墨西哥湾白垩系沉积有机质中异常高C31-C32升藿烷的检出及其生物地球化学意义
周珂亮, 孙 逊, 孙永革*
墨西哥湾白垩系沉积有机质中异常高C31-C32升藿烷的检出及其生物地球化学意义
周珂亮1, 孙 逊2, 孙永革1*
(1. 浙江大学 地球科学学院, 浙江 杭州 310027; 2. 得克萨斯大学奥斯汀分校 经济地质研究所, 美国 得克萨斯州 奥斯汀 78758)
地质体中藿烷类化合物以17αβ-藿烷系列为主, 且C31+升藿烷相对含量通常呈现出随碳数增加而减小的特征。本文报道了美国墨西哥湾下白垩统Aptian-Albian阶碳酸盐岩可溶有机质中异常高C31-C32升藿烷的检出(17α-C31>C30)。与含正常藿烷系列的碳酸盐岩相比, 该类低TOC含量碳酸盐岩中可溶有机质表现为低-C17/-C21值、5α(H),14α(H),17α(H)-C29规则甾烷优势、C同位素组成偏重、高Pr/Ph和Ts/Tm值等特征。结合碳酸盐岩沉积背景和可溶有机质中甲基藿烷的分布特征, 提出该类沉积有机质发育于偏氧化的近岸浅水环境, 沉积环境演变导致的生源变化是促使异常高C31-C32升藿烷分布的主要因素, 其来源可能与某种异养细菌优势有关。
C31-C32升藿烷; 微生物; 甲基藿烷; 沉积环境
0 引 言
藿烷类化合物是一类指示原核生物细菌贡献的生物标志化合物, 在不同时代地层中广泛分布且不受沉积环境等因素的限制, 因而被认为是地质体中普遍存在、种类最多、最丰富的五环三萜类化合物, 同时又具有特殊的生源和环境指示意义(Ourisson et al., 1979, 1987; Ourisson and Albrecht, 1992; Rohmer et al., 1992)。常见具有藿烷骨架的生物标志化合物包括不同立体构型的藿烷、甲基藿烷、脱甲基藿烷、开环藿烷、六环藿烷、重排藿烷、苯并藿烷等(Rullkotter and Wendisch, 1982; Schmitter et al., 1982; Hussler et al., 1984; Connan and Dessort, 1987; Summonsand Jahnke, 1990, 1992; Moldowan et al., 1991; 盛国英等, 2019)。藿烷构型化合物的分布与组成所携带的地质地球化学信息不仅是石油勘探中油–油对比、油–源对比、有机质热成熟度判断、油气运移成藏等研究的基础, 而且已广泛应用于第四纪地质学、环境科学、生物地球化学、考古学等相邻学科(Peters et al., 2005)。
沉积有机质中常见的藿烷是17α(H),21β(H)系列(αβ藿烷), 碳数分布主要介于C27~C35之间, 在/191质量色谱图上往往以C30αβ藿烷为主峰(偶见C29), 并以C30+藿烷降序分布为特征, C35+的藿烷较为少见(Rullkötter and Philp, 1981; Wang et al., 1996; Zhu et al., 2020)。盐湖相或海相碳酸盐岩沉积有机质中易见C34αβ或C35αβ藿烷相比于C32αβ或C33αβ藿烷的异常升高, 俗称“翘尾巴”(Boon et al., 1981; Connan et al., 1986; Fu et al., 1986; Clark and Philp, 1989)。本文报道了发现于墨西哥湾白垩系沉积有机质中异常高C31-C32升藿烷的分布, 并对其来源进行了初步探讨。
1 样品与实验
1.1 地质背景与样品分布
样品取自美国墨西哥湾石油探井Dix井。该井位于得克萨斯州南部、墨西哥湾北部被动大陆边缘Llano火山高原南部50 km处的Comanche台地(McFarlan and Menes, 1991)。该井东部为East Texas盆地, 西部为Maverick盆地, 从中新世至今一直处于隆生剥蚀阶段, 区域缺失大部分晚白垩世地层, 但Dix井早白垩世Aptian-Albian期的碳酸盐岩地层保存完好(Galloway et al., 1982; Fullmer and Lucia, 2005)。探井在深度1268.14~1342.59 m完整取心, 从下到上定义为Sligo、Pine Island、Jame、Bexar、Glen Rose 5个段。其中Sligo、James和Glen Rose段以灰色碳酸盐岩为主, Pine Island和Bexar段为富有机质黑色页岩。本研究分析的8件岩石样品取自该钻井剖面(表1)。
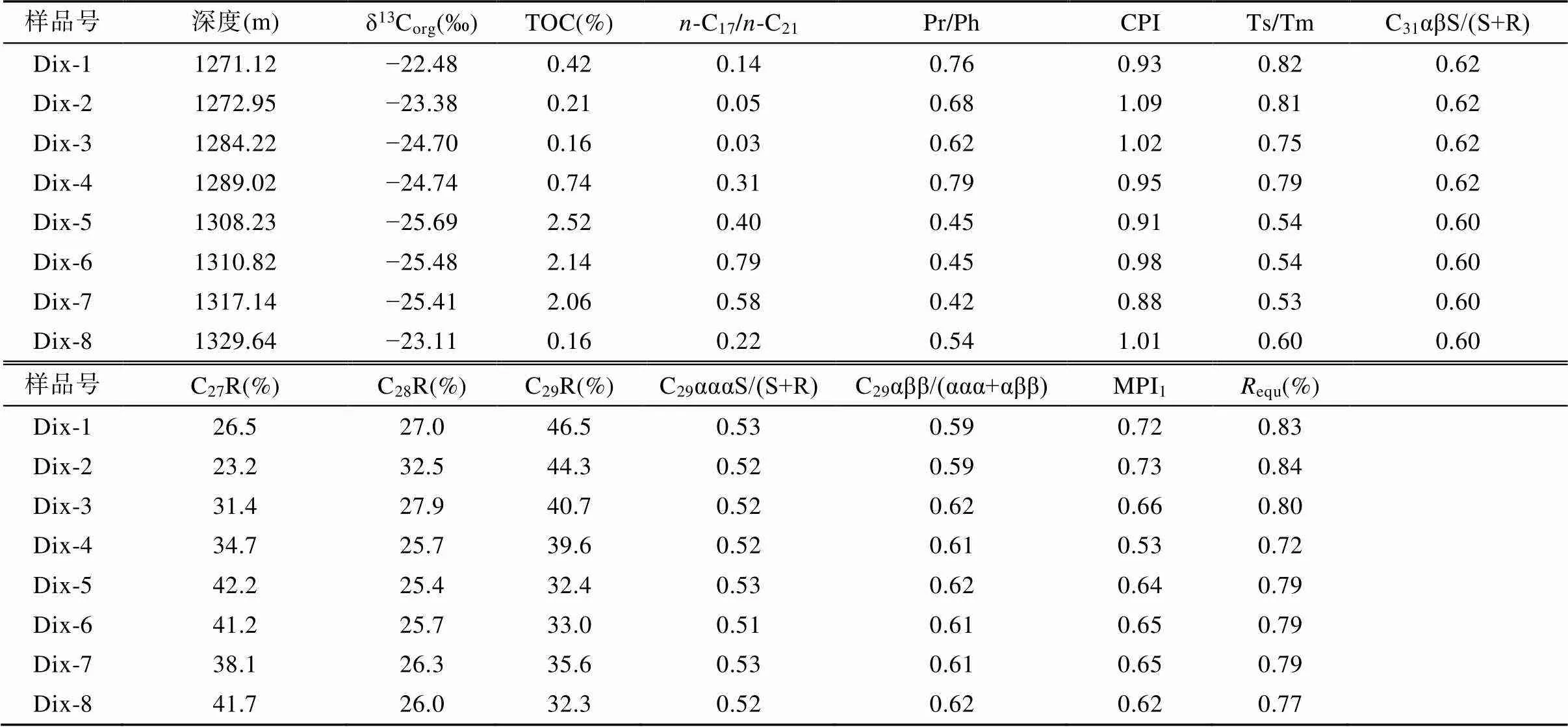
表1 墨西哥湾Dix井白垩系沉积有机质基本地球化学参数表
注: Pr. 姥鲛烷; Ph. 植烷; Ts. 18α(H)-22,29,30三降新藿烷; Tm. 17α(H)-22,29,30三降新藿烷; C31αβ. 17α(H),21β(H)-21-异丁基藿烷; C27R. C27规则甾烷; C28R. C28规则甾烷; C29R. C29规则甾烷; C29ααα. 5α(H),14α(H),17α(H)-24-乙基胆甾烷; C29αββ. 5α(H),14β(H),17β(H)-24-乙基胆甾烷。CPI=1/2×[∑(-C25~-C33)奇数/∑(-C24~-C32)偶数+∑(-C25~-C33)奇数/∑(-C26~-C34)偶数]; MPI1=1.5×(3-甲基菲+2-甲基菲)/(菲+9-甲基菲+1-甲基菲);equ=0.6×MPI1+0.4。
1.2 岩石总有机碳及稳定C同位素测定
将岩石样品用去离子水洗净, 置于45 ℃烘箱内烘干后用二氯甲烷冲洗表面, 放置通风橱自然挥发干燥后粉碎至200目备用。称取1.5 g左右的岩石粉末样品, 加入足量6 mol/L的盐酸, 于60 ℃水浴加热12 h, 以除去岩石中碳酸盐矿物, 然后用去离子水反复润洗, 直至溶液pH=7, 低温烘干后准确称量。除去碳酸盐的样品用Euro EA 3000元素分析仪测量总有机碳(TOC)含量, 岩石样品TOC值最终由样品除碳酸盐前后的质量计算得到。另取部分去除碳酸盐的样品进行总有机碳同位素(δ13Corg)分析, 使用连接有FLASH 2000有机元素分析仪的MAT-253同位素比值质谱仪进行检测, 测试精度±0.2‰, VPDB标准。
1.3 岩石可溶有机质的提取和分离
索氏抽提法提取氯仿沥青“A”, 用石油醚(30~ 60 ℃)沉淀去除沥青质, 将去除沥青质的部分进行硅胶–氧化铝柱层析, 以石油醚(30~60 ℃)、苯和甲醇作为洗脱液, 分别获得饱和烃、芳香烃和非烃组分。其中饱和烃组分通过尿素络合法进一步分离为正构烷烃和异构–环烷烃组分(Sun et al., 2005)。
1.4 生物标志化合物分析
对异构–环烷烃组分进行气相色谱–质谱(GC-MS)分析以获得生物标志化合物组成和分布特征。仪器为安捷伦7890B-5977A GC-MS联用仪。色谱柱使用DB-1MS弹性石英毛细管柱(60 m×0.32 mm×0.25 µm),色谱进样口温度290 ℃, 无分流模式进样, He为载气, 恒流1 mL/min。色谱升温程序: 初始温度60 ℃, 保留1 min, 先以3 ℃/min的速率升至210 ℃, 然后以2 ℃/min的速率升至295 ℃, 恒温30 min, 共用时123.5 min。离子源温度230 ℃, 电子轰击源(EI, 70 eV),质谱扫描采用全扫描加选择性离子扫描(Scan+SIM)模式, 扫描范围30~650, 选择离子分别为:/191、205、217、218、231、232。
气相色谱–质谱–质谱(GC-MS-MS)分析仪器为Agilent 7010B GC-MS-MS仪, 色谱柱使用DB-1MS弹性石英毛细管柱(60 m×0.32 mm×0.25 µm), He为载气, 恒速1 mL/min。色谱升温程序: 初始温度60 ℃,保留1 min, 先以3 ℃/min的速率升至220 ℃, 然后以2 ℃/min的速率升至300 ℃, 恒温30 min, 共用时124.33 min。离子源为EI模式, 条件为230 ℃、70 eV, 传输线温度300 ℃。质谱扫描方式为MRM模式。αβ藿烷检测方法为, 母离子: 370+14(=0, 1, 2…8), 子离子: 191; 甲基藿烷检测方法为, 母离子: 384+14(=0, 1, 2…8), 子离子: 205。
2 结果与讨论
2.1 岩石有机质的基本特征与生源组成
8件岩石样品TOC为0.16%~2.52%(表1)。可溶有机质中正构烷烃的分布范围为-C13~-C35, 呈现双峰型分布模式, 主峰碳为-C17和-C21,-C25+正构烷烃相对含量较低(图1a、b)。正构烷烃的碳优势指数CPI值为0.91~1.09(表1), 指示成熟有机质特征。规则甾烷C29ααα异构化参数20S/(20S+20R)在0.52左右, C29αββ/(ααα+αββ)值在0.61左右(表1), 对应等效镜质组反射率equ为0.7%~0.8%(Peters et al., 2005)。同时, 通过芳烃甲基菲指数(Radke and Welte, 1983)换算获得equ为0.72%~0.84%(表1), 两者结果较为一致。因此, 岩石可溶有机质中正构烷烃的双峰型分布和短链与中等链长正构烷烃在相对含量上的优势占比基本能够反映原始有机质的生源构成。已有研究表明, 浮游藻类产生的正构烷烃以短链奇碳数正构烷烃(-C15、-C17、-C19)为主(Giger et al., 1980); 大型水生植物产生的正构烷烃以中等链长奇碳数正构烷烃(-C21、-C23、-C25)为主(Ficken et al., 2000); 而高等植物产生的正构烷烃以长链奇碳数正构烷烃(-C27、-C29、-C31)为主(Prahl et al., 1994)。由此可见, 本次研究样品沉积有机质以水生生物输入为主, 陆生植物输入相对较少。
根据C27~C29规则甾烷的相对含量, 8件岩石样品可以分为2组, 2组样品之间C28规则甾烷相对含量基本不变, 第1组样品Dix-1~4以C29>C27为特征, 第二组样品Dix-5~8则相反(表1; 图2)。传统意义上, C27甾烷主要来自浮游藻类和浮游动物, C28甾烷主要来自含叶绿素II的浮游藻类, C29甾烷则主要来源于陆生高等植物(Volkman, 1986)。现有热成熟度和可溶有机质中相对较低的高碳数正构烷烃(图1a、b), 共同指示了极少的陆源输入。因此, 岩石可溶有机质中 C29甾烷可能更多地反映了底栖宏观藻类的贡献(Volkman et al., 1998; Kodner et al., 2008; Volkman, 2016)。但无论如何, 第2组样品有更显著的水生浮游藻类输入。与此相对应的是, 第2组样品中检出相对更高含量的4-甲基甾烷(图1c、d)。C28~C30的4-甲基甾烷同系物被认为主要来源于藻类, 特别是甲藻(Wolff et al., 1986; Volkman et al., 1990)。如果以-C17代表水生浮游藻类输入,-C21代表大型水生植物宏观底栖藻类输入, 那么-C17/-C21值不仅与规则甾烷C27-C28-C29的分布有很好的对应关系, 而且除个别样品外, 与岩石TOC也具有一致性, 即-C17/-C21值越大, 岩石TOC越高(表1), 说明浮游藻类很可能是岩石TOC的主要贡献者。

图1 墨西哥湾Dix井白垩系沉积有机质饱和烃色谱图(a、b), 甾烷(c、d)和萜烷(e、f)分布特征

图2 墨西哥湾Dix井白垩系沉积有机质C27-C28-C29规则甾烷分布三角图
上述生源输入的差异同样体现在δ13Corg组成上。第1组样品由于有机质中底栖宏观藻类相对贡献的增加, 更浅的水体环境使得有机质降解作用增强, 导致δ13Corg组成显著偏重(−22.5‰ ~ −24.7‰)。第2组样品由于浮游藻类相对贡献的增加, 使得δ13Corg组成偏轻, 除Dix-8号样品外, 其余3件样品的δ13Corg低于−25‰(表1)。Dix-8号样品有更低的-C17/-C21值, 以及更低的TOC值。第2组样品偏轻的δ13Corg组成可能与浮游藻类光合作用过程中利用了水柱和沉积物中有机质降解产生的富12C的CO2有关(Freeman et al., 1990; Collister et al., 1992)。
2.2 异常高C31-C32升藿烷的分布及其可能成因
研究样品岩石可溶有机质中萜类化合物的分布揭示8件样品均具有相对高丰度五环三萜类化合物、低丰度三环萜类化合物的特点(图1e、f)。三环萜类化合物碳数分布主要介于C20~C29之间。五环三萜类化合物主要是17αβ-藿烷系列化合物, 伽马蜡烷仅有微量检出, 未检出其他陆源三萜类。微量伽马蜡烷可能与Dix井所在位置有关, 下白垩统Aptian-Albian阶主要发育近岸浅水碳酸盐岩沉积, 可溶有机质中较高的重排甾烷含量(图1c、d)从一个侧面指证了这种沉积背景, 可能与近岸大量陆源黏土矿物输入引起的催化效应有关(Sieskind et al., 1979), 因此难以形成水体分层(Galloway et al., 1982; Fullmer and Lucia, 2005)。
众所周知, 地质样品中升藿烷相对含量通常具有C30(或C29)的明显优势且呈现出随着碳数的增加而减小的特征。通常αβ藿烷系列异常分布是指C34或C35相比于C32或C33的异常升高, 俗称“翘尾巴”, 主要出现盐湖相或海相碳盐岩沉积有机质中(Boon et al., 1981; Connan et al., 1986; Fu et al., 1986; Clark and Philp, 1989)。然而, 本研究部分样品具有异常高C31-C32升藿烷含量, C31升藿烷的丰度甚至超过了C30藿烷(图3a、b)。
地质体中藿烷主要来自于原核细菌细胞膜内的藿醇类化合物, 其在生物体内的作用类似于真核藻类体中的甾醇, 起固定和支撑作用。藿烷类化合物的细菌母源非常广, 包括蓝细菌、异养细菌、甲烷营养菌和化学自养菌等(Ourisson et al., 1987; Ourisson and Albrecht, 1992; Sinninghe Damsté and Schouten, 1997)。同时, 某些高等植物、地衣和蕨类植物也可以合成藿烷类化合物(如里白烯), 成为低碳数藿烷的母源(Rohmer et al., 1992)。虽然Dix井下白垩统Aptian-Albian阶主要发育近岸浅水沉积, 但较低陆生植物输入表明其不构成藿烷类化合物的主要贡献者。异常高C31-C32升藿烷可能主要与微生物的贡献有关。详细的对比研究发现, 在这8件岩石样品中, 具有异常高C31-C32升藿烷含量的4件样品相比于其余4件样品, 其生物标志化合物组合具有以下特征: 低-C17/-C21值、C29ααα规则甾烷优势、低TOC含量、C同位素组成偏重、高Pr/Ph和Ts/Tm值等(表1)。上述生物标志化合物组成上的差异性, 一方面反映了二者在生源构成上的不同; 另一方面反映了这种生源组成差异主要是由沉积环境的演变所致。尽管Dix井下白垩统Aptian-Albian阶总体属于近岸浅水沉积, 但更低的-C17/-C21值以及相对高的Pr/Ph和Ts/Tm值, 指示具有异常高C31-C32升藿烷分布的岩石沉积于更浅的氧化水体环境, 大型底栖藻类(如现代近岸浅水环境的褐藻)是沉积有机质的主要贡献者, 这一生态背景为浅水环境中微生物藻席的形成提供了先天条件。GC-MS-MS分析显示, 岩石可溶有机质中普遍检出2α-甲基藿烷和3β-甲基藿烷系列化合物(图4), 分别指示了蓝细菌和甲烷营养菌在当时沉积环境中的繁育。但是3β-甲基藿烷的含量要高出2α-甲基藿烷1个数量级(图4), 说明沉积期间氧化水体环境具有较高的生产力, 产甲烷菌在水体中产生甲烷流, 近岸淡水稀释下的低硫水体为甲烷营养菌的繁盛创造了机会(Blumenberg et al., 2007)。这种藻类有机质的快速降解不仅导致低TOC岩石的沉积, 而且异常高C31-C32升藿烷必定来自于某种优势微生物种属, 很有可能是某一类异养细菌, 进一步对升藿烷分子的C同位素组成进行测定有望成为解决这一问题的关键。

(a) C30~C35αβ藿烷的相对占比, 其中C31+αβ升藿烷计算时取22S和22R之和的平均值; (b) C31+αβ升藿烷与C30αβ藿烷的比值。
3 结 论
(1) 在美国墨西哥湾下白垩统Aptian-Albian阶的碳酸盐岩中检出了异常高C31-C32升藿烷的分布(17α-C31>C30)。
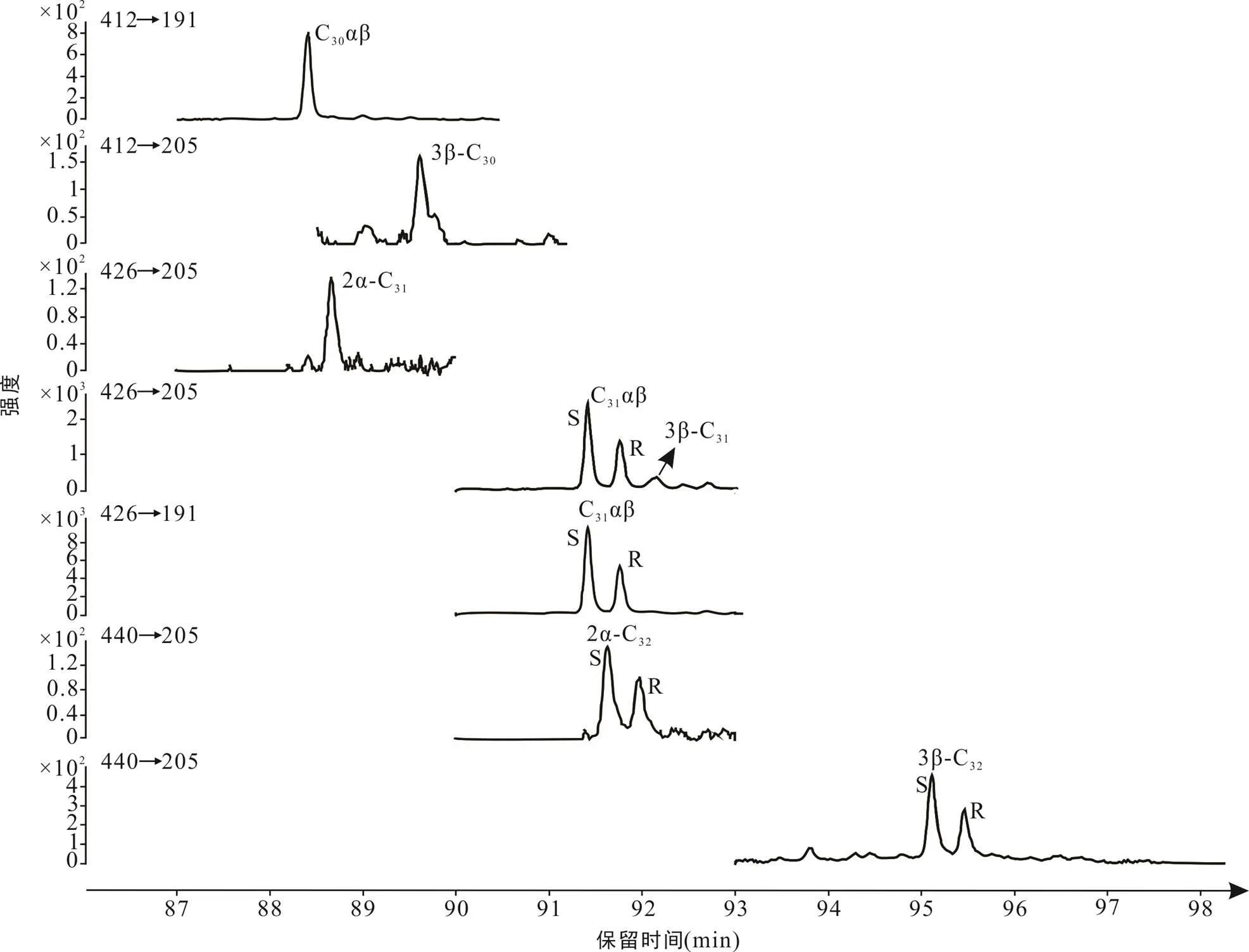
图4 墨西哥湾Dix井白垩系沉积有机质Dix-4样品异构烷烃C30-C31 17αβ-藿烷、C31-C32 2α-甲基藿烷和C30-C323β-甲基藿烷GC-MS-MS色谱图
(2) 沉积有机质生物标志化合物对比分析表明沉积环境演变导致的生源变化是促使异常高C31-C32升藿烷分布的主要因素。
(3)异常高C31-C32升藿烷的形成可能与异氧细菌有关, 但仍需进一步的工作证实。
致谢:实验过程得到浙江大学夏天、朱长凤博士的诸多帮助; 中国石油化工股份有限公司石油勘探开发研究院无锡石油地质研究所张志荣研究员和另一位匿名审稿专家对本文进行了详细审阅, 并提出了宝贵意见, 提高了论文质量, 在此一并致谢!
盛国英, 卢鸿, 廖晶, 彭平安. 2019. 地质体中藿烷类新化合物研究进展. 地球化学, 48(5): 421–446.
Blumenberg M, Seifert R, Michaelis W. 2007. Aerobic methanotrophy in the oxic-anoxic transition zone of the Black Sea water column., 38(1): 84–91.
Boon J J, Hine S H, Burlingame A, Klok J, Rijpstra W, Leeuw J D, Edmunds K, Eglinton G. 1981. Organic geochemical studies of Solar Lake laminated cyanobacterial mats // Bjoroy M, Albrecht C, Cornford C. Advances in Organic Geochemistry. New York: John Wiley & Sons: 207–227.
Clark J P, Philp R P. 1989. Geochemical characterization of evaporite and carbonate depositional environments and correlation of associated crude oils in the Black Creek Basin, Alberta., 37(4): 401–416.
Collister J W, Summons R E, Lichtfouse E, Hayes J M. 1992. Anisotopic biogeochemical study of the green river oil shale., 19(1–3): 265–276.
Connan J, Bouroullec J, Dessort D, Albrecht P. 1986. The microbial input in carbonate-anhydrite facies of a sabkha palaeoenvironment from Guatemala: A molecular approach., 10(1–3): 29–50.
Connan J, Dessort D. 1987. Novel family of hexacyclic hopanoid alkanes (C32–C35) occurring in sediments and oils from anoxic paleoenvironments., 11(2): 103–113.
Ficken K J, Li B, Swain D L, Eglinton G. 2000. An-alkane proxy for the sedimentary input of submerged/floating freshwater aquatic macrophytes., 31(7–8): 745–749.
Freeman K H, Hayes J M, Trendel J M, Albrecht P. 1990. Evidence from carbon isotope measurements for diverseorigins of sedimentary hydrocarbons., 343(6255): 254–256.
Fu J M, Sheng G Y, Peng P A, Brassel S B, Eglinton G, Jiang J G. 1986. Peculiarities of salt lake sediments as potential source rocks in China., 10(1–3): 119–126.
Fullmer S, Lucia F J. 2005. Burial history of central Texas Cretaceous Carbonates., 55: 225–232.
Galloway W E, Henry C D, Smith G E. 1982. Depositional framework, hydrostratigraphy, and uranium mineralizationof the Oakville sandstone (Miocene), Texas coastal plain., 113: 1–55.
Giger W, Schaffner C, Wakeham S G. 1980. Aliphatic and olefinic hydrocarbons in recent sediments of Greifensee, Switzerland., 44(1): 119–129.
Hussler G, Albrecht P, Ourisson G. 1984. Benzohopanes, a novel family of hexacyclic geomarkers in sediments and petroleums., 25(11): 1179–1182.
Kodner R B, Pearson A, Summons R E, Knoll A H. 2008. Sterols in red and green algae: Quantification, phylogeny, and relevance for the interpretation of geologic steranes., 6(4): 411–420.
McFarlan E J, Menes L S. 1991. Lower Cretaceous // Salvador A. The geology of North America. Boulder: Geological Society of America: 181–204.
Moldowan J M, Fago F J, Carlson M K, Yong D C, Duvne G A, Clardy J, Schoell M, Pillinger C T, Watt D S. 1991. Rearranged hopanes in sediments and petroleum., 55(11): 3333–3353.
Ourisson G, Albrecht P. 1992. Hopanoids. 1. Geohopanoids: The most abundant natural products on Earth?, 25(9): 398–402.
Ourisson G, Albrecht P, Rohmer M. 1979. The hopanoids: Palaeochemistry and biochemistry of a group natural products., 51(4): 709–729.
Ourisson G, Rohmer M, Poralla K. 1987. Prokaryotic hopanoidsand other polyterpenoid sterol surrogates., 41(1): 301–333.
Peters K E, Walters C C, Moldowan J M. 2005. The Biomarker Guide (The second edition). Cambridge: Cambridge University Press: 1–1155.
Prahl F G, Ertel J R, Goni M A, Sparrow M A, Eversmeyer B. 1994. Terrestrial organic carbon contributions to sedimentson the Washington margin., 58(14): 3035–3048.
Radke M, Welte H D. 1983. The methylphenanthrene index (MPI): A maturity parameter based on aromatic hydrocarbons., 10: 504–512.
Rohmer M, Bisseret P, Neunlis S. 1992. The hopanoids, prokaryotic triterpenoids and precursors of ubiquitous molecular fossils // Moldowan J M, Albrecht P, Philp R P. Biological Markers in Sediments and Petroleum. New Jersey: Prentice Hall: 1–17.
Rullkötter J, Philp P. 1981. Extended hopanes up to C40in Thornton bitumen., 292(5824): 616–618.
Rullkötter J, Wendisch D. 1982. Mircobial alteration of 17α(H)-hopanes in Madagascar asphalts: Removal of C-10methyl group and ring opening., 46(9): 1545–1553.
Schmitter J M, Sucrow W, Arpino P J. 1982. Occurrence of novel tetracyclic geochemical markers: 8,14-seco-hopanes in a Nigerian crude oil., 46(11): 2345–2350.
Sieskind O, Joly G, Albreche P. 1979. Simulation of the geochemical transformations of sterols: Superacid effect of clay minerals., 43(10): 1675–1679.
Sinninghe Damsté J S, Schouten S.1997. Is there evidence for a substantial contribution of prokaryotic biomass to organic carbon in Phanerozoic carbonaceous sediments?, 26(9): 517–530.
Summons R E, Jahnke L L. 1990. Identification of the methylhopanes in sediments and petroleum., 54(1): 247–251.
Summons R E, Jahnke L L. 1992. Hopenes and hopanes methylated in ring-A: Correlation of the hopanoids from extant methylotrophic bacteria with their fossil analogues // Moldowan J M, Albrecht P, Philp R P. Biological Markers in Sediments and Petroleum. New Jersey: Prentice Hal: 182–200.
Sun Y G, Chen Z Y, Xu S P, Cai P X. 2005. Stable carbon and hydrogen isotopic fractionation of individual-alkanes accompanying biodegradation: Evidence from a group of progressively biodegraded oils., 36(2): 225–238.
Volkman J K. 1986. A review of sterol markers for marine and terrigenous organic matter., 9(2): 83–99.
Volkman J K. 2016. Sterols in microalgae // Borowitzka M A, Beardall J, Raven J A. The Physiology of Microalgae. Berlin: Springer: 485–505.
Volkman J K, Barrett S M, Blackburn S I, Mansour M P, Sikes E L, Gelin F. 1998. Microalgal biomarkers: A review of recent research developments., 29(5–7): 1163–1179.
Volkman J K, Kearney P, Jeffrey S W. 1990. A new source of 4-methyl and 5α(H)-sterols in sediments: Prymnesiophytemicroalgae of the genus., 15(5): 489–497.
Wang P R, Li M W, Larter S R. 1996. Extended hopanes beyond C40in crude oils and source rock extracts from the Liaohe Basin, N.E. China., 24(5): 547–551.
Wolff G A, Lamb N A, Maxwell J R. 1986. The origin and fate of 4-methyl steroids — Ⅱ. Dehydration of stanols and occurrence of C304-methyl steranes., 10(4–6): 965–974.
Zhu C F, Cui X Q, He Y X, Kong L S, Sun Y G. 2020. Extended 3β-methylhopanes up to C45in source rocks from the Upper Cretaceous Qingshankou Formation, Songliao Basin, northeast China., 142, 103998.
Abnormally high abundance of C31-C32homohopanes in Cretaceous sedimentary organic matter from the Gulf of Mexico and its biogeochemical implications
ZHOU Keliang1, SUN Xun2, SUN Yongge1*
(1. School of Earth Science, Zhejiang University, Zhejiang 310027, Hangzhou, China; 2. Bureau of Economic Geology, The University of Texas at Austin, Austin 78758, Texas, USA)
The 17αβ-hopanes are major hopanoids in sedimentary rocks, generally showing a decreasing trend with increasing carbon numbers from C30to C35. This study reports an unusual distribution of 17αβ-hopanes with elevations of C31-C32homohopanes in carbonate rocks from the Early Cretaceous Aptian to Albian in the Gulf of Mexico in the United States. These low-TOC-content carbonate rocks were characterized by low-C17/-C21ratios, relatively high concentrations of 5α(H),14α(H),17α(H)-C29regular steranes, heavy stable carbon isotopes, and high Pr/Ph and Ts/Tm ratios. Considering the depositional background and the distributions of methylated hopanes in sedimentary organic matter, the sedimentary organic matter may have been deposited in a nearshore, shallow, and more oxidizing environment. The abnormal increase in C31-C32homohopanes could have resulted from the changes in biogenic sources caused by environmental evolution, and the abnormally high abundance of C31-C32homohopanes is due to an increase in heterotrophic bacteria.
C31-C32homohopanes; microbe; methylated hopanes; depositional environment
P593
A
0379-1726(2022)06-0659-08
10.19700/j.0379-1726.2022.06.005
2021-01-25;
2021-03-05
国家自然科学基金项目(42030803)资助。
周珂亮(1995–), 男, 硕士研究生, 地球化学专业。E-mail: zhoukl@zju.edu.cn
孙永革(1969–), 男, 教授, 主要从事石油有机地球化学和生物有机地球化学研究。E-mail: ygsun@zju.edu.cn

