lncRNA RP11-635L1.2在膀胱癌组织中的表达及对膀胱癌细胞增殖和侵袭的影响
鲁奕君,陈鸿凯,蔡 亮,吕 强,何 毅
膀胱癌是全球范围内最常见的泌尿系统恶性肿瘤,男性发病率明显高于女性[1]。随着诊疗水平的发展,膀胱癌患者的预后有所改善,由于膀胱癌的高复发率和侵袭性,多数膀胱癌患者的临床治疗效果较差[2]。探究膀胱癌恶性增殖和转移的调控因子,对提高膀胱癌患者5年生存率具有重要临床意义。长链非编码RNA(lncRNA)是一组大于200个碱基长度的内源性RNA分子,缺乏开放阅读框,不具有编码蛋白的能力[3]。近年来研究显示,lncRNA在转录和转录后可调节靶基因的表达,影响细胞的生理和病理过程[4]。大量研究显示,膀胱癌中存在多种lncRNA的异常表达,与膀胱癌细胞的活力、侵袭性、血管形成等过程相关,lncRNA可能成为膀胱癌发生和转移的分子诊断标志物[5-7]。RP11-635L1.2由748个碱基组成,定位于4号染色体。RP11-635L1.2在膀胱癌发病过程中的分子机制研究很少。本研究通过分析RP11-635L1.2在膀胱癌组织和细胞系中的表达水平,探究RP11-635L1.2对膀胱癌细胞生物学行为的作用及其分子机制。
1 材料与方法
1.1细胞系和试剂 膀胱癌细胞系MGH-U3、253J、J82、T24和永生化膀胱上皮细胞SV-HUC-1购于中国科学院上海细胞库;RPMI-1640培养基、DMEM培养基、CCK-8试剂盒、基质胶购于日本Takara公司;Lipofectamine 2000和胎牛血清购于美国Invitrogen公司;空载质粒(pcDNA3-NC)和RP11-635L1.2过表达质粒(pcDNA3-RP11-635L1.2)、qRT-PCR试剂盒购于上海吉玛制药技术有限公司;miR-NC和miR-373-3p mimics购于广州锐博生物科技有限公司;Transwell小室、双荧光报告载体野生型RP11-635L1.2和突变型RP11-635L1.2购于美国Promega公司;p-EGFR、p-AKT、p-ERK、p-JAK2、p-STAT3、α-Tubulin抗体购于美国Thermo Fisher Scientific公司。
1.2生物信息学技术分析 登录GEPIA数据库分析RP11-635L1.2在膀胱癌组织和癌旁正常组织中的表达水平,登录LncCeRBase数据库分析比较与RP11-635L1.2存在高度保守互补序列的微小RNA(miRNA)。
1.3细胞培养与转染 所有细胞置于37 ℃和5% CO2培养箱中,使用含10%胎牛血清的RPMI-1640培养基培养MGH-U3、J82、T24细胞,使用含10%胎牛血清的DMEM培养基培养253J和SV-HUC-1细胞。选取J82细胞对RP11-635L1.2进行功能性研究,分为NC组和RP11-635L1.2组,根据Lipofectamine 2000试剂盒说明书分别转染pcDNA3-NC质粒和pcDNA3-RP11-635L1.2质粒。
1.4qRT-PCR检测RP11-635L1.2和miR-373-3p的相对表达水平 采用Trizol法提取各细胞及转染后的2组J82细胞总RNA,进一步逆转录为cDNA。RP11-635L1.2表达水平以GAPDH为内参,miR-373-3p表达水平以U6为内参。设计引物序列,GAPDH上游引物:5'-GCACCGTCAAGGCTGAGAAC-3',下游引物:5'-ATGGTGGTGAAGACGCCAGT-3';RP11-635L1.2上游引物:5'-CTCTCTCCAAGTCCCAGTCG-3',下游引物:5'-TAGGAAGTTGGCAGGGAAGA-3';miR-373-3p上游引物:5'-GAAGTGCTTCGATTTTGCC-3',下游引物:5'-GAATACCTCGGACCCTGC-3';U6上游引物:5'-CTCGCTTCGGCAGCACA-3',下游引物:5'-AACGCTTCACGAATTTGCGT-3'。设置qRT-PCR反应条件:92 ℃ 40 s,58 ℃ 28 s,72 ℃ 28 s,循环36次,以2-ΔΔCt法计算RP11-635L1.2和miR-373-3p的相对表达水平。
1.5CCK-8法检测J82细胞增殖能力 将2组J82细胞以2×103个/孔的密度均匀接种在96孔板中,培养12 h至细胞贴壁。以细胞贴壁为0 d,分别于1、2、3、4、5 d的同一时刻更换新鲜培养基,在每孔中加入CCK-8试剂30 μl,震荡均匀。37 ℃避光环境孵育240 min,调整酶标仪波长为450 nm,检测每孔J82细胞的吸光度(A)值。
1.6Transwell实验检测J82细胞侵袭能力 2组J82细胞转染48 h后,采用磷酸盐缓冲液清洗4次,胰蛋白酶消化,细胞计数板计数。在Transwell上层小室铺一层基质胶,于培养箱中凝固。2组细胞按照2×104个/孔密度加至Transwell上层小室,在Transwell下层加入含30%血清的RPMI-1640培养基溶液700 μl,于培养箱中培养28 h。采用多聚甲醛凝固、结晶紫溶液染色,流水冲洗后室温晾干,在倒置显微镜下计数。
1.7双荧光素酶报告实验 选取对数生长期的J82细胞进行双荧光素酶报告实验,分别提取双荧光报告载体野生型RP11-635L1.2质粒和突变型RP11-635L1.2质粒,分别与miR-NC或miR-373-3p共转染至J82细胞。培养箱中转染52 h后,低温裂解细胞,分别测定细胞萤火虫荧光素酶和海肾荧光素酶表达强度,其比值即为相对荧光素酶活性。
1.8Western blot实验 吸去2组细胞培养基,磷酸盐缓冲液洗4次,每孔加细胞裂解液200 μl,冰浴裂解40 min,离心取上清蛋白。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白,以220 mA电流转膜至聚丙烯酰胺膜,封闭液封闭3.5 h,加入一抗p-EGFR(1∶1000稀释)、p-ERK(1∶2000稀释)、p-JAK2(1∶1000稀释)、α-Tubulin(1∶5000稀释)、p-AKT(1∶2000稀释)、p-STAT3(1∶1000稀释),孵育12 h。室温下与羊抗鼠二抗(1∶5000稀释)孵育3.5 h。加入化学显影液反应30 s,在凝胶成像仪中成像。

2 结果
2.1RP11-635L1.2在膀胱癌组织中的表达 与癌旁正常组织比较,膀胱癌组织中RP11-635L1.2的表达明显降低(P<0.01),见图1。
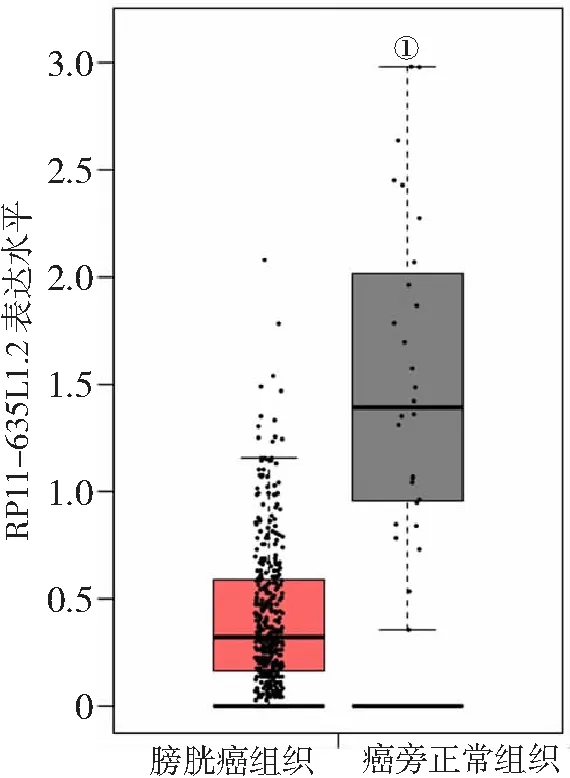
图1 膀胱癌组织和癌旁正常组织中RP11-635L1.2的表达
2.2RP11-635L1.2在膀胱癌细胞系中的表达 与永生化膀胱上皮细胞SV-HUC-1比较,膀胱癌细胞系MGH-U3、253J、J82、T24中RP11-635L1.2的表达水平明显降低(P<0.05,P<0.01),其中RP11-635L1.2在J82细胞中的表达水平最低,见图2。
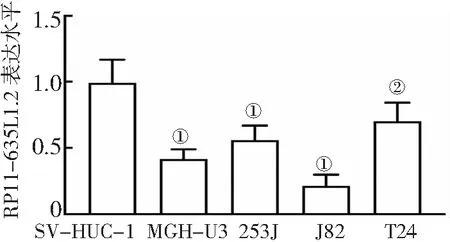
图2 膀胱癌细胞系中RP11-635L1.2的表达
2.3转染后J82细胞中RP11-635L1.2的表达情况 qRT-PCR检测结果显示,NC组和RP11-635L1.2组J82细胞中RP11-635L1.2表达水平分别为1.01±0.57和10.48±3.12,与NC组相比,RP11-635L1.2组J82细胞RP11-635L1.2表达水平明显升高(P<0.01)。
2.4RP11-635L1.2对J82细胞增殖的影响 CCK-8法检测显示,相比NC组,RP11-635L1.2组从第2日开始J82细胞增殖能力明显降低(P<0.05,P<0.01)。见图3。
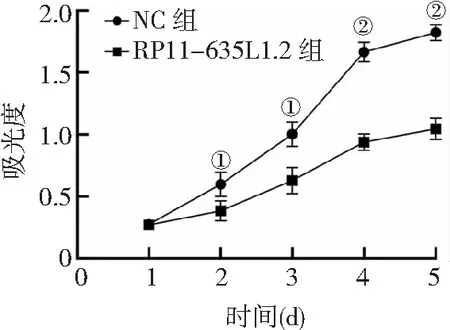
图3 RP11-635L1.2对膀胱癌J82细胞增殖的影响与NC组比较,①P<0.05,②P<0.01
2.5RP11-635L1.2对J82细胞侵袭能力的影响 Transwell实验显示,NC组和RP11-635L1.2组J82细胞侵袭量分别为(60.24±16.47)个和(24.32±11.30)个,与NC组相比,RP11-635L1.2组J82细胞侵袭量明显减少(P<0.01)。见图4。
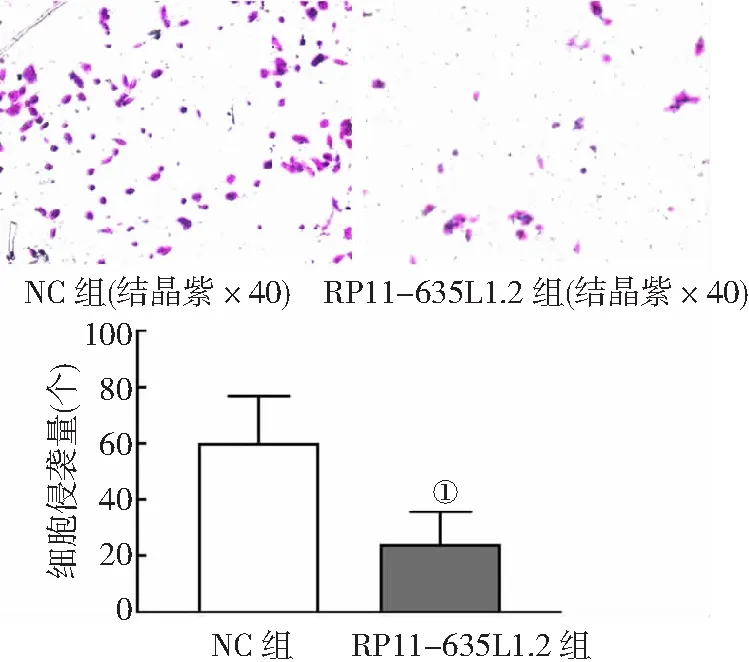
图4 RP11-635L1.2对膀胱癌J82细胞侵袭能力的影响
2.6RP11-635L1.2对miR-373-3p的靶向作用 利用LncCeRBase数据库预测,RP11-635L1.2与miR-373-3p存在互补结合的序列,见图5。双荧光素酶报告实验显示,野生型RP11-635L1.2与miR-373-3p共转染组荧光素酶活性明显低于与miR-NC共转染组(P<0.01),当RP11-635L1.2与miR-373-3p结合区域突变后,miR-373-3p对细胞的荧光素酶活性无明显影响(P>0.05)。见图6。

图5 RP11-635L1.2与miR-373-3p存在高度保守互补序列

图6 双荧光素酶报告实验结果
2.7RP11-635L1.2对miR-373-3p表达的影响 qRT-PCR检测结果显示,NC组和RP11-635L1.2组膀胱癌J82细胞miR-373-3p表达水平分别为5.12±1.28和0.99±0.35,过表达RP11-635L1.2抑制了J82细胞miR-373-3p的相对表达(P<0.01)。
2.8RP11-635L1.2对膀胱癌J82细胞EGFR/AKT信号通路蛋白表达的影响 相比NC组,RP11-635L1.2组EGFR/AKT信号通路蛋白p-EGFR、p-AKT、p-ERK、p-JAK2、p-STAT3表达量明显降低(P<0.01),见图7。

图7 RP11-635L1.2对J82细胞EGFR/AKT信号通路蛋白表达的影响
3 讨论
lncRNA的异常表达可显著影响细胞内癌基因或抑癌基因的表达,改变细胞的增殖活性、侵袭性、凋亡水平等,从而诱导肿瘤的发生[8-10]。目前研究证实,越来越多的lncRNA与膀胱癌发病密切相关[11-12]。LI等[13]研究发现,lncRNA LINC00355在膀胱癌组织中上调,尤其是在TNM分期较差的组织中,其高表达与膀胱癌患者的不良预后相关,沉默lncRNA LINC00355抑制了膀胱癌细胞的迁移、侵袭、上皮间充质转化过程。SHEN等[14]研究显示,与正常组织相比,膀胱癌组织中lncRNA MAGI2-AS3表达显著下调,并且与肿瘤分期和预后不良呈负相关,其过表达可抑制膀胱癌细胞的迁移和侵袭。YANG等[15]报道,lncRNA LINC01133在永生化膀胱上皮细胞外泌体中的表达明显高于在膀胱癌细胞中的表达,提示含有lncRNA LINC01133的外泌体通过诱导Wnt信号通路失活来抑制肿瘤细胞活力、迁移和侵袭。但在膀胱癌细胞增殖和侵袭过程中RP11-635L1.2的作用尚未明确。
本研究首先通过GEPIA数据库分析相关数据显示,RP11-635L1.2在膀胱癌组织中表达下调。在此基础上本研究通过qRT-PCR检测显示,与永生化膀胱上皮细胞相比,RP11-635L1.2在膀胱癌细胞系中表达下调,意味着RP11-635L1.2可能在膀胱癌的发病过程中发挥重要作用。本研究进一步通过体外培养J82细胞并给予RP11-635L1.2过表达质粒,结果表明RP11-635L1.2不仅能够抑制J82细胞的增殖能力,而且对细胞的侵袭能力表现出拮抗作用。
明确lncRNA的靶基因是探究lncRNA分子机制的重要环节[16]。近年来多项研究表明,lncRNA通过与miRNA 5'端互补配对结合,造成游离miRNA表达显著降低,从而调节肿瘤细胞的生长和上皮间充质转化[17-18]。本研究通过LncCeRBase生物数据库发现,RP11-635L1.2与miR-373-3p存在结合位点。研究显示,肾透明细胞癌组织中miR-373-3p表达高于相邻非肿瘤组织,其可促进细胞周期、抑制细胞凋亡和维持线粒体膜电位,起到促肿瘤作用[19]。与体检健康者相比,食管鳞状细胞癌患者术前血清miR-373-3p表达水平显著升高,而且miR-373-3p在癌组织中的表达水平显著高于癌旁正常组织,并指出miR-373-3p启动子甲基化水平在癌组织中显著降低是miR-373-3p异常高表达的原因[20]。由此可见,miR-373-3p可能是一种致癌基因。WANG等[21]研究显示,与邻近正常组织相比,膀胱癌组织中miR-373-3p表达水平升高,而且膀胱癌患者血清miR-373-3p表达水平高于体检健康者,提示miR-373-3p过表达能够促进膀胱癌细胞的增殖和侵袭。本研究通过双荧光素酶报告实验验证miR-373-3p与RP11-635L1.2之间存在靶向关系。同时,qRT-PCR检测发现miR-373-3p表达受RP11-635L1.2的负调控。此外,miR-373-3p可通过活化EGFR/AKT信号通路,促进膀胱癌的发生发展[21]。本研究还显示,过表达RP11-635L1.2后,EGFR/AKT信号通路蛋白p-EGFR、p-AKT、p-ERK、p-JAK2、p-STAT3表达减少,提示EGFR/AKT信号通路活化程度降低,进一步证实RP11-635L1.2是通过负调控miR-373-3p参与膀胱癌病理发展的。
综上,RP11-635L1.2在膀胱癌组织和细胞系中低表达,其通过负调控miR-373-3p抑制膀胱癌J82细胞的增殖、侵袭。RP11-635L1.2可能成为膀胱癌新的诊断标志物和治疗靶点。

