HER2阴性晚期胃癌患者外周血LMR、SII与PIV对生存结局的预测价值及预后影响因素研究
刘贤明,彭丽丽,任燕燕,王发艳,张洪珍
胃癌是一种常见的消化道恶性肿瘤。2020年,全球胃癌死亡人数高达76.9万人。在中国,胃癌是第五位常见癌症,占肿瘤相关死因的第三位[1]。由于胃癌早期症状不典型,并且缺乏有效的筛查手段,我国大部分胃癌患者确诊时已处于晚期,总体5年生存率不足40%[2]。因此,临床亟需更准确、更简单、更经济的预后评价指标。近年来,越来越多的证据表明,肿瘤相关炎症在肿瘤的发生发展中起着重要作用,免疫细胞和炎性细胞被认为是肿瘤微环境(TME)的重要组成部分[3]。外周血中性粒细胞、单核细胞、淋巴细胞和血小板,被认为可以导致肿瘤侵袭和转移,并且与多种肿瘤的进展密切相关[4-5]。既往研究报道,中性粒细胞-淋巴细胞比率(NLR)、血小板-淋巴细胞比率(PLR)、淋巴细胞-单核细胞比率(LMR)和全身免疫炎症指数(SII)与包括胃癌在内的多种肿瘤预后有关[6-7]。泛免疫炎症值(PIV)是最近发展起来的一种免疫炎症生物学标志物,由外周血中性粒细胞计数、血小板计数、单核细胞计数和淋巴细胞计数得出,已经被证实在晚期乳腺癌[8]、晚期结直肠癌[9]和晚期肺癌[10]中的预后评估价值要优于其他已知的预后指标,但其在局部晚期或转移性胃癌中的应用价值尚不清楚。本研究评估了PIV对接受一线化疗的人表皮生长因子受体2(HER2)阴性的局部晚期或转移性胃癌患者的预后评估价值,现报告如下。
1 资料与方法
1.1一般资料 选取2017年1月—2020年12月在河北省人民医院住院治疗的HER2阴性的局部晚期或转移性胃癌患者。纳入标准:①经组织学或细胞学检查确诊为HER2阴性胃腺癌患者;②院内多学科评估为无法根治性切除者;③行一线化疗前未接受任何形式的抗肿瘤治疗患者;④未出现感染征象或合并感染性疾病者;⑤有完整的病历和随访资料。排除标准:①临床资料欠缺;②合并可能影响治疗的基础疾病者;③有其他恶性肿瘤、血液系统疾病及自身免疫性疾病史者;④伴有感染性疾病及相关并发症者;⑤预计生存期≤3个月者。本研究经医院医学伦理委员会审查通过。
1.2研究方法 收集研究对象相关临床资料,包括性别、年龄、吸烟史、饮酒史、ECOG评分、肿瘤位置、分化程度、有无远处转移、治疗方案及治疗前外周血中性粒细胞、血小板、单核细胞、淋巴细胞计数和随访时间等。所有患者根据2017年美国癌症联合委员会(AJCC)指南(第8版)进行TNM分期。在接受一线化疗前3 d内采集患者清晨空腹外周血进行检测。PIV=中性粒细胞计数×血小板计数×单核细胞计数/淋巴细胞计数。SII=中性粒细胞计数×血小板计数/淋巴细胞计数;LMR=淋巴细胞计数/单核细胞计数。所有患者一线化疗方案均为XELOX方案(奥沙利铂130 mg/m2、d1,卡培他滨1000 mg/m2、d1~d14,每日2次,每21天重复)。
1.3随访情况 通过电话、短信与门诊结合的方式进行随访,随访开始时间为患者确诊时,末次随访时间为2021年12月31日或患者死亡日期。患者确诊后的前2年,每3个月随访1次;确诊后的3~5年,每半年随访1次;确诊后5年,每年随访1次。随访内容包括患者一般情况、血液学检查结果、内镜及影像学检查结果和生存结局等。总生存期(OS)定义为从确诊之日开始至死亡或末次随访时间。

2 结果
2.1LMR、SII、PIV最佳截断值的选取及预测价值 本研究共纳入符合条件的患者129例。截至随访结束,共有85例死亡。所有患者治疗前外周血中性粒细胞计数为(4.00±2.26)×109/L,淋巴细胞计数为(1.49±0.57)×109/L,单核细胞计数为(0.33±0.15)×109/L,血小板计数为(269.22±103.56)×109/L。根据ROC曲线确定治疗前LMR、SII及PIV用于预测HER2阴性晚期胃癌患者预后不良的最佳截断值,LMR最佳截断值为3.84,AUC为0.654(95%CI:0.553,0.755),敏感度为74.1%,特异度为54.6%;SII最佳截断值为726.3,AUC为0.677(95%CI:0.581,0.773),敏感度为58.9%,特异度为75.0%;PIV最佳截断值为122.4,AUC为0.717(95%CI:0.622,0.812),敏感度为89.4%,特异度为45.5%。见图1。

图1 PIV、SII及LMR预测HER2阴性晚期胃癌患者预后不良的ROC曲线
根据治疗前LMR、SII及PIV预测HER2阴性晚期胃癌患者预后不良的最佳截断值,将129例分为低LMR组54例(LMR<3.84)与高LMR组75例(LMR≥3.84);低SII组59例(SII<726.3)与高SII组70例(SII≥723.6);低PIV组48例(PIV<122.4)与高PIV组81例(PIV≥122.4)。
2.2LMR、SII及PIV与HER2阴性晚期胃癌患者临床病理特征的关系 LMR与HER2阴性晚期胃癌患者的年龄、性别、TNM分期有关(P<0.05)。SII与HER2阴性晚期胃癌患者的肿瘤位置、分化程度、TNM分期、远处转移有关(P<0.05)。PIV与HER2阴性晚期胃癌患者的性别、肿瘤位置、分化程度、远处转移、饮酒史有关(P<0.05,P<0.01)。见表1。
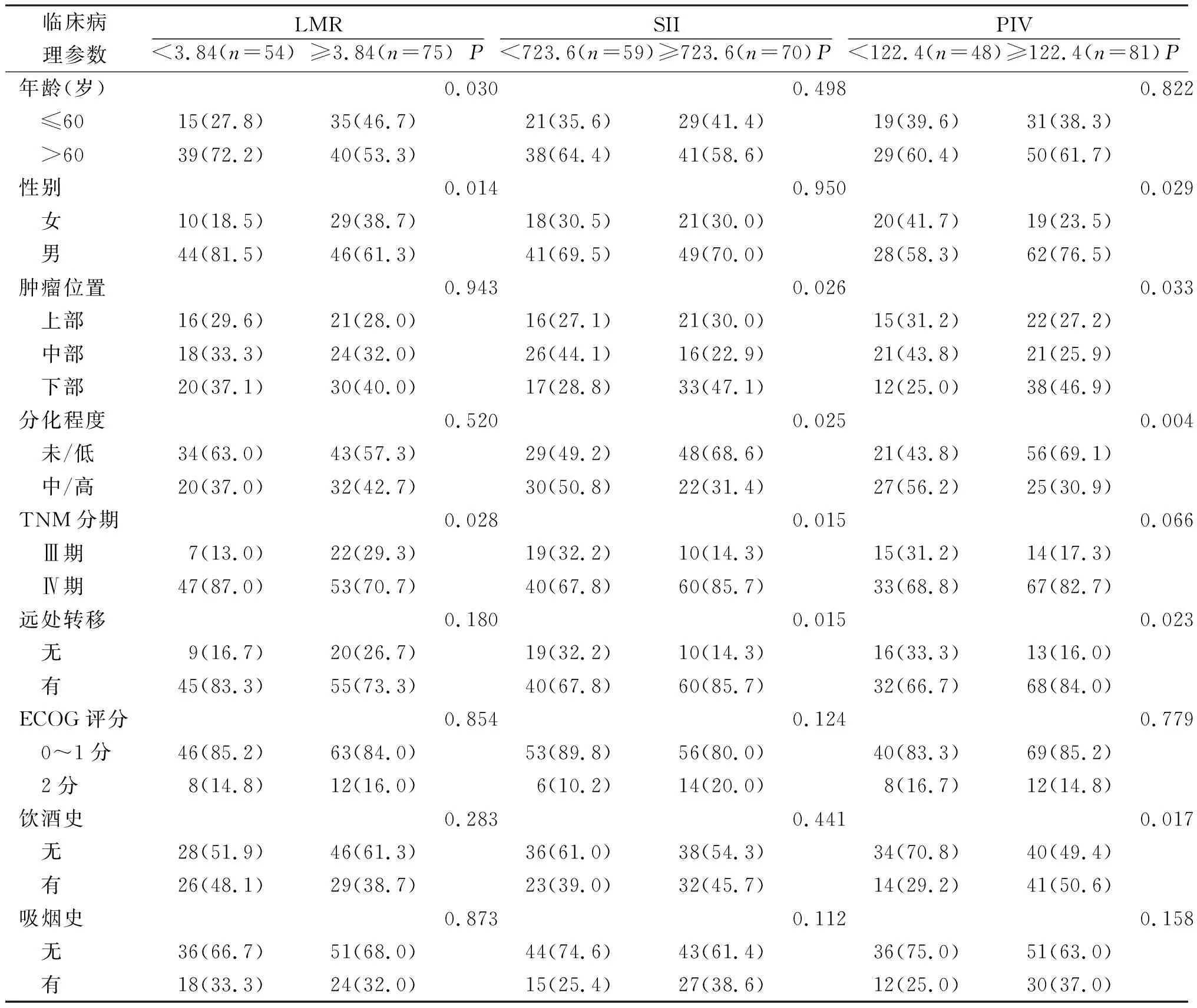
表1 LMR、SII及PIV与HER2阴性晚期胃癌患者临床病理特征的关系[例(%)]
2.3治疗前不同LMR、SII、PIV水平HER2阴性晚期胃癌患者生存曲线比较 129例OS为3~48个月,中位OS为9.6个月。Kaplan-Meier生存曲线显示,治疗前高PIV、高SII及低LMR提示患者预后不良。治疗前低PIV组OS为11.8~22.2个月,中位OS为17.0个月,高PIV组OS为7.8~12.2个月,中位OS为10.0个月,2组预后比较差异有统计学意义(P<0.05)。治疗前低SII组OS为14.2~17.8个月,中位OS为16.0个月,高SII组OS为8.8~11.3个月,中位OS为10.0个月,2组预后比较差异有统计学意义(P<0.05)。治疗前低LMR组OS为7.9~12.1个月,中位OS为10.0个月,高LMR组OS为12.3~17.7个月,中位OS为15个月,2组预后比较差异有统计学意义(P<0.05)。见图2。

图2 治疗前不同PIV、SII、LMR水平HER2阴性晚期胃癌患者的生存曲线
2.4HER2阴性晚期胃癌患者预后不良危险因素分析 通过单、多变量Cox比例风险模型分析进一步确定PIV、SII、LMR是否为HER2阴性晚期胃癌患者预后不良的危险因素。单因素分析表明,中/高分化程度、TNM分期Ⅳ期、有远处转移、高ECOG评分及治疗前高PIV、高SII及低LMR与HER2阴性晚期胃癌患者预后不良有关(P<0.05,P<0.01)。将上述有统计学意义的变量进一步纳入多变量Cox比例风险模型,结果显示高ECOG评分与治疗前高PIV是HER2阴性晚期胃癌患者预后不良的独立危险因素(P<0.05)。见表2。

表2 HER2阴性晚期胃癌患者预后不良的危险因素分析
3 讨论
自19世纪德国病理学家鲁道夫·维克肖等在肿瘤组织中发现了白细胞并提出炎症与肿瘤密切相关之后[11],近些年随着研究的不断深入,炎症与肿瘤之间的相关性逐渐被证实。全身炎症反应可以通过抑制细胞凋亡、促进血管生成和诱导DNA损伤来影响肿瘤的发展。然而,影响肿瘤形成的因素并非只有炎症。TME尤其是免疫环境,在调节肿瘤进展和抗肿瘤反应中起着重要作用。TME中的免疫细胞包括肿瘤相关巨噬细胞(TAMs)、骨髓来源的抑制细胞(MDSCs)、调节性T细胞(Treg)等免疫抑制细胞和细胞毒性T淋巴细胞、自然杀伤细胞(NK)等抗肿瘤效应细胞[12]。肿瘤有3种基本免疫表型:免疫沙漠型、免疫排斥型和免疫炎症型[13]。免疫炎症型肿瘤也被称为“热肿瘤”,其特征是高T淋巴细胞浸润、干扰素-γ信号通路增加、PD-L1表达和高肿瘤突变负荷(TMB);免疫沙漠型和免疫排斥型肿瘤被称为“冷肿瘤”。前者CD8+ T淋巴细胞位于侵袭边缘,故不能有效浸润肿瘤,后者肿瘤及周围均无CD8+ T淋巴细胞[14]。相同肿瘤的不同免疫表型患者,对治疗的反应也存在较大差异,将“冷肿瘤”转化为“热肿瘤”可能会使这些患者对当前化疗及后续的免疫治疗更敏感,从而产生客观的抗肿瘤反应[15]。
虽然中性粒细胞目前在肿瘤生物学中的作用仍有争议,但是已有研究证实其参与了肿瘤的进展和转移[16]。FRIDLENDER等[17]提出中性粒细胞可表现为N1型和N2型,N1型具有杀死肿瘤细胞的潜力,而N2型表达精氨酸酶和趋化因子配体2(CCL2)、CCL5、中性粒细胞弹性蛋白酶等促肿瘤因子,促进肿瘤细胞的侵袭和转移。特别是肿瘤相关中性粒细胞(TAN)被证明能够增强肿瘤细胞活性,促进血管生成,并且可以通过释放趋化因子和细胞因子来影响巨噬细胞的极化,在TME中起到募集和极化单核细胞/巨噬细胞的作用,进而影响肿瘤进一步恶化[18]。循环单核细胞是巨噬细胞的前体,并在组织中存在细胞因子和生长因子的情况下进行分化。TME的变化,如细胞因子、生长因子分泌及炎症、感染、损伤、缺氧等情况,可直接或间接影响M1型和M2型巨噬细胞的极化[19]。M1型巨噬细胞本质上是促炎细胞,在肿瘤早期阶段,该型细胞占优势,在TME中以抑制肿瘤细胞生长作用为主[20]。相关研究已表明,M1型巨噬细胞与肺癌[21]、结直肠癌[22]、卵巢癌[23]等的生存时间呈正相关。M2型巨噬细胞一般被认为是TAMs,其可通过分泌细胞因子、趋化因子和生长因子参与肿瘤细胞的生长与转移。而恶性细胞可分泌IL-10、血管内皮生长因子、血小板衍生生长因子等细胞因子,促进M2型巨噬细胞分化[19,24]。激活的肿瘤浸润T淋巴细胞在介导肿瘤细胞死亡和促进宿主免疫反应中的作用得到了广泛认可[25]。其中,细胞毒性T淋巴细胞能够选择性识别和杀死肿瘤细胞,是抗肿瘤免疫的关键参与者[26]。CD8+ T淋巴细胞在接收到来自树突状细胞呈递的抗原后,可被诱导成具有细胞毒性的效应CD8+ T淋巴细胞,从而影响肿瘤的发展[27]。另外,血小板作为转化生长因子β的来源、调节效应性免疫细胞激活、外渗及全身炎症的复杂相互作用网络的一部分,在肿瘤进展和免疫逃逸中具有多效性作用[28]。
不同的外周血细胞群可以反映全身和肿瘤局部的炎症和免疫状态。已有研究证明,在多种肿瘤患者中,与单个血细胞计数相比,2种及以上外周血细胞群组合的生物学标志物与患者预后的相关性更强[29-32]。作为一种新发现的炎性指标,PIV被发现与多种恶性肿瘤的预后相关[8-10],但其在胃癌尤其是局部晚期或转移性胃癌预后评估中的价值尚不清楚。在本研究中,我们回顾性分析了接受一线化疗的HER2阴性的局部晚期或转移性胃癌患者的临床病理资料与随访数据,评估了PIV与患者临床病理特征及预后的关系,结果发现PIV与患者性别、肿瘤位置、分化程度、远处转移及饮酒史有关,提示PIV在一定程度上反映了肿瘤细胞的侵袭性。更为重要的是,本研究显示HER2阴性晚期胃癌患者OS随PIV的升高而缩短,低PIV组1、2、3年生存率高于高PIV组。因此,PIV可作为评估HER2阴性晚期胃癌患者预后的一项独立预测指标。本研究结果还显示,外周血PIV预测HER2阴性晚期胃癌患者预后不良的价值较高,预测曲线的AUC为0.717,敏感度、特异度分别为89.4 %与45.5 %,较LMR、SII的预测价值要好。此外,本研究还显示治疗前高PIV是HER2阴性晚期胃癌患者预后不良的独立危险因素。提示外周血PIV可作为临床评估HER2阴性晚期胃癌患者预后的指标。PIV能够更全面捕获免疫环境的复杂性,或许有助于为晚期胃癌患者提供更为准确的预后分层,并作为接受一线化疗的晚期胃癌患者预后评估的有效工具。
已有相关研究报道了LMR、SII对胃癌患者预后的预测价值。郭梁等[33]研究表明,LMR低的患者总生存率和无病生存率要高于LMR高的患者。最新一项研究显示,术前LMR较低的患者应更频繁监测和更积极化疗[34]。而INOUE等[35]、WANG和ZHU[36]研究均表明,与低SII患者相比,高SII患者的OS更短,更易发生复发和远处转移,以及需要接受更长周期的辅助治疗。本研究显示,LMR与HER2阴性晚期胃癌患者的年龄、性别、TNM分期有关,SII与HER2阴性晚期胃癌患者的肿瘤位置、分化程度、TNM分期、远处转移有关。
然而,本研究也存在一定局限性:首先,本研究为单中心、小样本、回顾性研究,可能导致选择偏倚;其次,本研究未统计一线化疗后复发患者是否应用二线治疗及其对治疗结果的影响。因此,未来有必要继续开展多中心、大样本、前瞻性研究来进一步验证目前的结论。
综上,本研究发现PIV与HER2阴性晚期胃癌患者预后不良有关。由于PIV具有检测成本较低、临床易获得等优点,可作为很好的生物学标志物应用于临床,或许能为接受一线化疗的晚期胃癌患者提供更为准确的预后分层,有望成为一项评估患者预后的有效指标。

