反复超促排卵对老龄模型小鼠生殖能力的影响
赵 颖 章 勤 陈众芳 王如烨 马 景
Chambers 等[1]统计全球76 个国家体外受精和卵胞浆内单精子显微注射胚胎移植后分娩率分别为19.9%和24.3%,控制性卵巢刺激(control ovarian stimulation,COS)是主要影响因素之一[2]。COS 采用超生理剂量的促性腺激素,诱发多个卵子同时发育与成熟,从而获得更多的胚胎以用于移植[3]。超过4 次的COS 被称为反复促排[4-5]。研究发现,接受3 次以上的重复COS 可能导致卵母细胞数量显著减少,优胚数、植入率和临床妊娠率显著降低[6-7]。过度氧化应激引起活性氧(reactive oxygen species,ROS)在卵巢内的积累被认为可能是导致卵巢储备功能低下、卵母细胞损伤的机制之一。反复COS 不但能扰乱卵母细胞中纺锤体组织和染色体排列、改变早期胚胎中的组蛋白修饰,从而影响胚胎发育潜能[8-9],而且能明显升高卵巢ROS 水平,增加卵巢中的氧化应激和细胞凋亡,可能通过p16 和SIRT1/FOXO1 信号通路显著降低卵巢功能,但其对卵巢颗粒细胞功能、卵母细胞质量的影响仍无定论[10]。线粒体是ROS 最易影响的靶点,线粒体功能障碍可能导致受精失败、胚胎发育潜能下降,ROS 作为c-Jun 氨基末端激酶(c-Jun N-terminal protein kinase,JNK)的有效诱导剂,可能通过p53 作用介导细胞凋亡。因此,本实验从ROSJNK-p53-线粒体功能的角度探索反复超促排对老龄雌性小鼠卵巢功能的影响。
1 材料与方法
1.1 实验动物 30 只SPF 级7 月龄的雌性C57BL/6 小鼠(28~33 g),均从维通利华实验动物技术有限公司购买(证书号:SCXK 2019-0001)。小鼠在浙江中医药大学动物实验研究中心的屏障设施中以恒温、恒湿和自然光循环的条件饲养,实验通过浙江中医药大学伦理审查(批准编号:20201123-01)。
1.2 实验试剂与仪器 粉末型孕马血清促性腺激素(pregnant mare serum gonado-tropin,PMSG)试剂盒(江苏易核生物有限公司,批号2001A);粉末型人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)试剂盒(江苏易核生物有限公司,批号2003A);小鼠雌二醇(estradiol,E2)酶联免疫吸附剂测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(凡科维生物有限公司,批号21010279M);小鼠孕酮(progesterone,P)ELISA 试剂盒(凡科维生物有限公司,批号21010279M);小鼠抑制素B(inhibin-B,INHB)ELISA 试剂盒(凡科维生物有限公司,批号21022171M);ROS(DCFH-DA 探针)试剂盒(碧云天生物技术有限公司,批号112420201215);RT 反转录试剂盒(TAKARA,批号RR036Q),荧光定量试剂盒SYBR Premix Ex TaqTMⅡ(TAKARA,批号RR420L)。荧光倒置显微镜(蔡司,Axio Observer.A1);光学显微镜(Motic,AE2000);透射电子显微镜(HITACHI,H7650);荧光定量PCR 仪(ABI,Step-OnePlus)。
1.3 建立反复超促排小鼠模型 依据文献[5]将30只7 月龄的C57BL/6 雌鼠按照随机数字表法平均分成两组,其中15 只腹腔注射15 IU PMSG,48 h 后注射15 IU hCG,每周1 次,连续4 周。剩余15 只小鼠在实验结束前2 d 按促排流程腹腔注射PMSG 15 IU、hCG 15 IU 1 次。经历4 次COS 的老龄雌性小鼠为模型组,仅在实验结束前接受1 次COS 的老龄雌性小鼠为对照组。
1.4 ELISA 法检测血清中生殖激素水平 在最后1次COS 注射hCG 16 h 后,小鼠颌下静脉取血,室温静置1 h 后以3000 r/min 离心15 min,取上清,根据说明书,使用ELISA 检测试剂盒检测血清E2、P 和INHB 水平。
1.5 体式显微镜下观察卵母细胞形态、ROS 水平检测 在最后1 次COS 注射hCG 16 h 后解剖小鼠,取输卵管壶腹部置于含Hepes 缓冲液的试管中,壶腹部突起处用锋利的针头划开,使卵母细胞-颗粒细胞复合物(cumulus-oocyte complexs,COCs)滑出[11]。小鼠COCs 被放入含有透明质酸酶的预制Hepes 缓冲液中,消化5~10 min 后于体式显微镜下观察卵母细胞的数量和形态,收集并用于随后的实验;卵母细胞ROS 水平检测通过DCFH-DA 探针方法进行。卵母细胞在PBS 中用10 mM DCFH-DA 孵育20 min,每隔3~5 min 颠倒混匀,而后在37 ℃条件下PBS 洗3次,在荧光倒置显微镜下观察、拍照并用Image J 计算荧光强度。
1.6 HE 染色观察卵巢中各级卵泡及黄体数量 小鼠卵巢组织于4%甲醛固定后,脱水,石蜡包埋、切片,获得厚度为4 μm 的卵巢切片并进行苏木精-伊红(hematoxylin-eosin staining,HE)染色。光学显微镜下观察卵巢结构并进行卵泡计数并拍照。
1.7 透射电镜观察卵巢颗粒细胞超微结构 解剖小鼠后,1 min 内快速用眼科镊子分离一侧卵巢,并在冰上用手术刀片切下大小约1 mm×1 mm×1 mm 的卵巢组织,放入提前预冷的2.5%戊二醛中固定。经过漂洗、1%锇酸固定、脱水包埋、固化后,用超薄切片机获得约60 nm 切片并用醋酸铀-枸橼酸铅双染色,在透射电子显微镜下观察线粒体的形态,计算嵴模糊的线粒体及空泡征占比。
1.8 实时定量聚合酶链反应(RT-qPCR)检测卵巢JNK、Bcl2 关联X 蛋白(Bax)、人体抑癌基因(p53)、叉形头转录因子O 亚型(FOXO3a)mRNA 表达水平 取小鼠卵巢液氮冷冻,后移至-80 ℃冰箱冻存备用。取卵巢样品加入到1.5 mL 灭菌管中,加入裂解Buffer并进行组织破碎、吹打至无明显沉淀,RNA 提取试剂盒提取卵巢总RNA,RT 反转录试剂盒在普通PCR 仪中将mRNA 逆转录成为cDNA,用荧光定量试剂盒SYBR Premix Ex TaqTMⅡ配置反应体系,运用实时荧光定量PCR 仪进行扩增。条件:预变性95 ℃3 min;而后40 个循环(95 ℃10 s,60 ℃30 s);所有数据采用ABI StepOnePlus PCR 仪收集,转录水平通过公式2-△△CT计算,以β-actin 作为内参,引物由生工生物工程(上海)股份有限公司合成,引物设计见表1。

表1 RT-qPCR 引物设计
1.9 统计学方法 符合正态分布的实验数据以均数±标准差()表示,应用Prism Graphpad 统计软件进行分析,方差齐的数据通过独立样本t 检验分析组间差异,方差不齐者用秩和检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 E2、P、INHB 水平 与对照组比较,模型组小鼠的E2、P 及INHB 水平均显著降低(P<0.01)。见表2。
表2 各组小鼠血清E2、P、INHB 水平比较()

表2 各组小鼠血清E2、P、INHB 水平比较()
注:对照组接受1 次超促排;模型组接受4 次反复超促排;E2 为雌二醇;P 为孕酮;INHB 为抑制素B;与对照组比较,aP<0.01
2.2 超促排后获得卵子数量、破碎卵母细胞比率及ROS 值 与对照组比较,促排后模型组获得的卵子数量明显降低,其中破碎卵母细胞的比率明显升高(P<0.01)。模型组卵母细胞的ROS 值较对照组明显升高(P<0.01)。见表3 及图1、2。
表3 各组小鼠卵子数量、碎裂比率及卵母细胞ROS 水平比较()

表3 各组小鼠卵子数量、碎裂比率及卵母细胞ROS 水平比较()
注:对照组接受1 次超促排;模型组接受4 次反复超促排;ROS 为活性氧;与对照组比较,aP<0.01

图1 体式显微镜下的卵母细胞形态

图2 荧光倒置显微镜下卵母细胞ROS 荧光强度
2.3 卵巢各级卵泡及黄体数量及颗粒细胞线粒体形态 模型组小鼠卵巢中的原始卵泡较对照组明显减少(P<0.01),其发育卵泡(包括窦卵泡及成熟卵泡)均较对照组减少(P<0.05),而闭锁卵泡数量较对照组差异无统计学意义(P>0.05)(见表4 和图3)。模型组小鼠的黄体数量较对照组明显增多(P<0.05),透射电镜下可见对照组小鼠的颗粒细胞周围多为正常线粒体,其结构规则,呈圆形或杆状,嵴清晰完整。而模型组有较多异常线粒体,呈现肿胀、聚集、融合的状态,其嵴模糊或断裂,部分空泡化。相较于对照组,模型组线粒体空泡征及线粒体嵴模糊发生率更高(P<0.01),见表5 和图4。
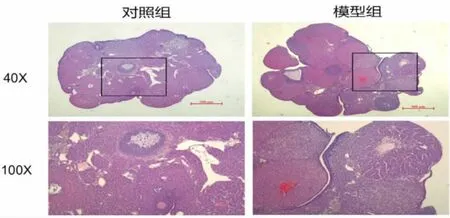
图3 卵巢病理图片(HE 染色)

图4 透射电镜下卵巢颗粒细胞超微结构(醋酸铀-枸橼酸铅双染色)
表4 各组小鼠原始卵泡、发育卵泡、闭锁卵泡及黄体数量比较(个,)
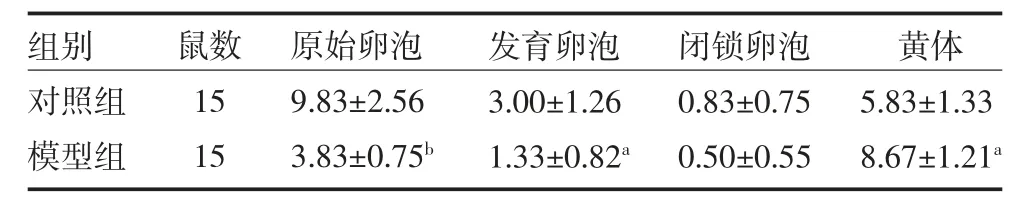
表4 各组小鼠原始卵泡、发育卵泡、闭锁卵泡及黄体数量比较(个,)
注:对照组接受1 次超促排;模型组接受4 次反复超促排;与对照组比较,aP<0.05,bP<0.01
表5 各组小鼠线粒体嵴模糊及空泡征发生率比较(%,)

表5 各组小鼠线粒体嵴模糊及空泡征发生率比较(%,)
注:对照组接受1 次超促排;模型组接受4 次反复超促排;与对照组比较,aP<0.01
2.4 卵巢中的凋亡相关基因表达情况 与对照组比较,模型组小鼠的JNK、p53、Bax mRNA 表达均升高(P<0.05),而FOXO3a mRNA 表达明显下降(P<0.01)。见表6。
表6 各组小鼠卵巢JNK、p53、Bax、FOXO3a 基因表达水平比较()

表6 各组小鼠卵巢JNK、p53、Bax、FOXO3a 基因表达水平比较()
注:对照组接受1 次超促排;模型组接受4 次反复超促排;JNK 为c-Jun 氨基末端激酶;p53 为人体抑癌基因;Bax 为Bcl2 关联X 蛋白;FOXO3a 为叉形头转录因子O 亚型;与对照组比较,aP<0.05,bP<0.01
3 讨论
高龄女性由于卵巢储备功能低下,在获得成功妊娠前不得不经历多次COS 以获得足够的优质胚胎。实验表明,经历4 次以上COS 的小鼠生育能力明显下降,抗苗勒管激素表达水平以及E2、P 浓度显著降低[4];影响卵丘细胞线粒体功能,从而降低卵巢功能,降低卵母细胞和胚胎质量,影响胚胎发育。本实验中,与经历1 次COS 相比,经历4 次COS 的老龄雌性小鼠E2、P 及INHB 水平降低,表明连续COS 降低了小鼠的生殖内分泌水平及卵巢储备功能。卵巢病理图片显示,连续4 次COS 使小鼠的原始卵泡、窦卵泡及成熟卵泡均减少,并使卵巢颗粒细胞线粒体形态发生异常改变、影响了线粒体的功能。通过观察我们发现,4次COS 雌性老龄模型小鼠异常卵子,尤其是破碎卵子的比率明显增高,而其卵子内ROS 水平也明显增加。我们推测,重复COS 可能导致雌性老龄模型小鼠的生殖器官受到强烈的氧化应激和损伤。
JNK 也称为应激激活蛋白激酶(SAPK),参与各种应激反应,尤其是导致氧化损伤的应激反应[12]。已有研究表明,在ROS 介导的细胞凋亡中,JNK 被激活并与p53 协同调节凋亡进程;同时,JNK 可通过Bax的线粒体易位增强Bcl2 促凋亡家族成员的功能。在应对氧化应激时,FOXO3a 磷酸化并促进ROS 清除剂的表达,而促其磷酸化的许多激酶也可作为JNK通路的上游激酶诱导一系列级联反应及应激细胞的凋亡[13-14]。本研究显示,由连续COS 导致的卵巢内ROS 过度累积,可诱导卵巢JNK、Bax、p53 mRNA 表达增加,FOXO3a mRNA 表达减低。
本研究表明,经过4 次COS 的老龄雌性小鼠雌孕激素水平下降、卵巢各级卵泡数减少,可能与卵巢内过度ROS 积聚,卵巢氧化应激水平激增,从而导致JNK、Bax、p53 等凋亡相关基因表达增加,颗粒细胞线粒体形态异常、功能紊乱有关。

