长远航人员咽部菌群分布特征
张 静,孙艺璇,李艳君
解放军总医院第六医学中心 检验科,北京 100048
随着航运经济发展,海上船只越来越多。海上环境高温高湿、淡水缺少,作业人员蔬菜水果摄入少,长期疲劳,容易导致机体的代谢能力和免疫功能降低,菌群分布发生变化。体表菌群的分布不同可能影响长远航人员的健康状况,从而在一定程度上影响海上作业能力[1-3]。菌群是指可以肉眼可见细菌或真菌形成的集团,正常菌群是指对人类无害的微生物群落,一般会在人的身体或健康动物的皮肤、 黏膜以及人体与外界相通的各种腔道中发现,其数量大、种类较稳定[4-5]。菌群与人类疾病存在密切的联系,菌群平衡被打破就会出现菌群失调,导致疾病的发生。本研究应用二代测序技术,对长远航人员不同航行阶段的咽部菌群测序进行种类和丰度分析,了解长远航人员咽部菌群分布以及随航行时间变化特征,为深入探讨随航症状以及某种疾病与菌群微生态相关性提供依据,进而为航海人员疾病的预防治疗以及后续深入研究积累基础数据。
对象与方法
1 研究对象 采集2017年9月- 2018年1月30名长远航人员在印度洋海域执行任务期间的咽部拭子,人员年龄20 ~ 53岁,男性18名,女性12名。其中包括医疗保障人员8名、船员8名、机组人员8名和后勤保障人员6名。采集的时间为航行前、航行中1个月、航行中3个月和航行中4个月,分别命名为1、2、3、4组,共120份样本,-80℃冰箱保存。
2 仪器与试剂 Qubit@2.0荧光计(Thermo Scientific);安捷伦生物分析仪2100 ions5tmxl;移液器;生物安全柜;Illumina Miseq测序仪;GeNeJET凝胶提取试剂盒(Turo SeaCo)。
3 基因组DNA提取 将拭子的棉签头剪下置于2 mL离心管,加入400 µL裂解缓冲液1;加入20 µL蛋白酶K和400 µL裂解缓冲液2,涡旋震荡15 s,充分混匀;56℃静置10 min,12 000 r/min离心(下同)15 s;加入400 µL无水乙醇振荡混匀,倒入吸附柱,离心1 min,弃废液;加入500 µL漂洗缓冲液1,离心1 min后弃废液;加入500 µL漂洗缓冲液2,离心3 min后弃废液;再次离心1 min;将吸附柱放入新的离心管,加入50 µL洗脱缓冲液,室温放置5 min;离心1 min收集DNA。采用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量样品于离心管中,使用无菌水稀释样品至1 ng/µL。
4 PCR扩增 以稀释后的DNA样本作为模板,根据序列中的保守区域设计相应引物,使用特异性Barcode序列,进而对特定基因片段进行PCR扩增。PCR反应体系为高保真PCR反应液15 µL,引物0.2 µmol/L,模板DNA 10 ng,共30 µL体系,扩增条件为98℃ 1 min (98℃ 10 s,50℃ 30 s,72℃ 30 s) 30个循环,72℃ 5 min。
5 产物纯化 在PCR产物中加0.8倍的磁珠,震荡充分悬浮后在磁力架上吸附5 min,用移液枪吸出上清;加入20 µL 0.8倍磁珠洗涤液,吸上清;加200 µL 80%乙醇,反向放置;待乙醇挥发完全,磁珠出现裂缝;加入25 µL洗脱液,室温放置5 min,充分吸附,移出上清到干净离心管中保存。
6 文库构建和上机测序 已经构建好的文库经过Qubit定量和文库检测,评估合格后,使用Illumina平台进行测序。高通量测序得到的原始图像数据文件,经碱基识别分析转化为原始测序序列,其中包含测序序列(Reads)的序列信息以及其对应的测序质量信息。
7 数据分析 对原始数据进行拼接、过滤,得到有效数据,按照QIIME2 dada2分析流程进行序列可操作分类单元(operational taxonomic units,OTU)聚类,再进行物种分类分析。根据聚类结果,一方面对每个序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况。同时,采用ASVs进行丰度分析,以得到样本内物种丰富度和均匀度信息,使用方差分析(analysis of variance,ANOVA)对分组样本的物种组成和群落结构进行差异显著性检验。
结 果
1 四组咽部菌群在门水平的构成 120份样本测序结果,4份样本测序失败。剩余测序结果分析,四组样本在界门纲目科属种水平的ASV数量见图1,116份样本在界门纲目科属种水平的ASV数量见图2。菌群门水平主要有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、蓝藻门(Cyanobacteria)和糖细菌门(Glycobacteria)(图3)。其中厚壁菌门丰度最高,在四组中占比依次为30%、28%、31%、38%;拟杆菌门丰度次之,在四组中占比依次为34%、35%、27%、23%。厚壁菌门和拟杆菌门在所有样本中占比为32%和30%,此外放线菌门和梭杆菌丰度占比也较高(图4)。
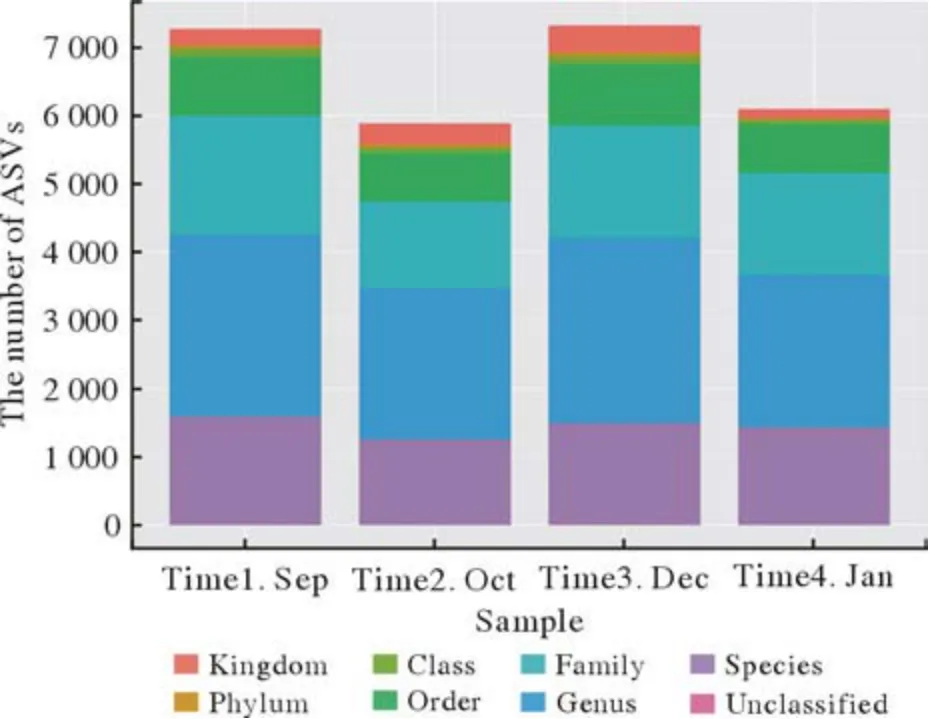
图1 四组咽部菌群的主要分布(横坐标为组别,Time1 Sep、Time2 Oct、Time3 Dec和Time4 Jan分别代表1、2、3和4组;纵坐标为分类水平的ASV数量)Fig.1 Distribution of pharyngeal flora in the four groups (The abscissa indicates groups, Time1 Sep, Time2 Oct, Time3 Dec and Time4 Jan represent group 1, 2, 3 and 4; The ordinate is the number of ASV)
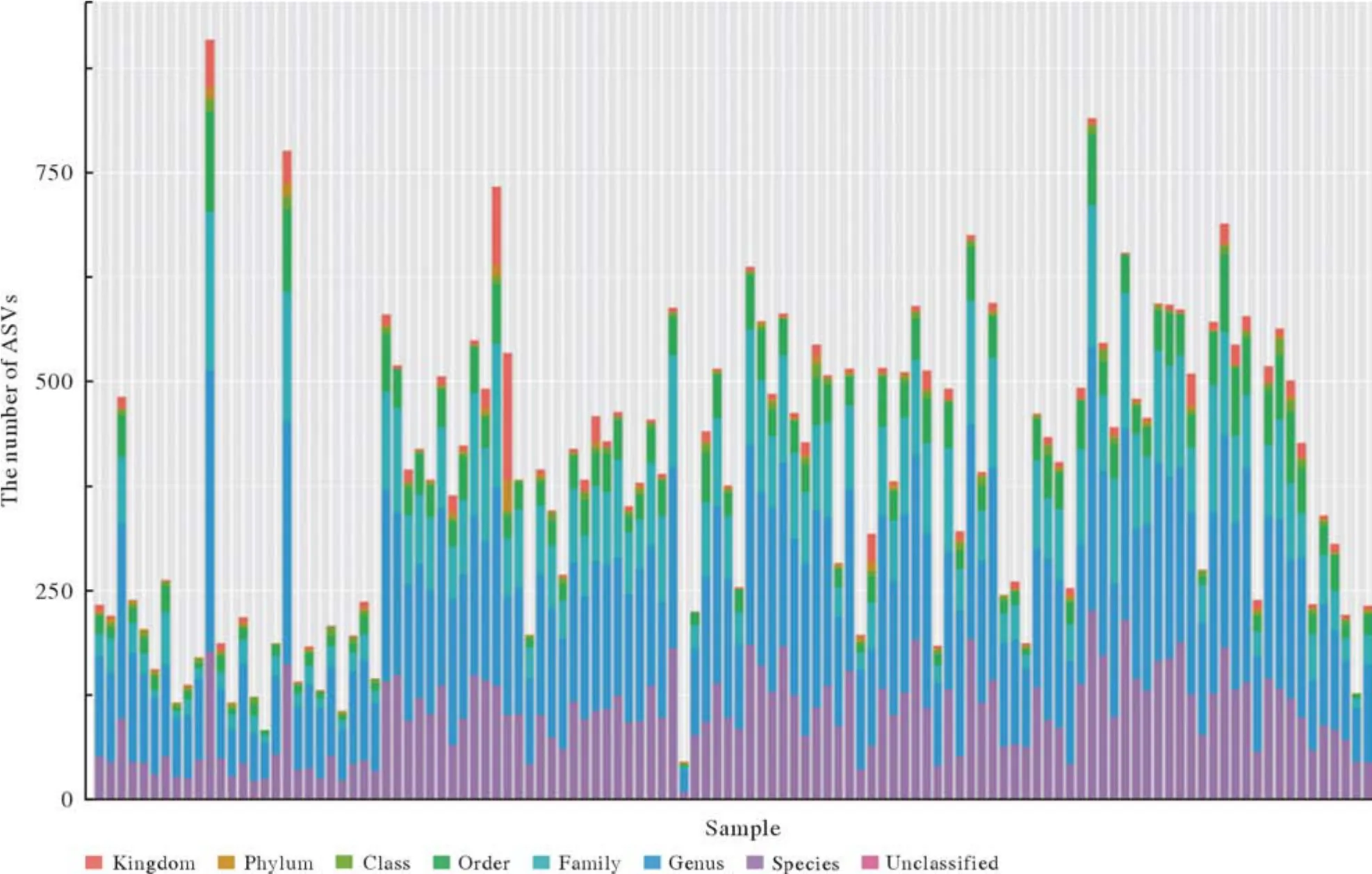
图2 116份样本咽部菌群的分布特征(横坐标为116份样本;纵坐标为分类水平的ASV数量)Fig.2 Distribution characteristics of pharyngeal flora of the 116 samples (The abscissa is the 116 samples; The ordinate is the number of ASV)
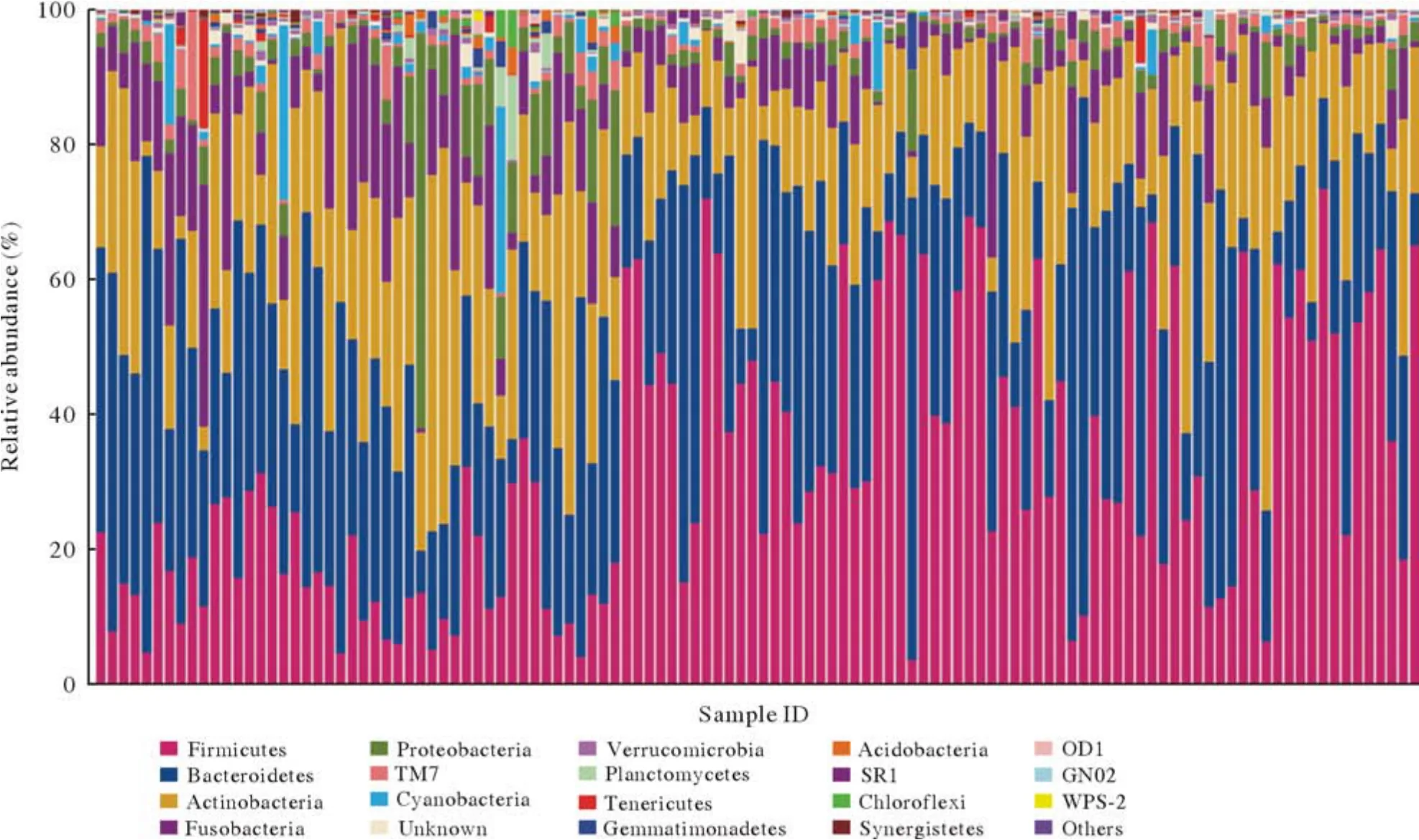
图4 116份样本在门类水平物种注释丰度分布(横坐标为116份样本;纵坐标为相对丰度百分比)Fig.4 Species abundance distribution of phylum in the 116 samples (The abscissa is the 116 samples; The ordinate is the relative abundance percentage)
2 四组咽部菌群在属水平的构成 菌群属水平主要有普氏菌(Prevotella)、拟杆菌属(Bacteroides)、瘤胃球菌属(Ruminococcaceae)、奈瑟菌属(Neisseria)、嗜血杆菌属(Haemophilus)、乳酸杆菌属(Lachnobacterium)和厌氧球菌属(Anaerococcus)。厚壁菌门中,瘤胃球菌属丰度占比最高;拟杆菌门中,拟杆菌属和普氏菌属丰度占比最高;梭杆菌门的梭形菌属、放线菌门的双歧杆菌属丰度占比较高(图5、图6)。厚壁菌门拥有最高的丰度,菌群也最具多样性,其中梭菌纲和芽孢杆菌纲也有较高的丰度(图5、图6)。
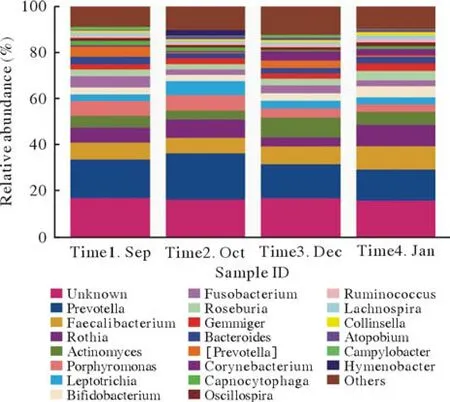
图5 四组咽部菌群主要属的分布(横坐标为组别,Time1 Sep、Time2 Oct、Time3 Dec和Time4 Jan分别代表1、2、3和4组;纵坐标为相对丰度百分比)Fig.5 Genus distribution of pharyngeal flora in four groups (The abscissa indicates groups, Time1 Sep,Time2 Oct, Time3 Dec and Time4 Jan represent group 1, 2, 3 and 4; The ordinate is the relative abundance percentage)
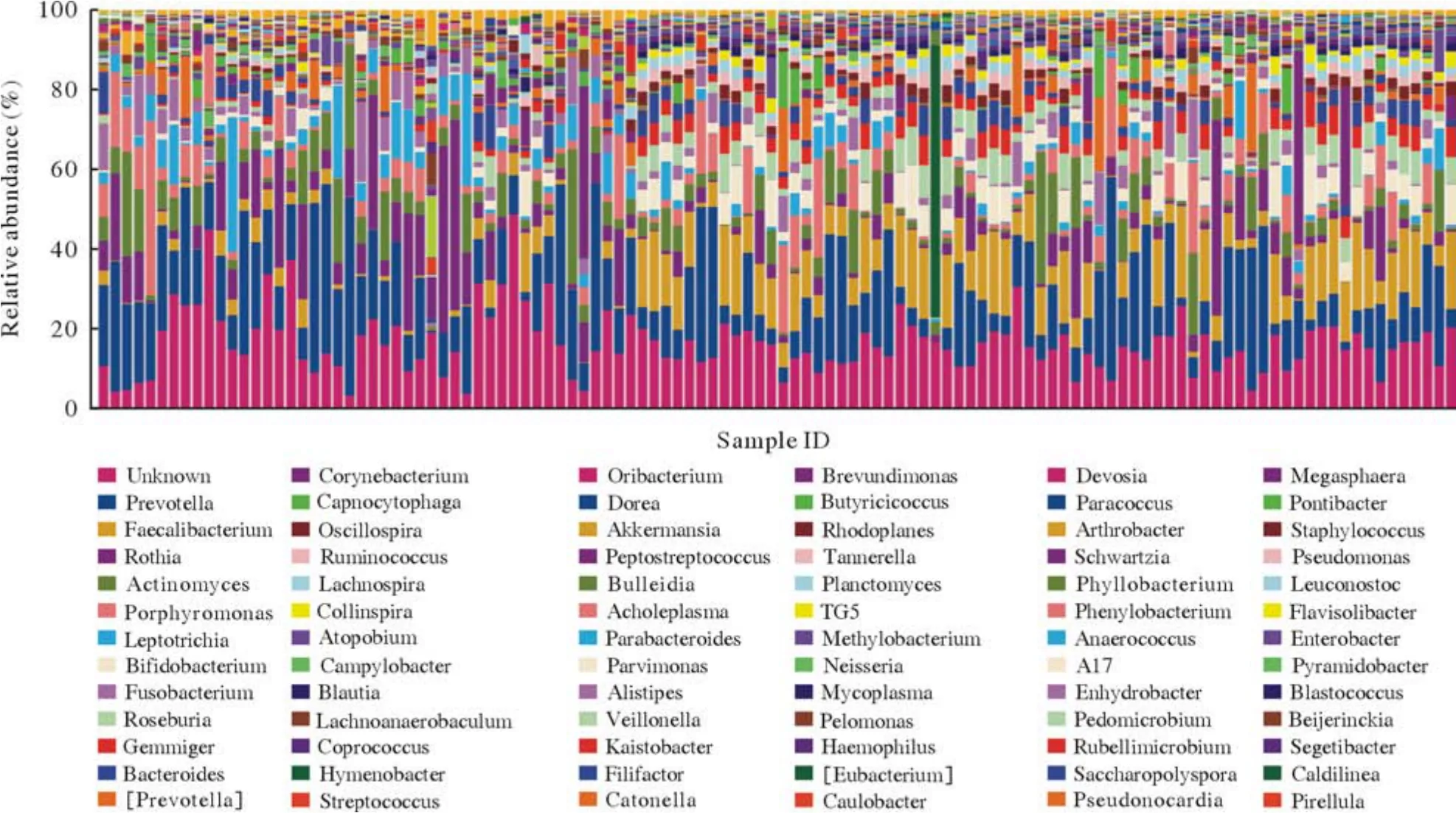
图6 116份样本在属类水平物种注释丰度分布(横坐标为116份样本;纵坐标为相对丰度百分比)Fig.6 Species abundance distribution of genus in the 116 samples (The abscissa is the 116 samples; The ordinate is the relative abundance percentage)
3 四组咽部菌群变化趋势 在门水平,四组的平均相对丰度对比发现,厚壁菌门4组>3组>1组>2组,1组与4组有统计学差异(P<0.05);拟杆菌门1组>2组>3组>4组,1组与4组有统计学差异(P<0.05);放线菌门4组>3组>2组>1组,1组与4组有统计学差异(P<0.05);变形杆菌门平均相对丰度在3组时最高(图7)。在属水平,普氏菌属平均相对丰度最高,2组>1组>3组>4组,2组相对丰度最高;双歧杆菌属,4组>3组>2组>1组,4组相对丰度最高;放线菌属3组>1组>4组>2组,3组丰度最高;棒杆菌属平均相对丰度在3组时最高(图8)。
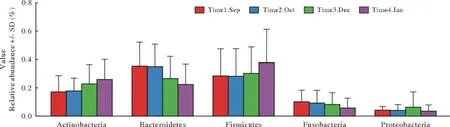
图7 门类水平主要菌的变化趋势(横坐标为物种分类;纵坐标为平均相对丰度,Time1 Sep、Time2 Oct、Time3 Dec和Time4 Jan分别代表1、2、3和4组)Fig.7 Trends in major bacteria of phylum (The abscissa is species classification; The ordinate is the relative abundance, Time1 Sep, Time2 Oct, Time3 Dec and Time4 Jan represent group 1, 2, 3 and 4)
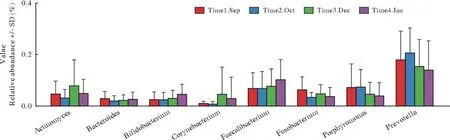
图8 属类水平主要菌的变化趋势(横坐标为物种分类;纵坐标为平均相对丰度,Time1 Sep、Time2 Oct、Time3 Dec和Time4 Jan分别代表1、2、3和4组)Fig.8 Trends in major bacteria of genus (The abscissa is species classification; The ordinate is the relative abundance, Time1 Sep, Time2 Oct,Time3 Dec and Time4 Jan represent group 1, 2, 3 and 4)
讨 论
本研究采用高通量测序技术,使用Illumin测序平台对116份咽部样本进行测序分析,研究人体咽部菌群的构成和分布特征。研究显示,长航人员咽部菌群在门水平有厚壁菌门、拟杆菌门、放线菌门、梭杆菌门、变形菌门、疣微菌门、蓝藻门和糖细菌门,在属水平有普氏菌、拟杆菌属、瘤胃球菌属、奈瑟菌属、嗜血杆菌属、乳酸杆菌属和厌氧球菌属。随着航行时间增加,菌群结构出现变化,菌群丰度多样性分析显示,航行过程中随着航行时间的增加放线菌门持续增加,拟杆菌门持续减少,厚壁菌门先减少后增加,变形菌门先增加后减少。同时发现菌群有增减,如新增了绿弯菌门、远洋球菌和硬脑膜放线菌,疣微菌门逐渐消失。普氏菌属和放线菌属航行开始后增加,分别在航行开始后1个月和航行后3个月最高,之后开始减少,双歧杆菌属和棒杆菌属逐渐增多。在长远航人员咽部菌群中厚壁菌门占主导,拟杆菌门次之。分析原因有以下几点:1)样本来自长远航人员,随行人员数量有限;2)环境影响,作业人员长期处于高温高湿的海洋生态环境中,极大影响了菌群的结构变化;3)测序方法,采用Illumina平台,所得的数据更全面详细。
与航行前相比,航行1个月咽部出现噬纤维菌纲、鞘氨醇杆菌纲、厌氧绳菌纲、海洋杆菌属、脱硫弧菌属等水源性微生物,与正常人群咽部菌群构成差异。其中硝化螺旋菌是一类革兰阴性菌,对水中植物非常重要,缺少会造成水生环境破坏,可导致鱼类死亡[6-7]。双歧杆菌属呈进行性升高,所占比例高于正常人群,分析原因可能在航行过程中补充了此类食物。双歧杆菌是一种益生菌影响宿主的健康,在作业人员饮食中增加含有双歧杆菌的酸奶,可避免缺少该种菌对身体造成不适[8-9]。
研究显示,正常人咽部菌群主要有厚壁菌门、拟杆菌门、放线菌门、梭杆菌门和变形菌门[10]。本研究长远航人员咽部菌群与正常人群基本一致,但新增蓝藻门。蓝藻门主要分布在淡水和海水中,长期接触易引起皮炎和中毒[11-13]。其次,随着航行时间增加,拟杆菌门逐渐减少,疣微菌门航行后期逐渐消失。此外,糖细菌门是正常人群口腔微生物菌落的共生成员,在航海人员咽部比例增加。一些文献报道航海人员口腔疾病多发[14-15],糖细菌门的增加更易诱发航海人员口腔疾病。长远航人员工作繁重,缺少休息,导致机体免疫力降低,且长期处于海上环境,心理上容易产生焦虑或抑郁[16-17]。以上因素均会影响菌群的代谢和生长,导致咽部菌群结构和多样性发生变化,条件致病菌增加,从而影响长远航人员身体健康[18-19]。近年来,针对长远航人员咽部菌群研究较少,现阶段我们对菌群的认识不够深入,针对文中面临的问题,综合考虑以下几点:采用新一代高通量测序法,增加标本检测数量,得到全面准确的菌群变化特征,进一步确认低丰度的菌群,发现更具代表性的菌群[20];将菌群分布及丰度变化特征与人员随航症状和某些疾病进行关联,深入探讨菌群微生态对长航过程中疾病的相关性;通过服用某些益生菌干预菌群结构变化,合理搭配饮食平衡,改善症状或预防治疗疾病[21]。本研究重点采用高通量测序技术,在获得咽部菌群多样性方面积累了基础数据,对后续深入研究长远航人员咽部菌群具有重要意义。
致谢:对项目组成员在标本采集、标本保存、实验和数据分析提供的帮助表示最诚挚的谢意!

