肝动脉化疗栓塞联合靶向及免疫检查点抑制剂治疗对中晚期肝癌患者的疗效及安全性研究
李颖林,叶斯斯,康馨丹,李 娟,白 莉
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 肿瘤内科,北京 100853;3 解放军总医院第二医学中心 呼吸内科,北京 100853
2020年全球癌症统计报告显示,肝癌的发病率和死亡率在全球范围内分别位居第6位和第3位,严重威胁人类的生命健康[1]。肝细胞肝癌(以下简称为肝癌)多在肝炎、肝硬化的背景下发展而来[2],是原发性肝癌的主要组织学类型。肝癌的早期临床症状不典型,常见的有乏力、上腹部疼痛、食欲缺乏、恶心呕吐等,容易被忽视,故多数患者在就诊时已处于疾病的中晚期,无法行根治性手术切除。目前针对中晚期肝癌的治疗主要包括放射治疗、消融治疗、经动脉化疗栓塞、系统抗肿瘤治疗等,依据疾病的不同分期分别推荐不同的一线治疗方法。肝动脉化疗栓塞(trans arterial chemoembolization,TACE)是巴塞罗那分期为B期肝癌的一线疗法[3]。但有文献报道TACE治疗后局部肿瘤坏死率仅有10% ~ 20%[4]。以索拉非尼和仑伐替尼为代表的靶向药物及免疫治疗药物免疫检查点抑制剂是晚期肝癌患者系统治疗的重要组成部分,其中以阿替利珠单抗联合贝伐珠单抗为首的靶免联合治疗被2020年版《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南》列为具有良好肝功能患者的Ⅰ级推荐[5]。目前针对肝癌联合治疗的研究主要集中在免疫检查点抑制剂联合靶向药物、TACE联合靶向药物,并取得了令人备受鼓舞的实验结果[6-7]。但鲜有研究探讨TACE联合靶向药物及免疫检查点抑制剂时的治疗疗效,故本研究进行了这一回顾性分析以评估三法联合治疗中晚期肝癌的疗效及安全性。
资料与方法
1 研究对象 纳入2016年1月- 2021年1月就诊于解放军总医院第一医学中心的中晚期肝细胞肝癌患者。纳入标准:1)经病理学或临床诊断为肝细胞肝癌;2)BCLC分期为B期或C期;3)年龄≥18岁;4) ECOG PS评分为0 ~ 2分;5) Child-Push分级为A级或B级;6)至少有一个影像学可评估的基线靶病灶;7)采用TACE联合靶向及免疫检查点抑制剂治疗或TACE联合靶向治疗。排除标准:1)早期肝癌或终末期肝癌;2) ECOG PS评分>2分;3)患有严重的自身免疫性疾病或目前正处于该类疾病的活动期;4)病理确诊为转移性肝癌。
2 治疗方法 根据患者治疗方法分为观察组和对照组。观察组采用TACE联合靶向药物及免疫检查点抑制剂治疗,对照组仅应用TACE联合靶向治疗。各方法简介如下。
TACE治疗:常规局部麻醉后采用改良Seldinger’s技术穿刺右侧股动脉导入5F动脉鞘,插入5F动脉导管行选择性腹主动脉和肠系膜上动脉造影及介入治疗。术中用药:500 ~ 1 250 mg注射用氟尿嘧啶、100 ~ 150 mg注射用奥沙利铂、30 mg注射用吡柔比星、5 mL碘化油注射液及10余粒明胶海绵碎粒。术后于右侧腹股沟区行加压包扎6 h,术后密切观察患者的生命体征及右侧足背动脉搏动情况。对存在门脉癌栓的患者允许采用个体化放疗。
靶向药物治疗: 甲磺酸仑伐替尼胶囊,若体质量<60 kg,剂量为8 mg,口服,1次/d;若体质量≥60 kg,剂量则为12 mg,口服,1次/d。甲苯磺酸索拉非尼片0.4 g,口服,2次/d。甲磺酸阿帕替尼片750 mg,口服,1次/d (以上3种药物需口服至疾病进展或出现不可耐受的不良反应)。瑞戈非尼片160 mg,口服,1次/d (28 d为1个周期,每周期的d1 ~ d21服药)。
免疫检查点抑制剂治疗:信迪利单抗注射液200 mg,静脉滴注,1次/3周;纳武利尤单抗注射液240 mg,静脉滴注,1次/2周;帕博利珠单抗注射液200 mg,静脉滴注,1次/3周;卡瑞利珠单抗注射液3 mg/kg,静脉滴注,1次/3周,直至疾病进展或出现不可耐受的毒性。
3 临床疗效及不良反应的评估 疗效评价标准使用实体肿瘤的疗效评价标准(Response Evaluation Criteria in Solid Tumours,RECIST) 1.1对治疗疗效进行评估,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)[8]。观察组和联合组人数分别计为n1和n2,总人数用N表示,客观缓解率(objective response rate,ORR)=(CR + PR)/n,疾病控制率(disease control rate,DCR)=(CR + PR + SD)/n。不良反应评估使用不良反应事件评价标准(CTCAE 5.0版)对靶向药物及免疫检查点抑制剂的不良反应进行评估。总生存期(overall survival,OS)为确诊至因任何原因所致死亡的时间,若随访结束时患者仍存活则以随访截止时间计算总生存期。本研究随访至2022年3月31日。
4 统计学分析 使用SPSS26.0软件进行统计学分析。计数资料采用χ2检验或Fisher确切概率法。以总生存期资料建立Kaplan-Meier乘积限生存曲线模型,两组生存资料比较为log-rank检验。P<0.05为差异有统计学意义。
结 果
1 两组基线资料比较 观察组98例,男性83例,女性15例,平均年龄为55.5岁;对照组52例,男性43例,女性9例,平均年龄为53.7岁。两组性别、年龄、吸烟史、饮酒史、有无肝硬化及病毒感染、是否行抗病毒治疗、原发肿瘤数目、转移数目、手术史、甲胎蛋白水平等指标均差异无统计学意义(P>0.05),见表1。所有患者ECOG评分均为0 ~ 2分,观察组与对照组中分别有7例和2例无病毒感染病史,多数患者HBV感染。

表1 两组肝癌患者基线特征的比较(n, %)Tab. 1 Comparison of baseline characteristics between the two groups (n, %)
2 临床疗效评价 观察组中CR 2例,PR 53例,SD 25例,PD 18例,ORR为56.1%,DCR为81.6%;对照组中CR 1例,PR 19例,SD 16例,PD 16例,ORR为38.5%,DCR为69.2%(表2)。截至2022年3月31日,36例存活,114例死亡,观察组中位总生存期(median overall survival,mOS)为23.1(95%CI:18.20 ~ 28.00)个月,对照组mOS为16.27(95%CI:12.03 ~ 20.51)个月(P=0.002),两组差异有统计学意义。见图1。
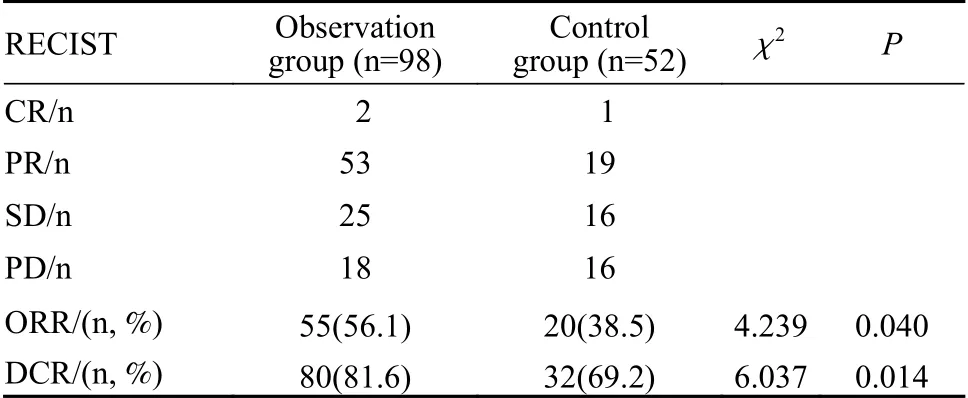
表2 两组疗效比较Tab. 2 Comparison of therapeutic effect between the two groups
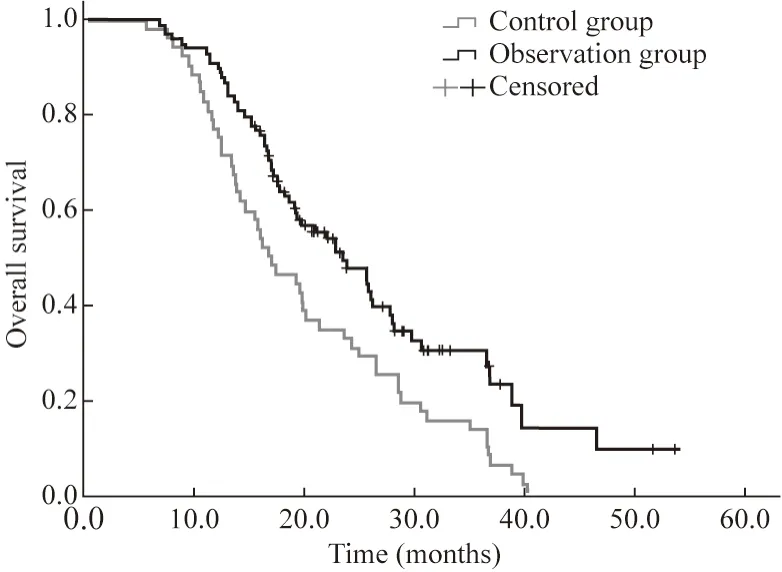
图1 两组总生存期Kaplan-Meier分析结果Fig.1 Comparison of overall survival between the two groups
3 不良反应 观察组最常见的不良反应为高血压(22.4%),其次为腹泻(21.4%)、手足反应(20.4%)、疲乏(14.3%)、蛋白尿(10.2%)、发音困难(9.2%)、甲状腺功能减退(8.2%)等,其中1例患者出现了Ⅱ级免疫相关性肺炎,应用激素治疗后症状好转。对照组最常见的不良反应为手足反应(32.7%),其次为腹泻(19.2%)、高血压(15.4%)、关节疼痛及肌痛(11.5%)等。对照组关节疼痛及肌痛的发生率高于对照组,查阅既往就诊资料考虑可能与骨质疏松等原发病有关。观察组与对照组相比未见明显不良反应增加。TACE治疗后部分患者出现栓塞后综合征,即恶心、呕吐、腹痛、发热等症状,均经过相应处理后好转。见表3。
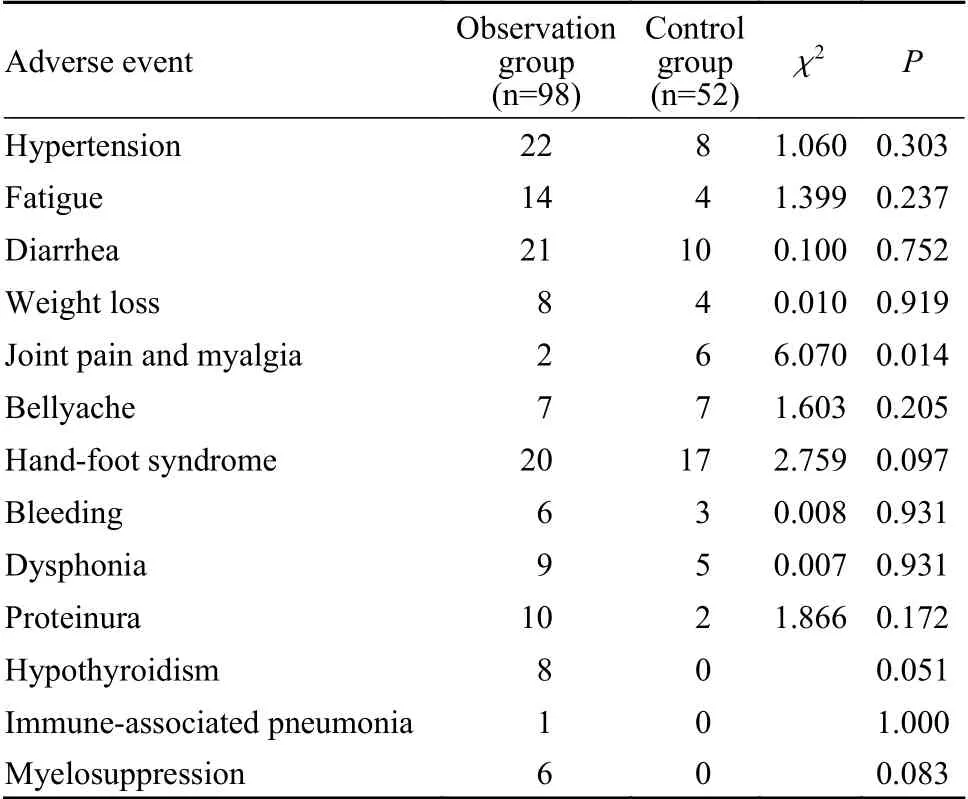
表3 两组不良反应发生情况(n)Tab. 3 Comparison of adverse events between the two groups (n)
讨 论
肝细胞肝癌是原发性肝癌的主要类型,约占其发病总数的75%[9]。常见的发病原因包括病毒感染、肥胖、2型糖尿病、非酒精性脂肪肝等[10],多数患者在癌变前都有肝硬化的背景。肝动脉化疗栓塞和系统的抗肿瘤治疗是目前中晚期肝癌患者的主要治疗方式。TACE作为介入手段之一,一方面通过将抗肿瘤药物及栓塞剂注入肝内肿瘤动脉发挥直接杀伤和切断血管营养的抗肿瘤作用,另一方面TACE治疗后可使缺氧诱导因子表达量增加,进而上调血管内皮生长因子及血小板衍生生长因子的表达,促进肿瘤血管的生长,从而妨碍抗肿瘤作用[11]。以仑伐替尼和索拉菲尼为代表的酪氨酸激酶受体抑制剂可抑制VEGFR及PDGFR的表达,提高TACE的治疗效果,故TACE与靶向药物联用在一定程度上可弥补TACE的不足。近年来以PD-1/PD-L1单抗、CTLA-4受体拮抗剂为代表的免疫检查点抑制剂在肿瘤治疗中获得了成功,使肿瘤内科治疗进入了一个崭新的时代,IMbrave150研究结果显示与单用索拉菲尼相比,阿替利珠单抗联合贝伐珠单抗可使肝癌患者的中位无疾病进展生存期和中位总生存期明显延长[12]。
目前已有多种免疫检查点抑制剂成功运用于临床治疗中,其中运用广泛的PD-1单抗通过阻断其与配体PD-L1、PD-L2结合可解除免疫抑制效应,激活 T 细胞功能,产生肿瘤免疫应答,发挥抗肿瘤作用[13]。因肝细胞肝癌的免疫微环境较为特殊和复杂,主要以免疫抑制状态为主[14-16],故单用免疫检查点抑制剂治疗难以带来令人满意的效果,故我们预测在TACE联合靶向药物治疗的基础上加用免疫检查点抑制剂可能有效。既往一项共纳入了142例PD-L1表达为阳性的不可切除肝细胞肝癌患者的回顾性研究提示接受帕博利珠单抗-仑伐替尼-TACE序贯治疗较仑伐替尼-TACE序贯治疗有益,前组患者的中位PFS和中位OS较后者分别延长了3.7个月和4个月,但不良反应也随之增加,初步揭示了三种方法联合治疗的优势[17]。相似的实验结果在其他诸多研究中也得到了论证[18-20]。本研究结果显示观察组和对照组患者的中位OS分别为23.1个月和16.27个月,ORR分别为56.1%和38.5%,DCR为81.6%和69.2%,最常见的转移部位为肝(37.8%)和门静脉(37.2%),其次为肺(27.6%)、淋巴结(21.2%)、骨骼(9.62%)和肾上腺(3.21%)。以上结果说明与对照组相比,观察组在治疗疗效方面更有优势,这与先前的研究相似。
在药物的安全性方面,观察组相比对照组未见明显不良反应增加,但极少数患者出现了免疫相关不良反应,主要是由于免疫检查点抑制剂诱导的免疫系统不仅针对肿瘤新抗原而且针对自身抗原而激活,从而导致正常组织的损伤[21]。在观察组中1例患者出现了Ⅱ级免疫相关性肺炎,经糖皮质激素治疗后好转。提示我们在应用免疫检查点抑制剂治疗过程中需要严密监测不良反应,及早对症处理。
本研究的不足之处有以下几点:1)此研究为回顾性研究,电话随访时很难获得完整可靠资料,具有一定的局限性;2)研究样本量偏小,需要更大样本的前瞻性研究证实其疗效。3)TACE联合免疫检查点抑制剂的具体时机和联合作用的详细机制有待明确。综上所述,该回顾性研究显示TACE联合靶向药物及免疫检查点抑制剂治疗中晚期肝癌疗效良好,且毒性无明显增加,是一种疗效可靠且安全的治疗方案。

