无导线心脏起搏器的研究现状与展望
郭海涵 李述峰 曹威,
(1.哈尔滨医科大学研究生院,黑龙江 哈尔滨 150086;2.哈尔滨医科大学附属第二医院心血管内科,黑龙江 哈尔滨 150086)
自1958年由瑞典心外科医生Ake Senning给患者植入第一台植入式心脏起搏器以来,植入式心脏起搏器给无数患者带来了福祉。随着心脏起搏器及其植入术的发展,起搏导线和脉冲发生器的材料及工艺有了显著进步;从非生理性起搏到生理性起搏,起搏技术也在飞速发展。目前植入的起搏器中,皮下植入起搏器脉冲发生器连接经静脉置入的电极导线的传统起搏器占大多数。但传统起搏器仍存在一些局限性及不足,术中及术后相关并发症发生率较高。10%的患者发生术后不良事件,大多数与电极导线或起搏器囊袋相关(血肿、皮肤损伤和囊袋周围感染)或与放置导线(气胸、心脏穿孔和导线脱出)相关,也偶有慢性并发症(中心静脉阻塞、三尖瓣关闭不全和感染)等[1-4]。这些并发症往往导致发病率、死亡率和医疗支出的大幅增加[5-6]。
介于传统心脏起搏器的不足,20世纪70年代,相关学者提出了无导线起搏器的概念。Spickler等[7]首先成功将无导线起搏器植入犬的右心室中。但受限于电池技术,未能在临床中使用。近年来随着工艺和程控技术的进步以及电池寿命的延长,无导线心脏起搏器(leadless cardiac pacemaker,LCP)得到进一步的发展。无导线心脏起搏是将LCP植入右心室,很大程度上克服了上述传统起搏器的局限性和不足。
1 LCP的研究现状
目前有两种无导线单腔起搏器:St.Jude Medical/Abbott公司的Nanostim无导线起搏器(图1)以及Medtronic公司开发的Micra经皮起搏系统(transcatheter pacing system,TPS)(图2)[8-9]。两种起搏系统的特性类似,体积分别为1.0 cm3和0.8 cm3,重量相等,起搏模式都是心室起搏、心室感知以及心室抑制型起搏(VVI),电池寿命接近,均有自己的一套程控系统(表1)。这两种系统都提供了与传统VVIR起搏器类似的起搏功能,包括速率响应算法。此外,为减少炎症发生,使用了一个非甾体抗炎药洗脱的尖端。尽管这些设备比传统的起搏系统要小得多,但预期寿命多至10年。虽然这些设备降低了传统起搏系统的一些风险,但它们也有自己的围手术期并发症和长期影响。同样需强调的是,目前还未进行过将无导线起搏系统与经静脉起搏系统进行比较的随机对照试验。然而,在小型非随机试验中,无导线起搏系统在安全性、有效性和可行性方面已有了显著的进步。

图1 NanostimTM
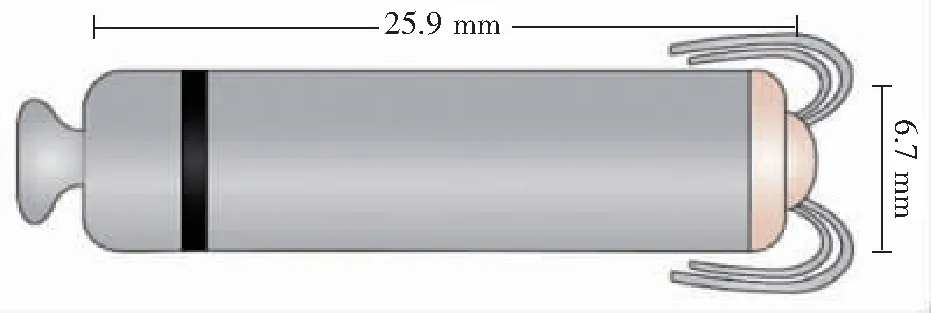
图2 MicraTM

表1 无导线起搏装置的比较
还有一种无导线双腔起搏器:Micra AV。这种起搏器具有房室同步性,能提供房室同步性的心室起搏以及双腔感知的心房同步心室抑制型起搏(VDD)的起搏模式,这是通过三轴加速度传感器感知心房收缩产生的加速度而实现的[10]。然而,与传统起搏方式不同,它不是感知心房的电活动而是感知其机械活动而实现房室同步的。
1.1 Nanostim LCP
Knops等[11]于2013年进行了Nanostim LCP相关的临床研究(LEADLESSⅠ研究),共入选33例患者,大多数患者为永久性心房颤动伴房室传导阻滞,其他入选标准包括窦性心律合并二度或三度房室传导阻滞且活动量少或预期寿命较短的患者、窦性心动过缓合并间歇停搏或电生理检查无异常的晕厥患者。共32例患者成功植入了LCP,手术成功率为97%,其中1例患者出现心脏压塞,行紧急心脏外科手术,随后死于卒中;另1例患者因术者无意中将LCP通过未闭卵圆孔植入左心室,该装置被及时发现后成功取出并更换为新的起搏器。1年后进行的术后随访发现:起搏器的起搏阈值、阻抗和感知等起搏参数均正常,无新的并发症出现,无电池衰减、过感知或感知功能不良[12]。之后进行了多中心且患者数量更大的LEADLESSⅡ研究[8],纳入了527例患者,植入成功率为95.8%。有90%的患者达到了治疗终点(即R波振幅≥5.0 mV,输出阈值≤2.0 V),不良事件发生率为6.5%,其中8例心脏穿孔,6例起搏器移位,4例因阈值升高将起搏器拔除,血管入路并发症发生率为1.2%。
LEADLESS观察性研究[13]是一项在欧洲进行的前瞻性研究,研究起搏器的短期安全性。在发生两次心脏穿孔后,由于方案的改变和研究人员的培训,研究暂停[14]。LEADLESS试验中的300例患者随后被纳入研究。在植入起搏器6个月后,94.6%的患者未发生严重不良事件,心脏穿孔率和起搏器移位率分别为1.3%和0.3%,无起搏器相关感染的报告。这些发现与LEADLESSⅠ和Ⅱ试验之前的结果具有可比性。
1.2 Micra TPS
2013年12月进行了一项非随机、多中心和前瞻性临床研究(Micra TPS研究)[9],纳入725例患者,TPS植入成功率为99.2%(719/725),随访6个月,98.3%的患者输出阈值≤2.0 V,其中起搏参数于随访过程中均趋于稳定;严重并发症发生率为4%,其中1例患者因肾衰竭代谢性酸中毒死亡,11例患者出现心脏穿孔或心脏压塞,5例合并穿刺部位损伤,随访中无起搏器移位或全身感染发生,与传统的起搏方式相比,Micra TPS起博器降低主要并发症发生率51%。Duray等[15]报道,术后1年TPS的主要并发症发生率较有导线起搏器低(4.0% vs 7.6%),其中长期住院治疗风险降低47%,术中及术后无并发症的概率稳定于96%,出现3例新发心力衰竭,1例起搏器综合征,未出现起搏器相关感染、遥测异常和起搏器移位。
Micra Post-Approval Registry证实了这些发现[16-17]。1 817例Micra植入术的结果显示,植入成功率为99.1%。1年后有97%的患者起搏阈值≤2.0 V,有2.7%的患者出现了主要并发症,降低主要并发症发生率63%。与前一项研究相比,心脏穿孔较少(0.44%),而血管并发症(0.61%)相似,有1例患者发生起搏器移位。
1.3 Micra AV
在MASS及MASSⅡ临床试验[18]中,从植入的MicraTM中获得心内加速度计信号,该MicraTM在患者各种活动期间感知心房收缩,从而创建了一种感知算法。该算法基于三轴加速度计采集的心脏周期的四个不同节段的信号,分别对应于等容收缩和二尖瓣/三尖瓣关闭(A1)、主动脉/肺动脉瓣关闭(A2)、被动心室充血(A3)和心房收缩(A4)。系统关闭窗口排斥起源于心室的信号(A1,A2),从而隔离了心房信号。当过滤和校正的加速度计信号超过程序设定的阈值时,就检测出了心房收缩。平滑的特性也整合在该算法,在减少A4感应时(如患者活动时)也能保持AV同步起搏。
MARVEL研究[19]通过将MASS/MASSⅡ研究中开发的算法下载到用于心房颤动同步起搏的MicraTM装置中,以评估该算法的可行性。此研究证明使用该算法进行房室同步起搏是可行的,算法应用期间的平均同步起搏比率为87%。在房室传导阻滞等级较高的患者中,与VVI相比,该算法将房室传导同步率从38%提高到80%(P<0.001)。此外,与VVI相比,超声心动图测量的左心室流出速度显著增加(23.9 cm/s vs 21.8 cm/s,P=0.004)。参与者的动态心电图监测数据显示,在起搏过程中无设备停止、起搏器相关的心动过速,或与设备或算法相关的不良事件。
2019年进行了MARVELⅡ临床试验[20]。MARVELⅡ研究基于之前的结果,实现了一种类似的基于加速度计的可下载算法用于VDD,具有增强的功能,包括自动编程和模式切换算法,可适应患者节律和活动的变化。试验结果显示:在纳入主要疗效客观分析的40例窦性心律及完全性房室传导阻滞患者中,VDD组静息时房室同步性≥70%的患者比例明显高于VVI组(95% vs 0%,P<0.001)。平均房室同步性从VVI时的26.8%(中位数26.9%)增加到VDD时的89.2%(中位数94%)。75例患者在VDD过程中均无起搏停止或起搏引起的心动过速。与MARVELⅠ试验相似的是,在VDD期间,无暂停、过度敏感诱发的心动过速发作或与算法相关的不良事件被报道。改进后的算法被证明优于MARVELⅠ试验中使用的初始算法。这些研究的一个关键限制是,由于大多数手术都是在一次预约中完成,观察时间较短,这可能不能准确地反映现实世界的变化。在这项研究之后,MicraTMAV于2020年1月获得美国食品和药物管理局批准。
2 LCP的优势及不足
2.1 优势
LCP在植入后比传统心脏起搏器更加美观,而且在之前的一些队列研究[21-22]中证实,无导线起搏比经静脉系统起搏的并发症更少。在预后方面,无导线起搏比经静脉系统起搏更佳,再者,与经静脉系统起搏装置相似,LCP可安全地接受磁共振成像检查[23]。在起搏器相关的感染方面,如前所述,在LEADLESS试验以及Micra临床试验中,并未发现有起搏器相关感染。目前,全世界有超过70 000例的MicraTMTPS植入,只有1例报道MicraTM感染[24]。并且,在经静脉系统植入起搏器发生感染的患者中,给予再次植入MicraTMTPS后,无复发感染的报道[25-27]。由于LCP的先天优势,从源头上避免了导线相关并发症,并且由于传统心脏起搏器在体内滞留时间长,在拔除导线时需经历的风险更大。在一项对需长时间心脏起搏的危重患者的多中心国际研究[28]中,无导线起搏未发生起搏器相关并发症,也未发生感染,是传统临时起搏新的替代方案。
在Garweg等[29]的研究中,Micra无导线起搏对瓣膜病患者是一种安全有效的起搏方式,能避免经三尖瓣起搏导管引起的感染,这是其显著的优势。在儿科患者中,无导线起搏亦是可行的[30]。
房室同步的双腔LCP可使完全房室传导阻滞的患者获得房室同步化收缩,能显著地改善房室传导阻滞植入无导线心室起搏器患者的房室同步性,更好地模拟了心脏的生理传导功能,实现生理、精准以及符合人体需求的起搏。此款双腔无导线起搏器具有新算法,能感知心房起搏心室,实现房室顺序性传导,可让更多符合起搏器适应证的患者获益。
2.2 不足
无导线起搏的缺点之一是较高的心脏压塞发生率和较严重程度的心脏压塞,与经静脉系统起搏相比,无导线起搏似乎更容易出现这种并发症。一些研究普遍报道,与无导线起搏相比,经静脉系统起搏导致心脏压塞的发生率略低:梅奥诊所的回顾性研究[31]报道,经静脉系统起搏比无导线起搏导致心包积液的发生率低1.2%;Micra历史队列的研究报道,心脏压塞的发生率低1.1%[9];丹麦心脏起搏器研究[4]报道的心脏压塞的发生率低0.8%。这可能和起搏技术及手术人员有关。另外,在起搏参数等方面,LCP也需改进,有文献[32]报道,小部分患者中Micra TPS植入后发生了极高的起搏阈值现象,这对患者的预后是个不利因素。尽管LCP已拥有VDD的功能,但目前所有LCP无全自动双腔起搏模式,房室失同步的非生理性起搏风险因素可能会随之增加。在起搏器电池耗竭的情况下,是取出后更换为新的起搏器,亦或是直接放置新的LCP,目前后一种方法更为常用。研究表明,身体可轻松容纳3个LCP[33],但以前植入的起搏器会不会干扰新的LCP的功能,这也是一个值得研究的问题。目前缺乏取出植入4年以上LCP的数据支持,取出设备可能还面临着诸如动静脉瘘或三尖瓣损伤的并发症。在一项单中心研究[34]中,302例植入Micra的患者,平均随访3~6年,其中23例患者需更换或修复起搏装置。因此,能保持稳定的LCP的工作也是重中之重。2020年,El-Chami等[35]进行了一项多中心的临床研究,共192例患者在Micra植入时进行了房室结消融,与非房室结消融的患者相比,房室结消融的患者并发症更多。
最近新出现的Micra AV虽然能实现房室同步性收缩,然而确实有临床上的局限性:一是起搏AV间期是固定发放起搏脉冲,无法调整AV间期;二是心房率高时,会使A3和A4十分接近以至于无法正确识别A4信号;三是当患者心房扩大时,心房收缩幅度会变弱,这会导致房室跟踪的效果减退。2021年,Mitacchione等[36]报道了1例57岁患者,植入了Micra AV起搏器,但出现严重房室不同步,发生了起搏器综合征。这说明LCP的房室同步性可能被高估,需长期随访和特定的功能评估,以检测可能延长的房室分离时间带来的不适。植入后的Micra AV常规优化后必须进行适当的传感优化。
3 LCP的未来发展方向
未来的LCP应改进目前起搏器的设计,以降低手术及起搏器相关并发症的发生率。最重要的是应改进递送系统,将心包积液和心脏穿孔的危险性降到最低。起搏器的大小、形状和固定方式都是值得考虑及改进的方面。另外,在蓄电方面,电池的重新设计和可充电模式的建立都是可通过减少重复操作等来降低相关风险。
3.1 双腔无导线起搏器
最近使用绵羊模型来评估了心房Micra的性能[37]。该Micra是现有心室Micra的改良版,具有更短和更平的尖端,以降低右心房穿孔的风险,右心房的壁甚至比右心室的更薄。这些数据显示了有符合期望值的起搏器性能,但在临床试验之前需更多的数据研究和设计调整。
3.2 LCP在心脏再同步化治疗的应用
尽管完全无导线心脏再同步化治疗(cardiac resynchronization therapy,CRT)尚未研发出来,但一种无导线左心室心内膜起搏器(WiSE-CRT)已开发出来,并已在临床试验中作为传统CRT系统的替代[38]。WiSE-CRT的初步应用经验显示:17例患者中的13例成功植入了WiSE-CRT,在6个月的随访中,QRS波群时限缩短,纽约心功能分级和左室射血分数(left ventricular ejection fraction,LVEF)改善,疗效良好[39]。但出现了严重的并发症,包括3例心脏压塞和1例死亡。随后的左心室电极植入的安全性和性能研究[38]纳入了35例对传统CRT无反应的患者,植入成功率较高(35例患者中成功植入了34例),在增加LVEF和缩短QRS波群时限方面效果良好,但仍有较高的严重不良事件发生率(39.5%),其中1例由递送导管引发的心室颤动最终导致患者死亡。此外,还有2例发生了与皮下脉冲发生器相关的感染。该WiSE-CRT可与TV-RV起搏器或无导线起搏器同步进行CRT。有研究证实,治疗后症状改善的患者占70%,与双心室有导线起搏相比,无导线起搏的反应率相当,心力衰竭患者左心室重塑能得到有效改善,同时在很大程度上降低了血栓栓塞性卒中的风险。最近的一项研究[40]表明,在升级CRT的患者中存在很多合并症,可能会增加CRT无反应的概率,尽管如此,与接受经冠状窦CRT的患者相比,WiSE-CRT成功率更高。这些发现需更多随机对照试验的支持,因此,需研发完全无导线CRT。2020年,Carabelli等[41]在欧洲开展了把Micra和WiSE-CRT结合使用的临床研究,发现Micra和WiSE-CRT系统可成功地协同工作,为患者提供完全无导线的CRT。此外,WiSE-CRT系统提供了在不更换Micra的情况下将大量Micra患者升级到CRT的方法。相信随着无导线心脏起搏的发展,这种组合的应用范围在未来可能会扩大。
3.3 LCP与皮下植入型心律转复除颤器
有报道[42-43]显示,在缺乏血管通路的患者中可植入LCP和皮下植入型心律转复除颤器(S-ICD)。在植入时、测试期间和适时电击后,未观察到S-ICD过度传感或装置之间的互相影响。此外,一项动物研究[44]证明了将支持抗心动过速起搏的LCP与S-ICD相结合的可行性。LCP的抗心动过速起搏由S-ICD触发并有效。然而,这项研究并未完全应用于临床研究中,能否在人体上实施还需进一步的临床研究来证明。
3.4 无导线希浦系统起搏
另外,针对心脏传导系统起搏(左束支起搏和希氏束起搏)的LCP还未设计出来,特别是在中国,生理性起搏尤其是左束支起搏正在如火如荼地开展[45]。需设计出对左束支行固定的无导线起搏器的尖端,亦或是能附着在传导系统的特殊材质的起搏器。理论上讲,有理由相信未来的LCP可设计成以传导系统为目标,在高位间隔处连接螺旋,并在VDD模式下起搏。
4 小结
无导线起搏能降低经静脉系统起搏的囊袋和导线相关并发症的发病率,能在心脏瓣膜病患者和重症患者的临时起搏中应用。但也存在着一些不足,例如心包积液、无法实现生理性起搏和双心室再同步化以及无法应用于快速型心律失常。而且,其长期安全性和有效性仍需大型随机双盲研究和更长期的随访观察来证实。无导线起搏技术需更多的临床实践,使更多的患者从中获益。重要的是,为了起搏的更生理化和房室失同步的患者能重获房室同步的心脏节律,新型的针对心脏传导系统的LCP需临床医生和生物工程学家共同努力来设计并投入临床使用。未来充满着机遇和挑战,随着无导线起搏器的不断发展和进步,有理由相信,真正的“无线时代”终将到来,将会为人类医疗健康事业做出更大的贡献。

