一例掌跖角化-牙周破坏综合征病例分析
徐文靖 田广杰 胡晗 王永兰
作者单位:300134 天津市儿童医院(天津大学儿童医院)口腔科(徐文靖);天津医科大学口腔医院牙周科(田广杰、胡晗、王永兰)
Papillon-Lefèvre综 合 征(Papillon-Lefèvre syndrome,PLS)是一种罕见的常染色体隐性遗传性疾病,由法国医生Papillon和Lefèvre于1924年首次报道[1]。以掌足底皮肤过度角化及早期快速严重的牙周破坏为特征,故因此得名。本病较为罕见,人群中患病率约为百万分之一至百万分之四,目前对该病的病因研究尚不清晰,研究表明组织蛋白酶C(cathepsin C,CTSC)基因变异可能是PLS的致病基础,但其具体致病机制尚不明确[2]。有研究报道侵袭性牙周炎患者也存在CTSC基因变异[3]。本文对一例CTSC基因新变异掌跖角化-牙周破坏综合征儿童进行报道。
一、病例资料
患者,女,5岁,汉族。因两年来牙齿松动脱落就诊于我院口腔科。家长诉两年前口腔内突发全口牙龈红肿,破溃。随后乳牙逐渐出现松动脱落,从前牙开始向后牙逐渐延伸,曾在外院就诊,口服抗生素无效。自出生6个月后发现膝盖及脚跟处皮肤粗糙皲裂脱屑,涂护肤霜无改善,且逐渐加重。
1.既往史:既往体健,否认外伤、感染或其他系统性疾病病史及治疗史。患者系G2P1,足月顺产,出生体重3.2 kg,无生后窒息史,母亲孕产史无特殊异常。
2.家族史:父母均体健,非近亲结婚,否认家族类似疾病史或遗传病史。患者父母及妹妹口腔、皮肤查体情况如下:母亲口腔卫生状况良好,牙龈色粉,形态菲薄,质地坚韧,牙齿排列整齐,无松动;父亲口腔卫生状况较差,牙龈色稍红,部分龈缘肥厚,质地稍软,口内可见少量牙石,牙齿排列整齐,无松动;妹妹G2P2,1岁,牙齿萌出正常,口腔查体无明显异常。患者父母及妹妹皮肤粘膜均未见异常。
3.全身检查:体温36.6℃,脉搏89次/分,呼吸19次/分,血压90/60 mmHg,身高112 cm,体重18.2 kg,智力正常,发育适龄,营养良好。无眼距增宽、连眉、鼻梁低平、耳位低等特殊面容,耳廓无畸形,口角无歪斜。无蹼颈,胸廓无畸形,心、肺、腹部查体未见特殊异常;骨骼运动正常,步态无异常,双侧轻度肘外翻,下肢无畸形,未见扁平足。神经系统查体:腹壁反射正常,双侧肱二、三头肌反射存在且对称,双侧膝腱、跟腱反射存在且对称;病理反射双侧Babinski征、Gordon征、Hoffmann征等阴性;脑膜刺激征阴性。
4.皮肤检查:全身皮肤粘膜无破溃、色素沉着、黄染等异常,无特殊斑痣,毛发无色素脱失但光泽稍差。双手皮肤柔软有弹性,十指趾指甲光滑有光泽。双侧膝部角化性丘疹,表面粗糙,双足跖、双侧趾内侧带状角化过度,皮肤增厚明显(图1)。

图1 患者脚掌、膝盖皮肤过度角化、脱屑,手部皮肤无明显异常
5.口腔检查:颌面牙弓对称无偏斜,腭弓形状正常无高拱。2022年1月第一次就诊时口腔内可见53、63、65、75、83、85六颗乳牙,均为Ⅲ度松动。口腔卫生较差,牙龈颜色暗红色,质地松软。牙龈退缩4~5 mm,牙周袋深5~6 mm,探诊有出血及溢脓。无牙处牙龈黏膜正常无红肿破溃。2022年5月复诊口腔内可见53、63、75、85四颗乳牙,Ⅲ度松动。离体乳牙可见根尖完整,牙根外侧光滑,内侧表面粗糙。牙龈退缩4~5 mm,牙周袋深5~6 mm,探诊有出血及溢脓。全口曲面体层X线片显示全口牙槽骨广泛型水平型骨吸收,恒牙胚发育未见明显异常,乳牙骨吸收至根尖,累及第一恒磨牙(图2)。
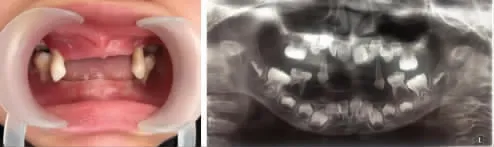
图2 患者口内彩照及曲面断层片
6.辅助检查:患者行血生化、甲状腺功能、性激素以及染色体核型分析等辅助检查。结果见25-羟维生素D3值偏低,余均无明显异常,染色体核型分析:46,XX。具体辅助检查项目及结果见表1。

表1 辅助检查项目及结果
7.遗传学检查:全外显子组测序发现患者CTSC基因(NM_001814)上存在1组复合杂合变异:①第2号外显子上c.189dupA杂合变异,导致氨基酸发生移码(p.V64Sfs*13)。根据美国医学遗传学与基因组学学会制定的遗传变异分类标准与指南,该变异可判定为可疑致病变异;蛋白功能预测软件REVEL预测为未知。Sanger测序结果显示患者母亲杂合携带该变异,其父亲及妹妹不携带该变异(图3),因此患者CTSC基因上的杂合变异c.189dupA遗传自其母亲。②第7号外显子上c.1379T>A杂合变异,导致第460号氨基酸由异亮氨酸变为天冬酰胺(p.I460N),该变异经蛋白功能预测软件REVEL预测为潜在有害。Sanger测序结果提示先证者父亲、母亲及妹妹均不携带该变异(图4),因此患者CTSC基因上的杂合变异c.1379T>A为新发变异。

图3 CTSC基因变异位点(c.189)Sanger测序结果

图4 CTSC基因变异位点(c.1379)Sanger测序结果
综上所述,CTSC基因上由移码变异c.189dupA和错义变异c.189dupA构成的复合杂合变异为患者的遗传学病因。
8.生物信息学分析:变异c.189dupA(p.V64Sfs*13)为移码变异,并可导致蛋白翻译提前终止。为探究变异c.1379T>A(p.I460N)对CTSC蛋白结构和功能的影响,我们进行了生物信息学分析。
CTSC蛋白具有二肽基肽酶活性,对由极性和疏水性氨基酸组成的各种二肽底物具有活性。首先通过SWISS MODEL软件模拟了CTSC蛋白的3D结构(图5)。

图5 SWISS MODEL软件模拟CTSC蛋白3D结构
我们对该变异可能对CTSC蛋白功能产生的影响进行探究,基于UNIPROT的记载CTSC蛋白的功能区域主要有两个:①活性位点为Cys258,His405以及Asn427;②结合位点为Phe302,Tyr304以及Tyr347。变异位置(p.I460N)和功能区域的分布情况见图6。

图6 变异位置(p.I460N)和功能区域分布
通过对比可以看出,变异p.I460N相对而言距离CSTC蛋白的结合区域更近。CSTC蛋白的功能是结合极性多肽或者疏水性多肽,而该变异导致第460号氨基酸由异亮氨酸变为天冬酰胺,也就是由疏水性氨基酸变异为亲水性氨基酸。因此通过蛋白3D结构模拟比对分析,预测变异后会影响CSTC蛋白与其他多肽的结合能力。
进一步探究变异对CTSC蛋白结构的影响,通过SWISS MODEL软件预测变异前后的CSTC蛋白结构。变异后,Ile460区域的蛋白质二级结构由原来的β折叠变成了无规则卷曲,见图7。

图7 Ile460区域蛋白质二级结构由β折叠变成无规则卷曲
因此通过蛋白3D结构模拟比对分析,可推测变异c.1379T>A(p.I460N)对CTSC蛋白的结构和功能都产生了影响,这可能是该变异的致病作用机制。
二、诊断
患者有典型牙齿过早脱落、严重牙周炎、牙龈退缩等口腔异常表现,以及双侧脚掌、膝盖皮肤过度角化、脱屑的皮肤异常,结合遗传学检查结果(CTSC基因上复合杂合变异),可明确诊断为掌跖角化-牙周破坏综合征。
三、治疗
牙周基础治疗,包括洁治、冲洗、上药。基础治疗后嘱每周复诊1次,观察治疗效果及炎症控制情况,期间嘱患者家长做好日常口腔清洁护理。计划拔除松动明显不能保留的乳牙,降低病原菌数量,减缓炎症的进展,必要时临时义齿修复。因特殊原因患者未能按时复诊,患牙自行脱落。现恒牙已逐渐萌出,观察治疗中。期间注意患者口腔卫生及牙龈炎症情况,必要时行牙周基础治疗,每月1次牙周支持治疗,恒牙根尖孔愈合后尤为重要。
四、讨论
1.Papillon-Lefèvre综合征及其发病机制:PLS是一种罕见的常染色体隐性遗传性疾病,以掌足底、肘部、膝盖等部位皮肤过度角化、皲裂、脱屑等,及早期出现的快速、严重的牙周破坏为特征,常导致乳恒牙早失,对成长中儿童的心理和生活质量都有一定的影响[4,5]。除了这些基本特征外,PLS患者还可能出现轻度智力低下、颅内钙化、指甲营养不良等。约20%~25%的PLS患者增加了对微生物感染的易感性,如皮肤脓肿、肾脓肿或肝脓肿[6,7]。本病较为罕见,人群中患病率约为1/1000000-4/1000000,由于父母近亲结婚占本病例50%以上[8]。
PLS的病因和发病机制非常复杂,最新研究其与CTSC基因异常有直接关系[9]。CTSC蛋白又称作二肽基肽酶I(DPPI),是半胱氨酸组织蛋白酶家族的成员之一,位于染色体11q14-q21上[10,11],在介导细胞毒性、吞噬破坏细菌、细胞因子的局部活化或失活方面具有重要作用[12]。到目前为止,在不同种族的人群中已经报告了110多个CTSC变异。其中,绝大多数CTSC变异都与PLS密切相关[13,14]。目前尚不清楚不同的变异是否会导致不同疾病的严重程度或中性粒细胞功能改变[15]。
牙周炎是一种慢性感染性疾病,以牙菌斑为始动因子,多种因素共同作用下导致牙齿支持组织的破坏。它的进展是宿主炎症-免疫反应异常的结果,其特征是慢性炎症被放大且无法消除,并导致牙齿支持组织的破坏[16]。目前研究表明,CTSC异常可导致中性粒细胞抗菌素LL-37肽缺乏,从而损害宿主的免疫能力[17]。还有人提出,在牙周组织中,过度活跃/反应的中性粒细胞的募集会导致促炎因子更高水平的释放,合并中性粒细胞的抗菌能力降低,可能导致局部破坏性的慢性炎症循环加剧,导致牙周组织的严重破坏[18]。另有研究表明,CTSC缺乏可导致细胞过度增殖,上皮细胞分化异常,可能影响牙周组织与牙面的粘连,导致牙周组织对病原体的机械屏障丧失,进而导致牙周炎和牙齿脱落[7]。
2.Papillon-Lefèvre综合征的诊断及鉴别诊断:目前PLS的诊断主要依据患者口腔、皮肤的临床表现以及基因检测结果确定。PLS患者的口腔临床症状包括菌斑堆积、多发性龋齿和严重牙周炎症等,2~3岁时明显。乳牙萌出完成后,牙周袋形成并出现进展迅速的牙周破坏,可伴有牙周脓肿。而无牙区的牙龈组织表现健康。可在4~5岁时出现乳牙早失。乳牙脱落后,牙周炎症消失,口腔粘膜呈现健康外观[19]。恒牙列的口腔表现与乳牙列相似。有文献报道,恒牙在发育过程中不受影响,在牙根发育完成后,牙龈炎症明显,牙周袋形成并伴有牙槽骨破坏。可有牙周溢脓,口臭,牙齿松动、脱落和错牙合畸形。影像学可表现为牙槽骨严重吸收,牙齿脱落、移位,一般不伴有牙根吸收[14]。PLS患者的皮肤病损表现为脚掌及手掌皮肤大面积的过度角化,可延伸到膝部、肘部、背部和手指,部分严重患者脚掌处可见黄色脱皮,病损处可见严重的细菌感染伴有恶臭。约20%的PLS患者因免疫功能紊乱伴有其他的机体异常,如皮肤、肝脏、肾脏和脑部的脓肿及硬脑膜钙化[20]。
PLS其他临床症状可能与肢端痛(Pinek’s病、Swift’s病)、低碱性磷酸酶血症、组织细胞增生症、周期性和先天性中性粒细胞减少症、Chediaki-Higashi综合征、Thost-Uny病和Meleda病(掌跖角化病)等相似[21]。PLS最常见的鉴别诊断是Haim-Munk综合征(Haim-Munk syndromes,HMS)和低碱性磷酸酶症(Hypophosphatasia,HPP)。HMS是一种罕见的常染色体隐性遗传病,也以掌跖角化及快速进展的牙周破坏为主要临床特征,但HMS多伴有指甲弯曲变厚、蜘蛛脚样指、肢端骨质溶解和扁平足。绝大部分HMS患者可发现CTSC基因的变异,现研究认为,HMS和PLS均由CTSC基因变异所致,但两种疾病临床表现差异的确切原因尚不可知。HPP是一种罕见的代谢性疾病,主要致病机制是肝/骨/肾型碱性磷酸酶基因变异导致不同程度的酶缺失。HPP临床除了表现为掌跖角化和进展性牙周炎,患者均表现为碱性磷酸酶的缺乏,可作为重要的鉴别诊断依据[22]。
3.Papillon-Lefèvre综合征的治疗措施:PLS患者的治疗措施较为复杂且预后较差,早期诊断并进行治疗对患者牙齿的保留、皮肤病损及身心健康至关重要。PLS患者口腔表现的早期管理包括消除致病微生物,使用常规牙周基础治疗、口腔卫生指导、漱口水和全身抗生素治疗;在生长发育期,必要时联合正畸和修复治疗[23]。皮肤病损的治疗常用抗炎润肤剂、角质溶解药物、水杨酸衍生物和类固醇[21]。研究表明口服维生素A类化合物可同时改善牙周组织的破坏[24]。为了减缓牙周破坏的迅速进展,应建议患者保持良好的口腔卫生,同时使用洗必泰含漱液。无法保留的乳牙或恒牙建议拔除,可使用传统可摘义齿修复,或种植修复,有时需结合生物材料的应用。成功的牙周管理是改善牙列预后、预防或延缓乳牙和恒牙早失的关键。强烈呼吁口腔专业人员熟悉并意识到此类疾病以及其早期诊断和治疗的重要性[23]。
在本研究中,结合典型临床表现及遗传学检查结果,该患者可明确诊断为PLS,CTSC基因上的复合杂合变异为其遗传学病因。通过生信预测分析变异c.1379T>A(p.I460N)对CTSC蛋白的影响,结果提示Ile460区域的蛋白质二级结构由β折叠变成了无规则卷曲,即对CTSC蛋白的结构和功能都产生了影响,这可能是该变异的致病作用机制,但尚需实验室实验进一步进行验证。

