E2F1、survivin和mutp53在口腔鳞状细胞癌中的表达及意义
王锦航 彭士雄 赵建广 陈彦平 崔子峰
头颈癌在全球发病率中排第七位,其中口腔鳞状细胞癌(oral squamous cell carcinomas,OSCC)较为多见[1]。近年对于OSCC的治疗方案不断更新,如在常规治疗中联合免疫、靶向治疗等新模式,这使得部分患者的无瘤生存期延长,但总体患者的五年生存率却没有显着改变,仍保持在50~60%[2],因此仍有必要阐明OSCC发生或进展的潜在分子机制。
E2F1是E2F转录因子家族成员,参与调控细胞周期、凋亡和DNA修复等过程,在乳腺癌、肺癌和胃癌等多数癌症中被证明高表达可以促进癌症的发生或进展[3]。survivin是凋亡蛋白抑制因子(inhibitor of apoptosis proteins,IAP)家族成员,在正常组织中低表达或不表达,但在多数癌症中却呈高表达,这一特性使其成为癌症治疗中潜在的理想靶标[4]。p53可通过诱导细胞凋亡或细胞周期停滞起到肿瘤抑制因子的作用,但在多数癌症中编码p53蛋白的TP53基因发生突变,产生突变型p53(mutant p53,mutp53),使原本的肿瘤抑制作用部分或完全丧失,从而促进恶性转化[5]。通过以上三者的特征推测,它们在OSCC中可能也发挥着重要的作用,因此本研究拟通过免疫组化检测E2F1、survivin和mutp53蛋白在OSCC中的表达情况,并探讨三者表达以及与患者临床病理特征间的相关性,为OSCC发生或进展机制的阐明提供新思路。
资料与方法
1.病例资料
收集于2013年1月至2014年12月间,52例经河北医科大学第四医院口腔颌面外科手术切除的OSCC患者肿瘤组织及相应癌旁组织(距肿瘤边缘>2.0 cm)样本,详细临床病理资料见表1。所有患者术前均未接受任何肿瘤相关治疗,且术后组织样本由至少两名病理科医师独立进行诊断,证实肿瘤组织具有典型鳞癌形态(图1)以及癌旁为正常组织。该研究已通过河北医科大学第四医院伦理委员会审批(编号:2020KY283),患者均已签署知情同意书。

图1 OSCC组织(HE,A×200,B×400)

表1 52例OSCC患者的临床病理资料
2.免疫组化染色和结果判定
取OSCC和相应癌旁样本的石蜡包埋组织,制成4μm的组织切片。SP试剂盒(中杉金桥生物技术有限公司,北京)行E2F1/survivin/mutp53蛋白的免疫组化染色。石蜡包埋的组织切片在二甲苯中脱蜡,100%~75%的梯度乙醇溶液中再水化,3% H2O215 min阻断内源性过氧化物酶活性,0.1M EDTA(pH8.0)/枸橼酸盐缓冲液(pH6.0)100℃2 min行抗原修复,正常羊血清封闭15 min。接下来,将切片与1:25的E2F1抗体(ab4070;NeoMarkers,USA)/1:50的survivin抗体(BM3975;博士德公司,武汉)/1:50的mutp53抗体(sc47698;普利莱基因技术有限公司,北京)4℃过夜,PBS冲洗后加入二抗(中杉金桥生物技术有限公司,北京)37℃15 min。然后,将切片用DAB显色(中杉金桥生物技术有限公司,北京),使用苏木精染色溶液复染1 min,置于80%~100%梯度乙醇溶液中脱水后,中性树胶封片。最后,在显微镜下观察染色的组织切片并捕获图像进行分析。以PBS缓冲液替代一抗的阴性切片作为阴性对照,E2F1、mutp53蛋白阳性表达为细胞核内呈棕褐色的颗粒,survivin蛋白阳性表达为细胞质或细胞核中呈棕黄色的颗粒。
判定标准为5个高倍镜视野中计算100个肿瘤细胞中蛋白表达的阳性细胞百分比,<5% 0分,5%~<25% 1分,25%~<50% 2分,51%~75% 3分,>75% 4分;染色水平,无色0分,淡黄色1分,棕黄色2分,棕褐色3分。两项评分相加为每例标本蛋白表达的积分:0~1分 阴性(-),2~3分 弱阳性(+),4~5分 中度阳性(++),6~7分 强阳性(+++)。免疫组化结果至少由2名病理科医师在双盲情况下观察所得。
3.统计学处理
应用SPSS(v17.0)软件行统计学处理,计数资料由n表示。表达差异应用χ2检验分析,表达间的相关性应用Spearman等级相关性分析,与临床病例特征的相关性应用非参数Mann-Whitney U检验(两组间)和非参数Kruskal-Wallis检验(多组间)分析。结果均以P<0.05为差异具有统计学意义。
结 果
1.E2F1、survivin和mutp53蛋白在OSCC和癌旁组织中的表达差异分析
E2F1(图2)、mutp53(图3)的阳性产物呈深褐色颗粒位于细胞核,survivin(图4)的阳性产物呈棕黄色的颗粒多数位于细胞核。分析结果由表2所示,E2F1、survivin和mutp53蛋白在OSCC组织中的阳性表达率分别为75.00%(39/52)、88.50%(46/52)和82.70%(43/52),均高于相应癌旁组织(P<0.001)。

表2 免疫组化检测E2F1、survivin和mutp53蛋白的表达

图2 E2F1在OSCC和癌旁组织中的表达
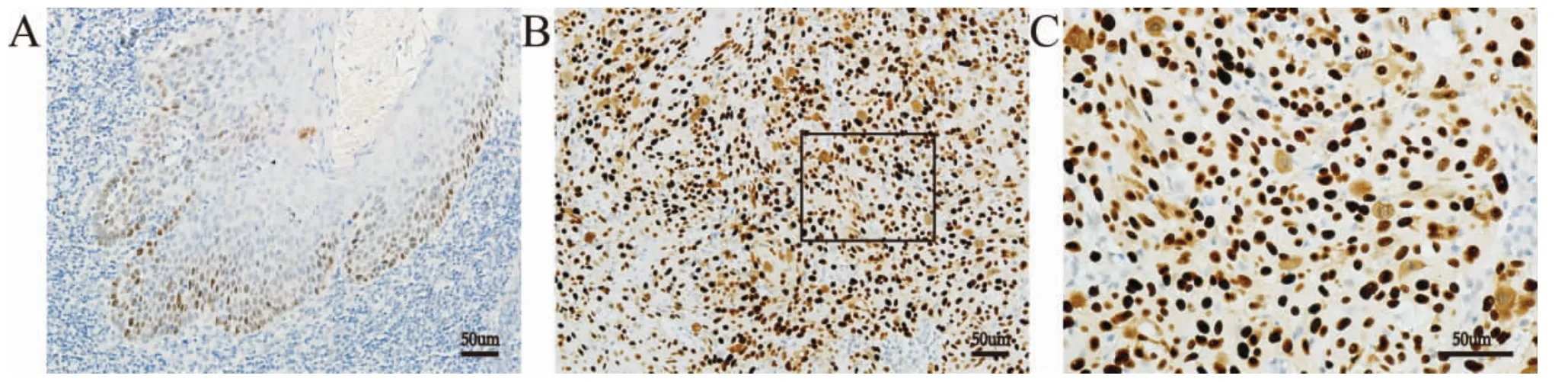
图3 mutp53在OSCC和癌旁组织中的表达

图4 survivin在OSCC和癌旁组织中的表达
2.OSCC组织中E2F1与survivin、mutp53蛋白表达间的相关性分析
对OSCC组织中E2F1、survivin和mutp53蛋白免疫组化结果行Spearman等级相关性分析。结果由表3所示,OSCC组织中E2F1蛋白的表达与survivin(rs=0.446,P=0.001)和mutp53(rs=0.386,P=0.005)蛋白的表达均呈正相关。

表3 OSCC中E2F1与survivin、mutp53蛋白表达间的相关性
3.OSCC组织中E2F1、survivin和mutp53蛋白表达水平与患者临床病理特征间的相关性分析
分析结果由表4所示,E2F1蛋白的表达水平与OSCC患者的性别(P=0.5864)、年龄(P=0.352)、细胞分化(P=0.089)、淋巴结转移(P=0.097)和肿瘤分期(P=0.247)均无相关性。survivin蛋白表达水平与OSCC患者的细胞分化(P=0.005)、淋巴结转移(P<0.001)及肿瘤分期(P<0.001)相关,但与年龄(P=0.385)和性别(P=0.693)无关。mutp53蛋白表达水平与OSCC患者的细胞分化(P=0.001)、淋巴结转移(P<0.001)及肿瘤分期(P<0.001)相关,但与年龄(P=0.875)和性别(P=0.838)无关。
讨 论
E2F1作为调控数千个下游靶基因的转录因子在细胞核中起着重要作用,其异常表达可影响肿瘤细胞的代谢重编程或肿瘤进展[6]。Jiang等[7]研究表明,E2F1可通过影响葡萄糖摄取、乳酸或ATP产生来调节尤因肉瘤细胞中的有氧糖酵解途径以促进病情发展,可作为潜在的治疗靶点。Chen等[8]的研究中,E2F1在肾透明细胞癌中呈高表达,并且其高表达与患者的总生存期和无进展期较短有显著相关性,表明E2F1可能起到促癌作用。但另有研究却发现相反的结论,如在前列腺癌中E2F1充当肿瘤抑制因子的角色[9],这可能取决于不同病理组织的特异性。尽管在多种癌症中E2F1的功能已经得到明确,但尚未证实其在OSCC发生或恶性进展中是否发挥作用。本研究通过免疫组化分析发现E2F1蛋白在OSCC中呈高表达,可能发挥促癌基因的作用。但在进一步分析与OSCC患者临床病理的关系时发现,E2F1的高表达与性别、年龄、细胞分化、淋巴结转移和肿瘤分期均无相关性。这与Shen等[10]研究结论相似,E2F1在胃癌组织中的表达高于低级别上皮内瘤变组织,但与胃癌患者的淋巴结转移、临床分期、浸润深度和远处转移等因素均无相关性,提示E2F1的突变过表达可能发生在癌变早期,待完全转变为恶性后其表达则无明显变化。因此,本研究推测OSCC中E2F1蛋白的高表达可能也是癌变早期的关键步骤,值得进一步探讨证实。
为挖掘可能与E2F1发挥协同作用的异常活化蛋白,研究选择了具有E2F结合位点的survivin蛋白进行分析[11]。作为IAP家族中最小的成员,survivin在胚胎发育过程中起着重要作用,但在多数终末分化的组织中表达却是沉默的,这使得成年人中survivin的表达被视为癌症的首要指标[12]。而survivin同时也是p53的直接靶标,这也从p53的抑制作用解释了成年人体内缺乏survivin的原因[13]。作为一种强大的癌症抑制因子,p53可通过促进细胞生长停滞、DNA修复以及调节自噬或代谢等方式来保护基因组[14],然而编码p53肿瘤抑制蛋白的TP53基因约在50%的人类癌症中高度突变,导致完整p53蛋白中的单个氨基酸被取代而产生mutp53,使原本具有的肿瘤抑制作用部分或完全丧失,并获得独立于野生型p53的新致癌活性[15,16]。本研究先行通过免疫组化检测了survivin和mutp53蛋白的表达,发现两者均在OSCC中呈高表达,并且都与患者的细胞分化、淋巴结转移及肿瘤分期相关,其中强阳性例数随细胞分化越低、伴有淋巴结转移或TNM分期越高等因素而增多。进一步经Spearman等级相关性分析发现,E2F1蛋白的表达水平与survivin和mutp53蛋白的表达水平均呈正相关。这些实验验证了本研究之前假设,survivin和mutp53的异常高表达状态可能在OSCC的发生或进展中与E2F1发挥着协同作用。

