两种常见基因突变对早期人工耳蜗植入儿童听觉言语发展的影响
卢星 王斌 宋凡 秦兆冰
郑州大学第一附属医院耳鼻喉医院耳科(郑州 450000)
人工耳蜗植入(cochlear implantation,CI)是帮助重度极重度感音神经性聋患儿重建听力、发展言语的有效手段。然而,CI儿童的听觉言语能力仍存在较大的个体间差异,不同的遗传病因也被认为是除了植入年龄和植入时间之外的重要影响因素。GJB2、SLC26A4基因突变是在我国听障人群中最为常见的两大致聋基因,二者对于CI儿童术后的听觉言语能力的影响尚无定论。本研究探讨了伴有GJB2或SLC26A4基因突变的早期植入儿童的听觉言语发展,旨在避免植入年龄对康复效果的影响,期望为指导临床咨询、预测康复效果,建立合理期望值提供依据和参考。
1 资料与方法
1.1 研究对象
选择2014年7月-2018年7月在我院接受单侧CI的211例语前聋患儿为研究对象。纳入标准:1.双侧重度或极重度感音神经性聋;2.植入年龄≤3.5岁的语前聋患儿;3.接受至少1年系统的听觉言语康复训练。排除标准:1.内耳结构畸形患者,仅有前庭水管扩大者除外;2.合并智力障碍或身体其他部位残疾者;3.缺席随访≥2次者;4.有其他已知原因致耳聋者。本研究通过医院伦理委员会审批。所有受试儿童家长已签署知情同意书。
1.2 研究方法
1.2.1 术前检查及分组方法
所有患儿术前均行相关听力学检查、影像学检查及基因检测。采集受试者外周静脉血样本,使用试剂盒(北京天根生化科技公司)提取DNA,应用耳聋基因芯片(北京博奥生物有限公司)按照操作说明进行遗传性聋基因突变热点的筛查,该芯片可检测出中国人群中4个常见耳聋基因共9个突变位点,包括GJB2(35delG,235delC,176del6bp及299delAT)、SLC26A4(IVS7-2A>G,2168A>G)、GJB3(538C>T)及 线 粒 体 DNA12SrRNA(1494C>T,1555A>G)。对行基因芯片检测未发现SLC26A4基因的2168A>G(H723R)或IVS7-2A>G突变者标本行SLC26A4基因全外显子测序。对行基因芯片检测未发现GJB2基因突变或仅检测到单个杂合突变患者再行GJB2基因全外显子测序。
根据基因检测结果将CI儿童分为GJB2基因突变组,SLC26A4基因突变组,未检出耳聋基因突变者纳入对照组。
1.2.2 听觉言语能力评估
由同一位经过培训的专业人员评估研究对象的听觉言语能力,评估时间分别为术前及开机后6个月、12个月、18个月、24个月和36个月。
评估内容包括:有意义听觉整合量表(Meaningful Auditory Integration Scale,MAIS)或婴幼儿有意义听觉整合量表(Infant-Toddler Meaningful Auditory Integration Scale,ITMAIS),根据受试儿童年龄选择量表,小于3岁者采用ITMAIS,大于等于3岁儿童采用MAIS量表。评估人员就量表中的10个问题逐一询问受试儿童家长,其根据患儿的听觉行为给予详细的描述和举例。评估人员根据患儿听觉行为出现的频率采用0-4分进行评分,0分表示该听觉行为从未发生,1分表示该听觉行为发生的频率为0-25%,2分表示该听觉行为发生的频率为25%-50%,3分表示该听觉行为发生的频率为50%-75%,4分表示该听觉行为发生的频率为75%-100%。ITMAIS/MAIS量表得分以各问题实际得分之和占理论总分的百分比的形式记录。
听觉行为分级(Categories of Auditory Performance,CAP)分8个等级,用0-7分表示。
汉语沟通发展量表短表(Putonghua Communitive Development Inventory,PCDI),包括词汇和手势(Word&Gesture)以及词汇和句子(Word&Sentence)两个量表。W&G量表适用于生理年龄为8-16个月的婴幼儿,共有106个词汇,考察研究对象的词汇理解和词汇表达能力。W&S量表适用于生理年龄为16-30个月的幼儿,共有113个词汇,重点评估词汇表达能力。由专业人员就量表中的问题和词汇逐一询问家长,确定受试儿童听懂和会说的词汇。测试结果以量表第二部分听懂或会说的词汇数目表示。
有意义言语使用量表(Meaningful Use of Speech Scale,MUSS),共10个问题,评估患儿在生活中自发使用言语的情况,评估方式同ITMAIS/MAIS量表。0分-该行为从未出现;1分-该行为很少出现,频率<50%;2分-该行为有时出现,频率≥50%不足75%;3分-该行为经常出现,频率≥75%;4分-该行为总是出现,频率为100%。MUSS得分为各问题得分之和占理论总分的百分比。
1.3 统计分析
采用SPSS21.0进行统计学分析。计量资料以表示,计数资料用频数表示,组间比较采用χ2检验。三组CI儿童的康复结果的比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
本研究共纳入CI儿童211例,其中GJB2基因突变组65例(包括c.235delC纯合突变34例,复合杂合突变31例),SLC26A4基因突变组42例(包括c.919-2A>G纯合突变11例和复合杂合突变31例),均伴有前庭水管扩大,对照组104例。所有研究对象的CI手术均由同一位医生主刀完成,手术均一次成功,术中电极完全植入,术中检测正常,术后无并发症发生。植入体类型为澳大利亚CI24RE(CA)50例,澳大利亚CI422 35例,奥地利Med-EL Sonata ti100 81例,美国AB HiRes90HiFocus 1j 45例。三组CI儿童一般资料见表1。
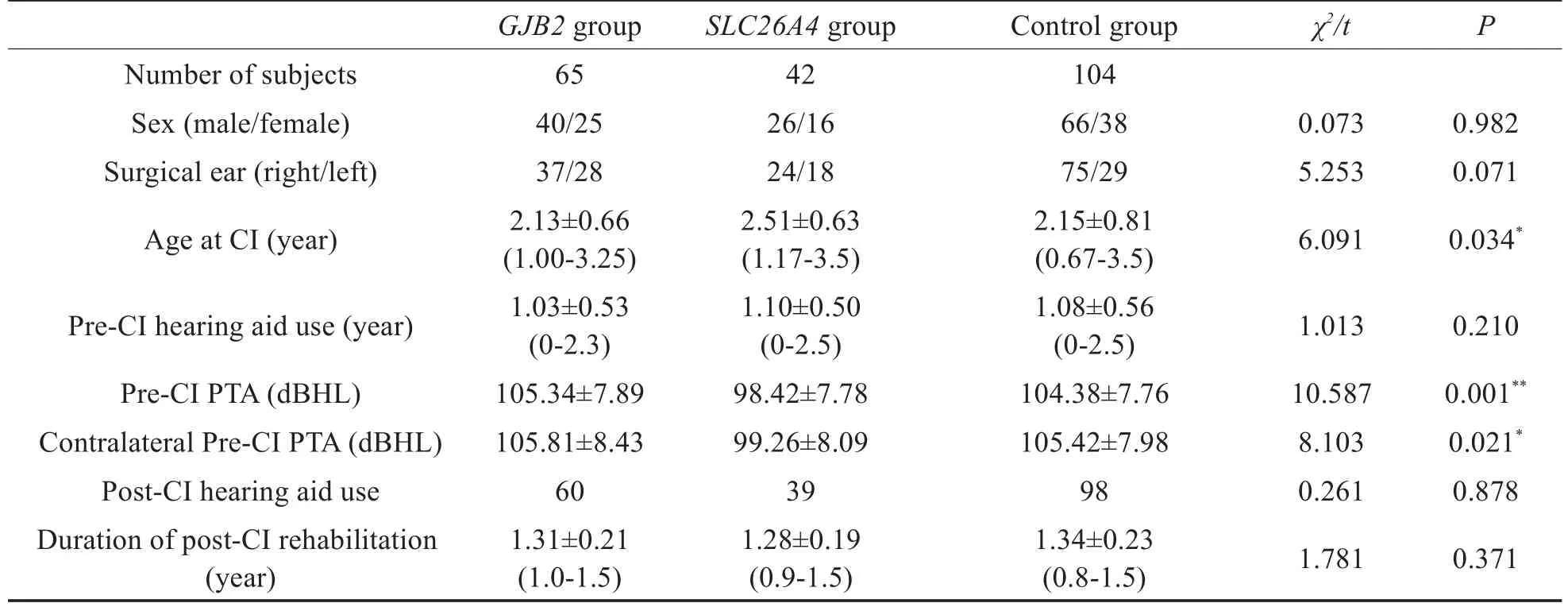
表1 三组CI儿童一般资料Table 1 Characterization of three groups
2.2 三组CI儿童术后听觉言语康复结果比较
2.2.1 三组CI儿童术后不同时间ITMAIS/MAIS量表结果
三组CI儿童的ITMAIS/MAIS量表得分随着术后康复时间的延长,得分均不断提升。三组在术前、开机6个月、12个月及18个月时得分有明显差异,事后比较显示SLC26A4组CI儿童在术前、开机6个月、12个月及18个月时的得分均高于相同时间点GJB2组和对照组CI儿童的得分,差异有统计学意义(P<0.05),GJB2组和对照组得分无差异。在开机24个月及36个月时,三组间的差异无统计学意义(P>0.05)。结果见图1。
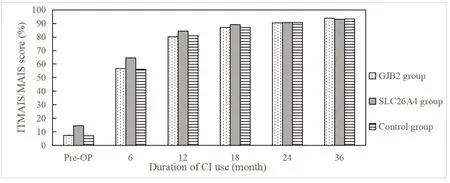
图1 三组CI儿童ITMAIS/MAIS量表得分Fig.1 ITMAIS/MAIS scores in three groups
2.2.2 三组CI儿童术后不同时间CAP得分
三组CI儿童的CAP得分在术后各时间点逐步提升。术前及开机6个月时,三组得分有差异,事后多重比较显示SLC26A4组得分优于GJB2组和对照组得分(P<0.05),GJB2组和对照组CI儿童得分无明显差异。在其他时间点,三组间的差异无统计学意义(P>0.05)。见图2。
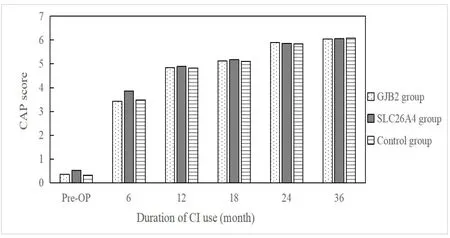
图2 三组CI儿童CAP得分Fig.2 CAP scores in three groups
2.2.3 三组CI儿童术后不同时间PCDI量表结果
三组CI儿童的PCDI量表得分随着术后康复时间的延长,得分均不断提高。在术前、开机6个月及12个月时三组间词汇理解得分有差异,SLC26A4组得分高于相同时间点GJB2组和对照组CI儿童的得分(P<0.05),余时间点三组未见明显差异。在各随访时间点,三组词汇表达得分的差异无统计学意义(P>0.05)。结果见图3,4。

图3 三组CI儿童词汇理解得分Fig.3 PCDI word reception scores in three groups

图4 三组CI儿童词汇表达得分Fig.4 PCDI word expression scores in three groups
2.2.4 三组CI儿童术后不同时间MUSS量表得分
三组CI儿童的MUSS量表得分随着术后康复时间的延长,得分逐步提高。在各随访时间点三组得分对比,差异均无统计学意义(P>0.05)。见图5。
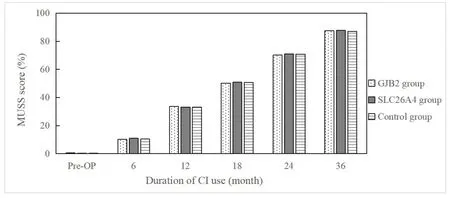
图5 三组CI儿童MUSS得分Fig.5 MUSS scores in three groups
2.2.5 三组按植入年龄分层后结果比较
在GJB2组,SLC26A4组及对照组内,分别按照年龄分为≤2岁组及2-3.5岁组,即≤2岁GJB2组(34例),2-3.5岁GJB2组(31例),≤2岁SLC26A4组(18例),2-3.5岁SLC26A4组(24例),≤2岁对照组(53例)及2-3.5岁对照组(51例)。比较不同基因组内≤2岁者与2-3.5岁者的结果,低龄组显示出相对较好的听觉言语能力,ITMAIS/MAIS得分在开机6个月、12个月及18个月时,≤2岁GJB2组优于2-3.5岁GJB2组,≤2岁SLC26A4组优于2-3.5岁SLC26A4组,≤2岁对照组优于2-3.5岁对照组(P<0.05,表2)。PCDI词汇理解得分在开机6个月、12个月、18个月及24个月时,≤2岁GJB2组优于2-3.5岁GJB2组,≤2岁SLC26A4组优于 2-3.5岁SLC26A4组,≤2岁对照组优于2-3.5岁对照组(P<0.05,表4)。PCDI词汇表达得分,在开机12个月、18个月及24个月时,≤2岁GJB2组优于2-3.5岁GJB2组,≤2岁SLC26A4组优于2-3.5岁SLC26A4组,≤2岁对照组优于2-3.5岁对照组(P<0.05,表5),在其余时间点,不同基因组内≤2岁和2-3.5岁组的得分无明显差异。CAP得分以及MUSS得分在术后各个时间点,在不同基因组内≤2岁组和2-3.5岁组得分无明显差异(P>0.05,表3,6)。
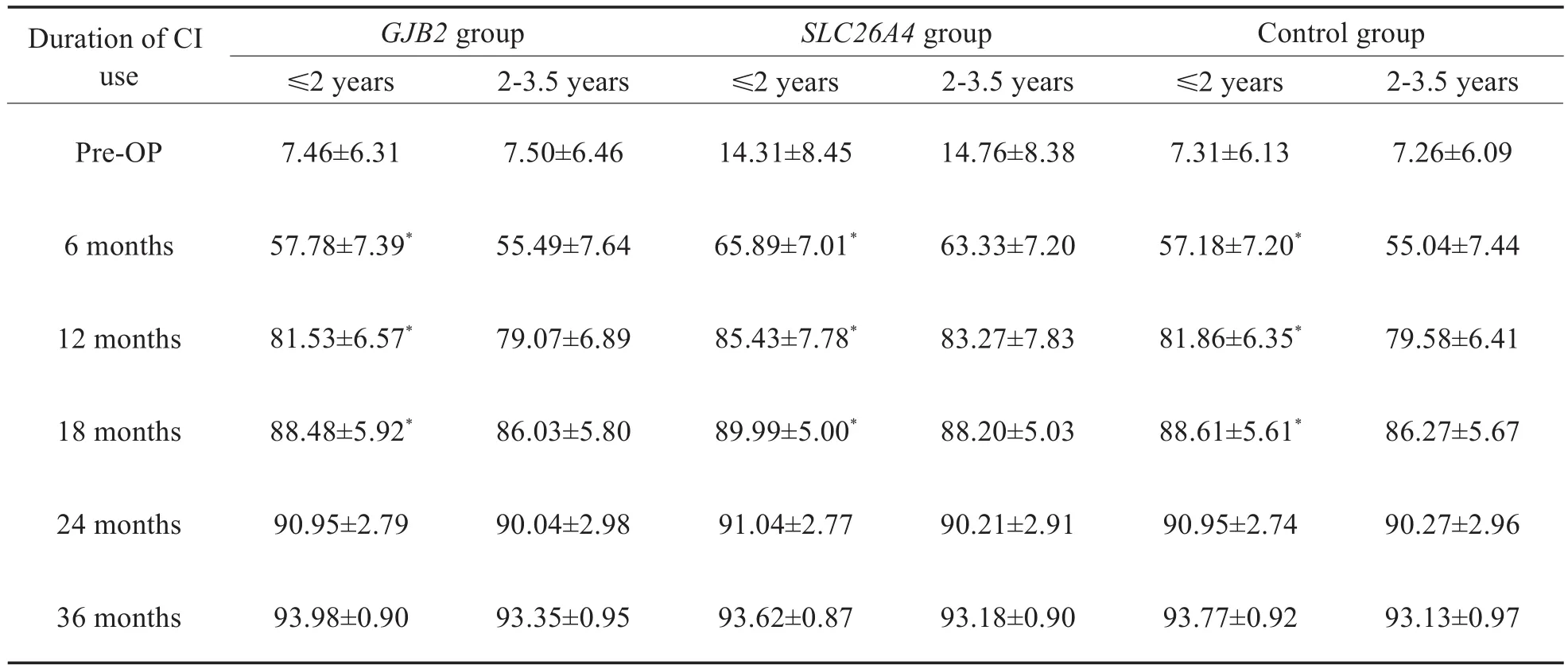
表2 不同基因组≤2岁和2-3.5岁CI儿童ITMAIS/MAIS得分Table 2 Comparison of ITMAIS/MAIS scores between age sub-groups
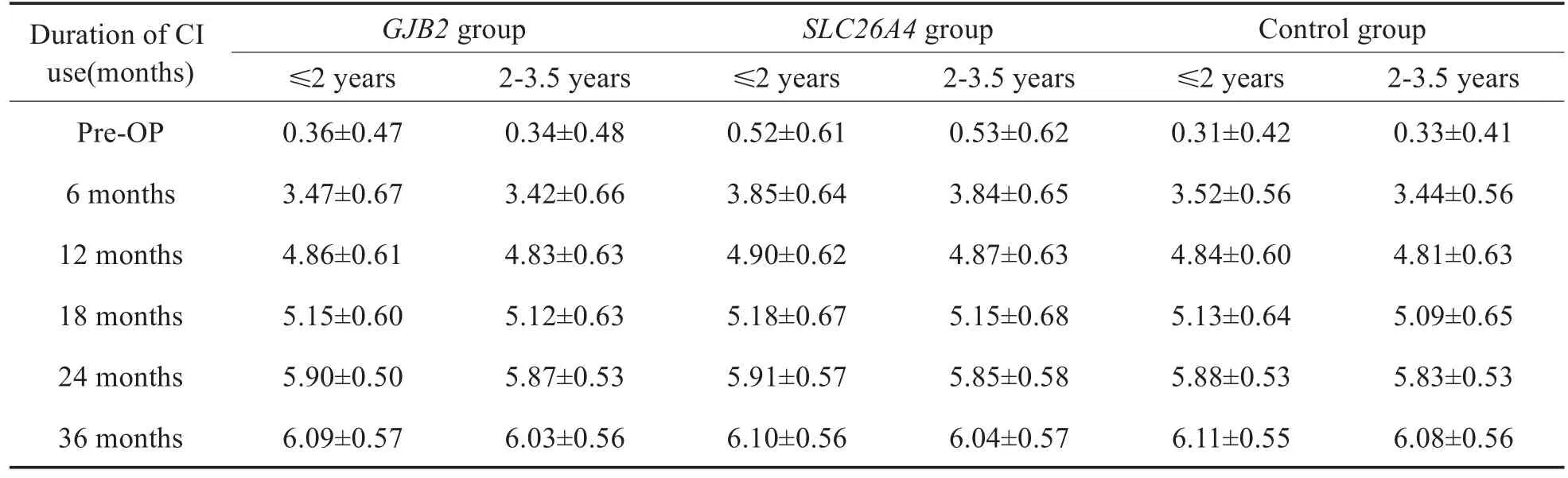
表3 不同基因组≤2岁和2-3.5岁CI儿童CAP得分Table 3 Comparison of CAP scores between age sub-groups
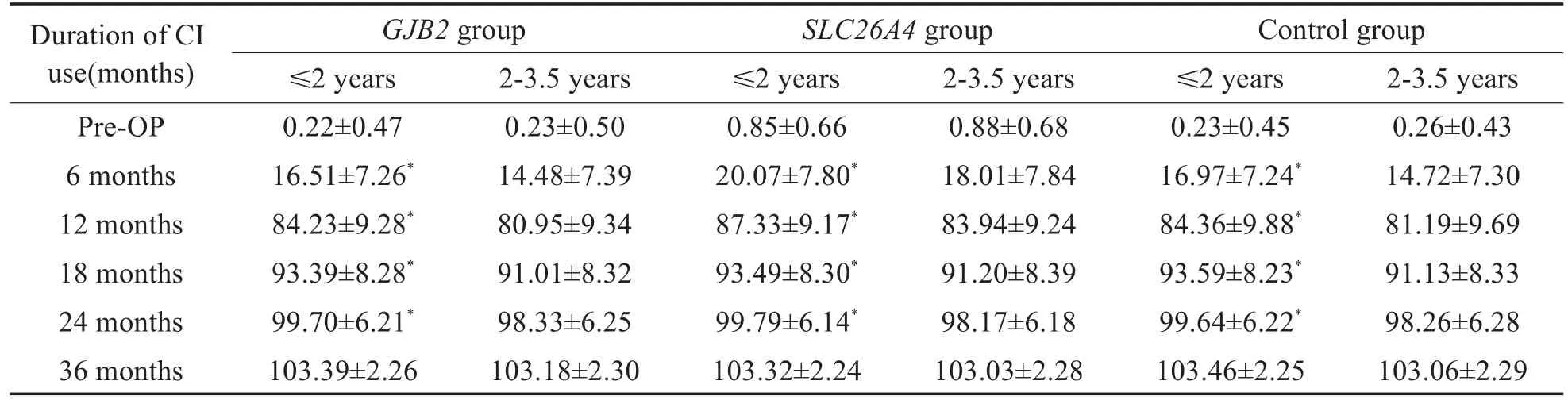
表4 不同基因组≤2岁和2-3.5岁CI儿童PCDI词汇理解得分Table 4 Comparison of PCDI word reception scores between age sub-groups
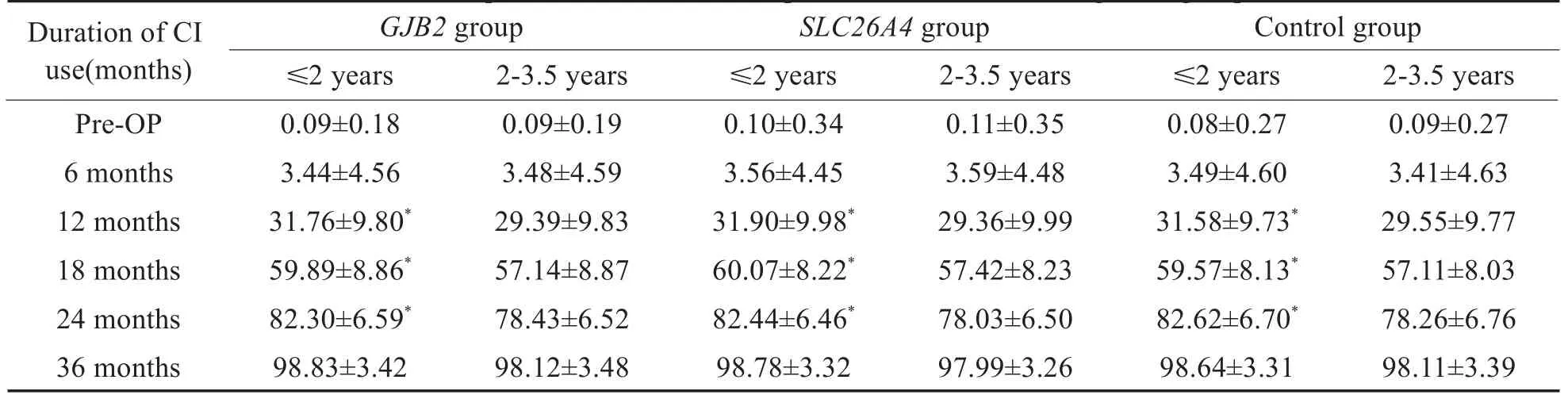
表5 不同基因组≤2岁和2-3.5岁CI儿童PCDI词汇表达得分Table 5 Comparison of PCDI word expression scores between age sub-groups
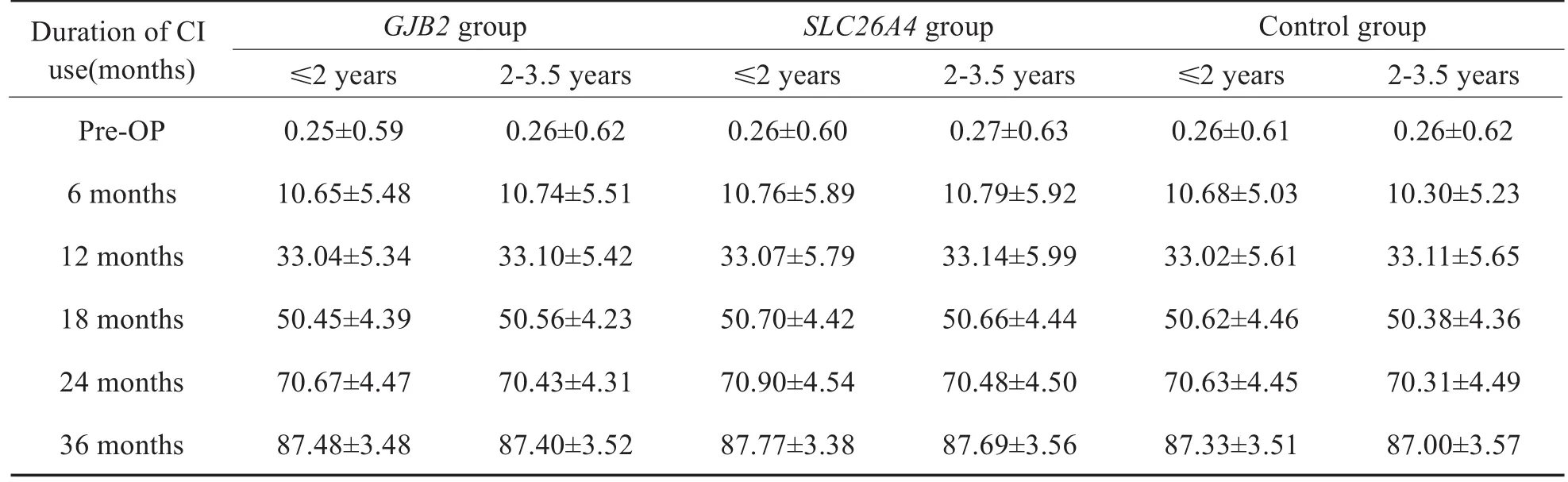
表6 不同基因组≤2岁和2-3.5岁CI儿童MUSS得分Table 6 Comparison of MUSS scores among between sub-groups
3 讨论
GJB2基因突变是导致先天性聋的最常见原因,其发病机制被认为是当基因突变时,编码的缝隙连接蛋白功能异常,出现钾离子循环障碍致钾离子中毒进而引起毛细胞功能受损及听力下降。SLC26A基因突变是我国第二大常见致聋基因,是前庭水管扩大相关耳聋的常见原因,编码在血管纹中表达的阴离子转运蛋白。Eppsteiner等[1]推测致聋基因的表达部位将对植入效果起到很大作用,表达于螺旋神经节的基因突变与较差的CI预后相关,而表达于膜迷路的基因突变则预示良好的植入效果,因为CI的作用绕过了耳蜗毛细胞,直接刺激螺旋神经节,正常的螺旋神经节细胞和完整的听觉通路是CI疗效的关键。GJB2和SLC26A4这两种常见的耳聋相关基因对螺旋神经节的影响很小,有望在CI术后获得良好的听觉言语效果。
关于GJB2基因突变或SLC26A基因突变是否影响CI儿童术后的听觉言语能力,研究报道并不一致。有研究显示,伴有GJB2突变的CI儿童在听觉能力[2,3]、词汇及句子识别[4-6]、阅读能力[7,8]以及表达性语言[9]等多个方面的表现均优于不伴基因突变的CI儿童,SLC26A4突变的植入儿童在言语感知方面也有相似的表现[2,10,11]。也有一些文献报道基因突变未能表现出对植入效果的积极作用,GJB2或SLC26A4突变的CI儿童的言语感知、听觉能力及噪声下言语识别和未检出基因突变聋儿相比无明显差异[12-17]。多个研究结果之间的差异,可能由于入选研究对象的年龄范围不同、病例数不同、所采用的评估工具不同,随访时间不同等多个因素所致。植入年龄被认为是影响康复效果的重要因素。然而,上述研究大多都存在年龄跨度较大的现象,例如Popov等[4]及Mostafa[5]等的研究对象的年龄范围为1-7岁,Wu等[2]的研究中CI儿童的平均年龄为7.2岁,Karament等[17]及Kim等[16]的受试儿童的年龄跨度达1-14岁,这就无法避免年龄因素对康复效果的影响。Wu等[18]的研究显示,在3.5岁前接受CI的伴有GJB2或SLC26A4基因突变的聋儿,术后远期的听觉能力和言语可懂度均优于未检出基因突变者。然而植入年龄大于3.5岁的基因突变聋儿的听觉言语表现则无异于未检出基因突变者。因此,本研究重点关注了伴有GJB2突变或SLC26A4突变的早期植入(≤3.5岁)儿童,这也是基于Sharma等[19]提出的早期植入的年龄分界点,期望通过减少年龄因素对康复结果的影响,进一步了解GJB2突变或SLC26A4突变对CI儿童听觉言语发展的作用。
本研究显示三组CI儿童在术后3年内的听觉能力、言语识别和词汇能力逐步提升,经历了听觉察觉、辨识、词汇理解及词汇表达的发展过程,首先是听觉能力的快速发展,在术后1年内的进步最快,而言语能力的发展相对平缓,说明言语能力是基于听觉能力而发展的。伴有GJB2基因突变的聋儿在CI术后3年内各个随访时间点的听觉言语能力和对照组儿童无明显差异。SLC26A4组的植入年龄略大于其余两组,这与SLC26A4组中有部分患者术前有过残余听力和听觉经验有关,体现在SCL26A4组的术前裸耳听阈及量表评估结果优于其他两组。这为他们术后获得更好的康复效果奠定了基础,是术后早期的听觉及词汇理解能力优于其他两组儿童的原因。SLC26A4突变患儿的听觉言语优势主要体现在术后1年半内,CAP得分的优势仅体现在术后半年内,可能与CAP的评估内容较为粗略有关。随着康复时间的延长,SLC26A4突变患儿的优势逐渐弱化,在术后24个月至36个月时,三组CI儿童能到达相似的康复效果。此外,SLC26A4基因突变并未表现出对词汇表达及言语使用的积极作用,可能由于患儿的听损程度重,有限的残余听力即使经过助听器的佩戴,绝大部分仅表现为听觉能力的初步发展,难以对词汇表达及言语使用等高级阶段的能力产生积极的影响,因此,积极早期植入对其听觉言语的康复也至关重要。Wu等[18]的长期研究显示,在术后3年时,GJB2突变和SCL26A4突变的CI儿童的CAP、SIR得分均优于未检出突变组,而在术后5年时,两种致聋基因已显现不出对CAP和SIR结果的影响,两组患儿的表现无异于未检出突变者。作者认为此时的受试儿童大多已达到较高的能力水平,这可能是病因不再表现出积极作用的原因。本研究中,术后3年时MAIS结果在三组CI儿童已显现出天花板效应,这是得分无差异的原因之一,此时基因突变也未显示对CAP得分的影响,这说明经过较长时间的CI使用,两种常见基因突变的植入儿童都能达到良好的康复效果。Abdurehim等[20]通过meta分析发现GJB2相关耳聋患儿CI术后的言语识别能力和非综合症性耳聋以及其他遗传性耳聋患儿相比无差异,但优于环境病因(包括低出生体重、早产、宫内感染、脑膜炎、巨细胞感染和风疹)致聋患儿的康复效果,这是因为后者很可能伴有高级中枢及认知功能等方面的缺陷。Wu等[18]也认为,GJB2或SLC26A4突变的患者受益于完整的听觉通路,相比于病因不明的患者能获得更满意的结果,而后者的耳聋原因各不相同,因此降低了整体的康复效果。在不同基因组内,≤2岁CI儿童均表现出更好的听觉言语效果,ITMAIS/MAIS在开机24个月及36个月时,PCDI结果在开机36个月时,低龄组的得分未表现出优势,可能与这两种测试此时已达到天花板效应有关。不同植入年龄的CI儿童的CAP及MUSS结果在术后各个时间点并未显示出差异,可能由于这两种评估工具为主观问卷,CAP评分的分级标准较为粗略,MUSS问卷反映了在日常生活中对言语的使用能力,更适用于术后中远期言语能力的评估。这也进一步说明,3.5岁以内接受手术的植入儿童均有望获得良好的康复效果。总之,我们以及国外的研究结果都支持了Eppsteiner RW等的推测,致聋基因的表达部位将影响植入效果,基因突变未累及听神经和听觉传导通路预示着良好的康复效果。
本研究通过对GJB2或SLC26A4基因突变聋儿CI术后听觉言语能力的随访评估,显示了SLC26A4基因突变对康复效果的动态影响,尤其对植入后早期的听觉言语发展有积极作用,GJB2或SLC26A4基因突变预示着良好的康复效果。基因检测有助于预估CI儿童的康复效果。然而本研究仍存在病例数少,随访时间短及对照组病因未细化等方面的不足,这也是今后的研究工作中应进一步关注的内容。

