1007例新生儿听力筛查及耳聋基因测序结果分析
黄卫彤 刘锦嵩 王宗杰 廖旺 张峰,4 朱茂灵 鄢盛恺*
1南宁市妇幼保健院(南宁 530011)
2遵义医科大学附属医院检验科(遵义 563003)
3遵义医科大学检验医学院(遵义 563006)
4中国科学院北京基因组学研究所(北京 100101)
听力损失(hearing loss,HL),即耳聋,是一种常见的导致听觉敏感度下降的疾病,严重降低患者的生存质量。根据世界卫生组织的最新数据,世界上约有4.3亿人患有HL,包括3400万儿童,超过世界人口的5%;预计到2050年,患有各种程度HL的人数将达25亿人,至少7亿人需要听力康复治疗[1]。HL的发病主要受到遗传和环境两方面因素的影响,其中与遗传因素相关的HL占60%,根据临床表现,遗传性HL(hereditary hearing loss,HHL)患者中70%为非综合征型HL(Nonsyndromic hearing loss,NSHL),30% 为综合征型 HL(Syndromic hearing loss,SHL)[2]。耳聋的基因组异质性很高,广泛的研究表明,HHL的耳聋基因突变频率在不同地区和不同民族之间差异很大,为了进一步分析南宁市新生儿耳聋基因突变情况以及耳聋基因突变与HL的关联性,本研究针对GJB2、SLC26A4和GJB3采用靶向捕获高通量测序方法对1007例听力初筛未通过的新生儿进行测序分析,以评估新生儿听力筛查的准确性,为耳聋致病基因联合新生儿听力筛查的应用提供参考。
1 材料与方法
1.1 研究对象
随机选取出生于2016年1月-2018年12月经南宁市新生儿疾病筛查中心17000名新生儿听力初筛未通过的1007例新生儿为研究对象,并收集其足跟血样本进行耳聋相关基因靶向捕获高通量测序(包括GJB2、GJB3、SLC26A4),通过广西全民健康信息平台查看这些新生儿的基本信息、听力复筛和确诊结果。本研究由南宁市妇幼保健院伦理委员会批准许可,所有参与该研究的新生儿家属都签署了知情同意书。
1.2 新生儿听力筛查方法
听力初筛采用RESONANCE®R14O筛查型耳声发射仪(意大利产)进行耳声发射(Otoacoustic emission,OAE)检测,在新生儿出生后48~72h或出院前完成,初筛未通过者在出生后的42天内完成复筛,复筛采用OAE和自动听性脑干诱发电位反应(Automatic auditory brainstem response,AABR)组合检测,测试环境噪声均低于30dB(A),AABR以在正常听力级30~35dBnHL能引出V波为通过,一律双耳复筛,仍未通过者则在出生后3~6个月时进行HL确诊检查。确诊检查采用听性脑干反应(Auditory brainstem response,ABR)阈值做听力损失分级:平均听阈31-50dBnHL为轻度,51-70dBnHL为中度,平均听阈71-90dBnHL为重度,≥90dBnHL为极重度。
1.3 标本采集和DNA准备
由护士采集新生儿静脉血或足跟血,制成3个血斑滤纸并晾干,保存于-20度冰箱,留待检测。用血片打孔器将血斑打孔得到6mm直径的干燥血斑,经萃取后,用DNA提取试剂(北京天根生化科技有限公司)提取基因组DNA。
1.4 标本采集和DNA准备
根据Illumina MiniSeq平台的操作流程将提取的gDNA用于文库的构建和测序,测序流程可简单概括为:样本gDNA浓度的检测、文库给构建,对目的片段进行富集扩增以及纯化、文库的定量和质检、上机测序以及数据过滤。仪器包括PCR仪(ABI 2720 PCR),荧光定量PCR仪(ABI 7500)、测序仪(Illumina MiniSeq),配套试剂有PCR反应试剂(TAKARA Multiplex PCR Assay Kit ver.2)、文库定量试剂盒(KAPA Library Quantification Kit Illumina platforms)。
1.5 统计分析
等位基因频率,关联分析,H-W遗传平衡效验采用PLINK 1.9[3]程序包进行分析,P>0.05符合HW遗传平衡,关联分析用比值比(odd ratio,OR)表示,P<0.01为具有统计学意义;其他数据采用SPSS 19.0进行分析,突变等位基因频率和突变携带率以百分率(%)表示。
1.6 突变生物信息分析
运用BWA(Burrows Wheeler Aligner)软件与人类基因组hg19进行比对单核苷酸多态性(SNPs)和插入缺失(indel)。通过Picard和GATK等软件进行鉴定并采用snpEff软件和dbSNP、千人基因组数据库、HGMD、ClinVar等数据库进行基因注释和功能预测。根据《遗传变异分类标准与指南》,将突变的临床意义定义为“致病的”、“可能致病的”、“意义不明确的(VUS)”、“可能良性的”和“良性的”[4]。
1.7 蛋白结构预测
运用RaptorX在线服务器[5]预测候选基因表达出的三维蛋白结构,用PyMOL对RaptorX预测的蛋白质三维结构进行图像处理。候选突变基因表达的氨基酸序列参考NCBI数据库,比较突变型和野生型蛋白的二级结构及功能变化。
2 结果
2.1 新生儿听力筛查情况
初筛未通过的1007例新生儿在出生后的42天内完成复筛,其中181例(17.97%,181/1007)未通过复筛,这些新生儿在出生后3~6个月内完成HL确诊检查,78例(0.46%,78/17000)确诊HL,其中单耳轻度24例,中度2例,重度4例,极重度4例,双耳轻度29例,中度2例,重度3例,极重度2例,其余8例左耳和右耳的严重程度不同。78例确诊HL患儿满6个月后进行药物治疗3例,佩戴助听器4例,其余71例进行了包括听力补偿、听觉言语康复、行为康复治疗以及教育等相关项目等干预。
2.2 耳聋基因测序结果
针对GJB2、GJB3、SLC26A4测序共检测出709个突变等位基因,突变情况及等位基因频率见图1。听力初筛未通过的新生儿中有355例(35.25%,355/1007)携带至少一种突变等位基因,237例检出12种“致病的”或“可能致病的”突变位点,其中58例(24.48%,58/237)确诊HL;78例检出新错义突变位点(c.217C>A、c.316T>G、c.676G>T、c.739T>C),其中2例携带GJB2c.217C>A确诊HL,13例听力确诊正常者检出11种非编码区多态突变。GJB2、GJB3、SLC26A4基因的突变携带率分别为1.75%(297/17000)、0.66%(113/17000)、0.36%(61/17000),等位基因频率分别为25.07%(505/2014)、6.51%(131/2014)、3.33%(67/2014)。78例确诊HL的新生儿中,检出GJB2、GJB3、SLC26A4基因突变的占比分别为83.33%(65/78)、12.82%(10/78)、2.56%(2/78),其中检出GJB2基因复合杂合突变9例,纯合突变38例,均为致病突变,单杂合突变12例,为致病或可能致病突变,GJB3基因单杂合突变3例,多基因突变7例,另有9例(11.34%,9/78)未检测到基因突变。检出GJB2基因突变的确诊新生儿,轻度听力损失占68.93%、中度占8.74%、重度占11.65%、极重度占10.68%,检出GJB3基因突变的确诊新生儿,轻度听力损失占58.33%、中度占8.33%、重度占33.33%、无极重度,检出SLC26A4基因突变的两例均为轻度听力损失。

图1 耳聋相关基因突变情况及等位基因频率,“致病的”或“可能致病的”突变显示为红色柱。Fig.1 Deafness-related gene mutation and allele frequency,"pathogenic"or"possibly pathogenic"mutation is shown as red columns.
2.3 突变位点与HL的关系
以确诊HL且突变阳性的新生儿为病例组、未确诊HL且突变阳性的新生儿为对照组。分析本研究检出的耳聋相关基因突变位点与HL之间的关联,选取突变例数达到统计学标准的候选突变位点GJB2:c.109G>A(8.99%)、c.79G>A(4.82%)、c.608T>C(2.53%)、c.341A>G(3.77%),GJB3:c.357C>T(3.92%)进行分析;哈迪-温伯格遗传平衡检验和基因型与表型关联分析结果见表1、2。结果显示除c.109G>A(c2=23.907;P<0.001)外,其他候选位点的等位基因频率在病例组和对照组中均符合HW遗传平衡;除 c.608T>C(Z=1.407;P>0.05)外,其他候选位点的突变基因型与表型的关联具有统计学意义。
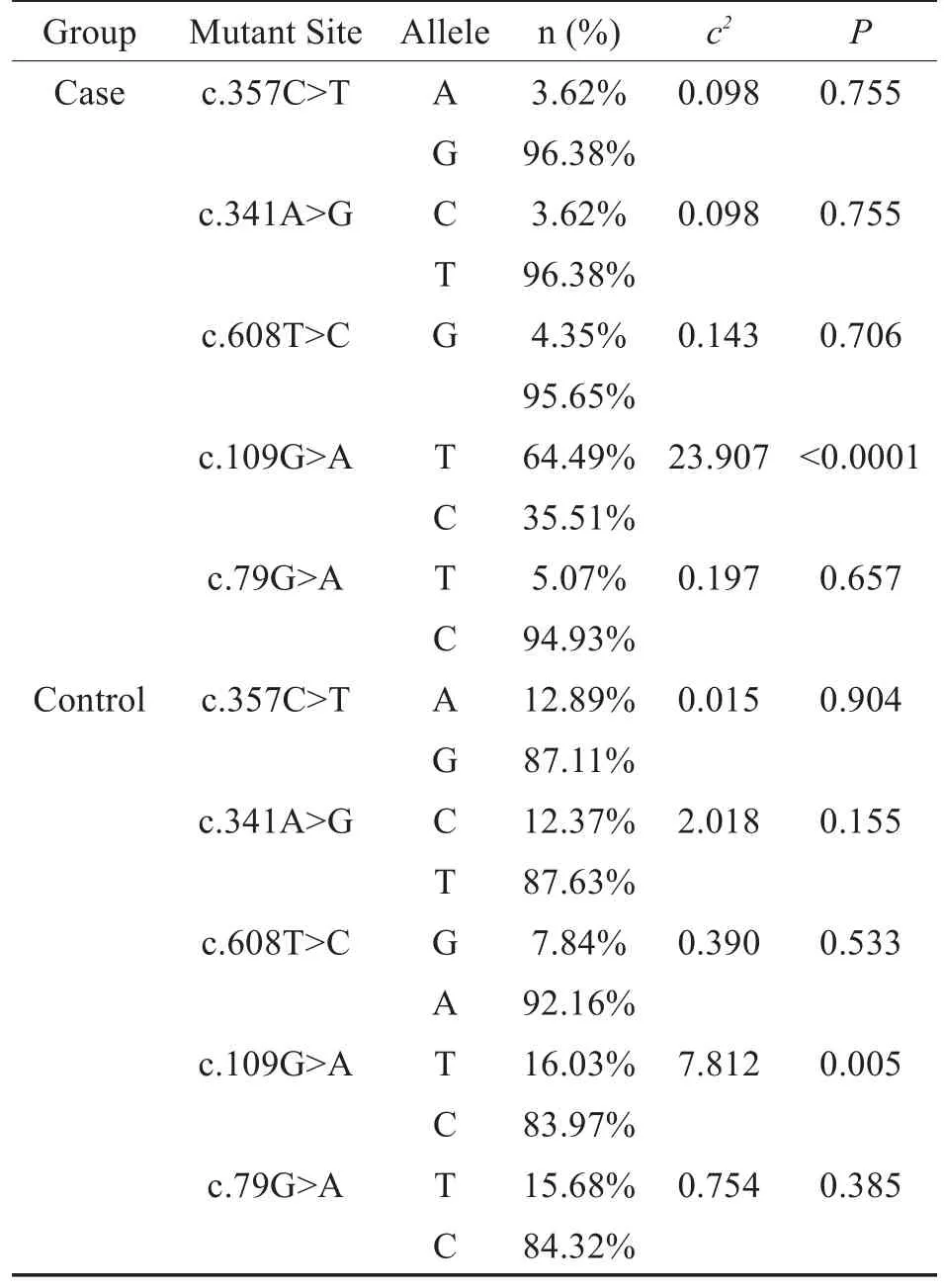
表1 哈迪-温伯格遗传平衡检验结果Table 1 Hardy-Weinberg's equilibrium test result

表2 表型-基因型关联分析结果Table 2 Results of phenotype-genotype association analysis
2.4 蛋白预测结果
结果显示(图2),c.109G>A和c.79G>A对应的氨基酸序列改变分别为GJB2p.Val37Ile、GJB2p.Val27Ile,两个位点都是由缬氨酸(Val)置换为异亮氨酸(Ile),这两个种氨基酸都为非极性,两种预测的突变型蛋白氢键连接、α-螺旋、β-折叠与其野生型相比均没有差异,因为GJB3:c.357C>T属于同义突变,GJB2:c.341A>G属于非外显子突变,故不能生成相应的蛋白质三维结构。

图2 候选突变基因野生型和突变型预测三维蛋白结构对比图,黄色虚线表示氢键,氨基酸残基上蓝色表示氢键受体,红色表示氢键供体;蛋白二级结构α-螺旋、β-折叠、无规卷曲分别以绿色、紫色、粉色着色;Val:缬氨酸、Ile:异亮氨酸。Fig.2 Comparison diagram of three-dimensional protein structure predicted by wild-type and mutant of candidate mutant genes.The yellow dotted line represents the hydrogen bond,the hydrogen bond receptors and donors on amino acid residues were colored as blue and red respectively;α-Helix,β-Sheet,and random coil were colored as green,purple,and pink respectively.Val:valine,Ile:isoleucine.
3 讨论
近年来,许多基因位点的变异被证实与HL有关,截至2021年8月,已报道了约124个耳聋基因,存在约192个突变位点[6],据报道,新生儿中HL的患病率约为1.8/1000,到5岁时,这一比率将达到约2.7/1000[7],因此,HL的早期筛查和干预对于改善患儿语言、沟通和认知发展至关重要。新生儿普遍听力筛查在我国已经实施了20多年,这将确诊HL的平均年龄从24-30个月下降到2-3个月,然而,目前的新生儿普遍听力筛查方案对巨细胞病毒诱导的HL、氨基糖苷类抗生素诱导的HL和迟发性或进行性HL的诊断等存在局限性,因此将耳聋基因的检测介入新生儿普遍听力筛查计划能有效弥补传统听力筛查的局限性。
GJB2、SLC26A4和GJB3基因是我国最常见的热点耳聋基因,占HHL的70%~80%,其中GJB2基因占55%[8]。本研究确定了356例新生儿耳聋易感基因突变情况,由于检测方法和研究对象的差异,突变检出率高于其他研究,其中GJB2基因(占63.19%)的突变携带率(1.75%)最高,c.109G>A等位基因频率(8.987%)最高,其结果病例组不符合H-W遗传平衡是由于突变频率在病例组中比较高,GJB3、SLC26A4基因突变携带率较低,但略高于本地其他研究[9-10]。与我国南方其他地区相比,本研究GJB2和SLC26A4的基因突变携带率均低于成都市(2.20%、1.27%)、东莞市(4.16%、5.22%)、深圳市(1.98%),GJB3基因突变携带率与这三个地区的差异不大[11-13]。值得注意的是,355例耳聋基因阳性新生儿中有40.28%(143/355)的壮族人,有研究报道广西地区汉族GJB2、GJB3和SLC26A4的突变携带率均高于壮族[14],这或许是本研究突变携带率较低的原因,另外,本研究有51例(65.38%,51/78)确诊HL者携带c.109G>A,其中32例为壮族新生儿,由于壮族样本量少,尚不能确定壮族成分对研究结果的影响。
GJB2基因的变异会影响间隙连接蛋白-26的表达,目前推测缝隙连接蛋白-26的缺失可能损害K+离子的循环,高浓度K+抑制谷氨酸的摄取,最终导致毛细胞凋亡[15]。GJB2c.109G>A是否致聋存在争议,孙菲菲[16]在耳聋患者家系中明确c.109G>A会引起轻度的听力损伤,刘清明等[17]发现携带c.109G>A伴c.235delC的复合杂合突变者在3年的听力密切随访未通过,而c.109G>A纯合突变者均通过。针对蛋白预测结果与本研究统计结果不符的情况,我们认为原因如下,在线服务器根据人工智能从现有数据库中寻找相似度最高的蛋白结构为模板拟合出的三维模型,并不能完全反映出蛋白表达的实际情况,c.109G>A和c.79G>A突变的确诊HL新生儿中有13.06%的新生儿为GJB2复合杂合突变,甚至有7.25%为多基因突变,可能由多基因、多位点的复杂突变导致的HL,仅用单个位点的突变预测出的蛋白模型难以验证与表型的关联。
本研究的不足:1)作为针对新生儿的随机筛查研究,我们的病例组样本不够大,还应增加样本量,另外,应该对所有进行听力初筛的新生儿进行耳聋基因测序。2)我们仅对3个耳聋相关基因进行测序,这些基因的覆盖范围很小,故存在一定程度的漏诊,突变阴性的患者是否携带其他致病突变仍然未知,后续的研究需尽量采用全外显子组测序以鉴定其他罕见的耳聋基因。3)我们无法收集到新生儿父母及其他亲属的样本,故不能构建核心家系,从遗传的角度进行研究分析。
综上所述,本研究发现GJB2c.109G>A是广西南宁市新生儿携带率最高的耳聋基因突变。独立进行听力筛查和耳聋基因测序筛查存在一定的缺陷,结合两种筛查方法是临床早期干预NSHL的有效策略。目前的结果对广西地区耳聋基因筛选方案的建立应该是有价值的。

