基于物种特异性PCR技术检测鼻疽诺卡菌和巴西诺卡菌的初步研究
李 芳,隗 明,徐 帅,岳 苑,邱小彤,韩李超,陈胜林,刘雪萍,任明辉,李振军,
诺卡菌是腐生需氧型革兰阳性丝状细菌,属于放线菌纲、放线菌目、诺卡菌科、诺卡菌属,广泛存在于山川、湖泊及腐烂植被中[1-2]。该菌主要感染免疫功能低下或伴有合并症患者,引起肺诺卡菌病、皮肤诺卡菌病、心内膜炎、小肠诺卡菌病等,严重时可造成神经系统感染,危及人和动物的生命[3-4]。其中,鼻疽诺卡菌、巴西诺卡菌为临床常见致病菌[5-7]。
传统诺卡菌的鉴定方法为生化试验,准确率较低,且耗时长[5];诺卡菌病由于没有特征性症状,常被临床忽视,等待报告时间段多为经验性用药,易延误患者的病情[8]。近年来,随着分子生物学技术的发展,建立了以16SrRNA、hsp65、gyrB、rpoB、secA1、16S rRNA-23S rRNA基因间隔区(ITS)为靶基因的PCR方法检测诺卡菌,然而这些基因位点存在于所有诺卡菌物种中且过于保守,需要通过进一步测序才能达到对诺卡菌物种的准确鉴别[9-11]。
为了更加高效、准确地鉴定常见诺卡菌,本研究基于本课题组前期筛选的鼻疽诺卡菌和巴西诺卡菌特异性基因(数据未发表),设计特异性引物,旨在建立一种能同时鉴别两种临床常见诺卡菌的快速、经济、精确的SS-PCR检测方法,将诺卡菌的检测提高到种水平,对诺卡菌的临床诊断具有重要应用价值。
1 材料与方法
1.1 实验材料
1.1.1 主要仪器 PCR仪(德国Senso公司),CO2培养箱(美国Thermo Fisher公司),电泳仪(中国百晶生物技术有限公司),凝胶成像分析仪(日本GE公司),核酸浓度检测仪(美国Thermo Fisher公司)。
1.1.2 试剂 脑心浸液培养基(英国Oxoid公司),金牌Mix(中国全式金生物技术有限公司),DNA marker(日本TaKaRa公司),GoldView (中国艾德莱生物科技有限公司),Wizard基因组DNA纯化试剂盒(美国Promega生物技术有限公司)。
1.1.3 菌株来源 本实验所用菌株共计150株,其中13株鼻疽诺卡菌标准菌株和3株巴西诺卡菌标准菌株来源于德国菌种保藏中心;82株鼻疽诺卡菌临床分离株(北京市17株、江苏省7株、陕西省9株、甘肃省27株、四川省4株、广东省8株、宁夏省4株、未知来源6株)和10株巴西诺卡菌临床分离株(浙江省2株、四川省1株、湖南省1株、北京市2株、山东省1株、未知来源3株); 7株盖尔森基兴诺卡菌、2株星形诺卡菌、3株豚鼠诺卡菌、2株脓肿诺卡菌、3株新星诺卡菌、2株亚洲诺卡菌、2株老兵诺卡菌、2株肉色诺卡菌、4株链霉菌、1株红球菌、6株分枝杆菌、1株束村氏菌、1株戈登氏菌、2株糖多孢菌、4株棒状杆菌均由中国疾病预防控制中心传染病所提供。
1.2 方法
1.2.1 引物设计基于鼻疽诺卡菌和巴西诺卡菌特异性基因序列,通过CmSuite软件(v8.0)和BLAST软件(https://blast.ncbi.nlm.nih.gov/Blast.cgi)共设计16对引物。引物由北京生工生物工程(上海)股份有限公司合成,本研究采用的两对引物,见表1。

表1 诺卡菌靶基因及引物信息Tab.1 Pathogen target gene and primer information
1.2.2 DNA提取 将细菌接种于BHI液体培养基中,待生长至对数生长期,取菌液200 μL接种于20 mL BHI液体培养基中,37 ℃摇菌18 h,4 000 r/min离心10 min弃上清,按照Wizard基因组DNA纯化试剂盒提取模板,置4 ℃备用。
1.2.3 质粒制备 鼻疽诺卡菌特异性靶基因为NFA_41530,巴西诺卡菌特异性靶基因为O3I_RS18895,扩增片段交由上海生工公司制备质粒pESI-NFA_41530和pESI-O3I_RS18895。每个碱基的平均分子量为660,pESI-T质粒含1 865个碱基,单质粒分子量为660×(目的基因片段碱基数+1 865),每微升拷贝数=(质粒浓度/单质粒分子量)×10-9×阿伏伽德罗常数。
1.2.4 SS-PCR条件优化 以标准菌株巴西诺卡菌DSM 43758、鼻疽诺卡菌IFM 10152的DNA为模板,扩增体系为25 μL,其中引物0.1~1 μL(10 μmol/L)设10个梯度,模板1 μL,用金牌Mix补齐至25 μL。扩增条件为:95 ℃预变性5 min;95 ℃变性30 s,退火温度设58 ℃、60 ℃、62 ℃、64 ℃、66 ℃、68 ℃,6个梯度30 s,72 ℃延伸40 s,30个循环;终末延伸5 min。最后取4 μL PCR产物经1.5%的琼脂糖180 V 15 min进行电泳,使用成像仪观察目的条带大小,并记录结果。
1.2.5 SS-PCR特异性的评价 使用108株目标菌株和42株非目标菌株进行特异性检测。以巴西诺卡菌DSM 43758和鼻疽诺卡菌IFM 10152作为阳性对照,无核酶水作为阴性对照。
1.2.6 SS-PCR灵敏度的评价 将鼻疽诺卡菌质粒标准品、巴西诺卡菌质粒标准品分别按10倍梯度进行逐级稀释成108~103copies/μL。然后通过SS-PCR方法分别对鼻疽诺卡菌和巴西诺卡菌的质粒进行扩增,每个浓度设3个平行样本,实验均为阳性结果则判定为阳性。同时将标准菌株巴西诺卡菌DSM 43758、鼻疽诺卡菌IFM 10152的菌液按照108~101cfu/mL浓度梯度稀释,提取DNA,每个稀释度取3 μL作为模板。
1.2.7 模拟痰样本的检测 先用PBS调菌悬液至OD值为1,再对20份健康人痰液样本进行依次编号,将每份痰样本分为两组。一组为试验组:每份模拟痰样本总体积为1 mL,其中1-5号样本中加入100 μL鼻疽诺卡菌悬液,6-10号样本中加入100 μL巴西诺卡菌悬液,11-20号样本中加入鼻疽诺卡菌和巴西诺卡菌悬液各100 μL,用痰液样本补齐至1 mL。另外一组做平行对照:加入相对应体积的PBS于痰液样本,使得每份阴性对照样本总体积为1 mL。混匀,提取核酸。采用SS-PCR方法判断痰样本中检测符合率。
2 结 果
2.1 SS-PCR引物的确定 通过筛选最终选择种特异性引物farToT_F/R和braToT_F/R,最后将PCR产物送到上海生工测序,所得到的序列进行BLAST比对,结果表明扩增产物与目标菌株序列一致。
2.2 SS-PCR扩增条件的优化 经多次调整,最终确定反应条件为:95 ℃预变性5 min;95 ℃变性30 s,退火温度68 ℃ 30 s,72 ℃延伸40 s,30个循环;终末延伸5min。反应体系为25 μL,其中farToT_F/R为0.2 μL(10 μmol/L),braToT_F/R为0.5 μL(10 μmol/L);模板为1 μL;金牌Mix补齐25 μL。分别以巴西诺卡菌DSM 43758、鼻疽诺卡菌IFM 10152为模板进行单一PCR扩增时,结果显示巴西诺卡菌和鼻疽诺卡菌扩增为单一且清晰的目的条带;其次将二者同时加入该反应体系中,结果均能够扩增出鼻疽诺卡菌和巴西诺卡菌的目的片段(图1)。表明SS-PCR可以同时扩增出巴西诺卡菌和鼻疽诺卡菌,且两者间无交叉反应。
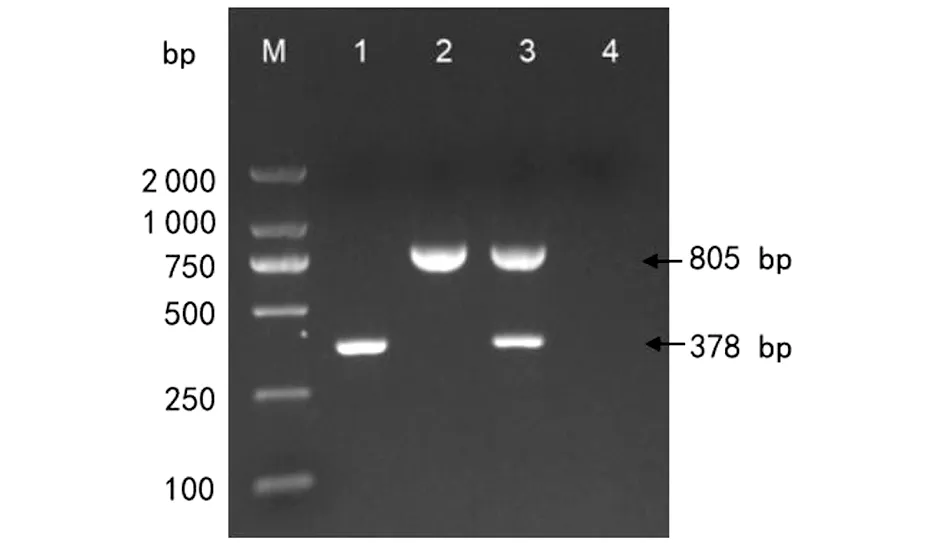
注:M.DNA Marker DL2000;1. O3I_RS18895 gene;2. NFA_41530 gene;3. NFA_41530 gene and O3I_RS18895 gene;4.Negative control。图1 NFA_41530基因和O3I_RS18895基因的PCR扩增 Fig.1 PCR amplification of NFA_41530 and O3I_RS18895 genes
2.3 SS-PCR特异性评价 分别采用鼻疽诺卡菌、巴西诺卡菌和非目标菌株引物扩增,结果显示鼻疽诺卡菌和巴西诺卡菌分别呈现清晰且单一的目的条带(805 bp左右和378 bp左右),非目标菌株无扩增条带,重复3次,结果均一致。表明本试验种特异性引物farToT_F/R和braToT_F/R具有很好的特异性及稳定性(图2)。

注:M.DNA Marker DL2000;1-22.鼻疽诺卡菌,目的片段805 bp左右;23-32.巴西诺卡菌,目的片段378 bp左右;33-47.红球菌、链霉菌、分枝杆菌、戈登氏菌、糖多孢菌、束村氏菌、亚洲诺卡菌、盖尔森基兴诺卡菌、星形诺卡菌、肉色诺卡菌、新星诺卡菌、豚鼠诺卡菌、脓肿诺卡菌、纹带棒状杆菌、老兵诺卡菌;48.阴性对照。图2 SS-PCR特异性检测Fig.2 SS-PCR for species-specific detection
2.4 SS-PCR灵敏度评价 巴西诺卡菌质粒浓度为58.2 ng/μL;鼻疽诺卡菌质粒浓度为37.4 ng/μL。计算得到NFA_41530质粒、O3I_RS18895质粒的拷贝数分别为1.3×109copies/μL、2.4×109copies/μL。将鼻疽诺卡菌、巴西诺卡菌的质粒标准品进行倍比稀释,在稀释至104copies/μL后仍能扩增出目标条带,灵敏度分别为1.3×104copies/μL、2.4×104copies/μL;此外,扩增体系检测灵敏度为103cfu/mL。表明该方法具有较高的灵敏度(图3、图4)。

注:M.DNA Marker DL2000;1-6.鼻疽诺卡菌基因1.3×108至1.3×103 copies/μL DNA,蓝色圈出1.3×104 copies/μL,大小为805 bp;7.阴性对照。图3 鼻疽诺卡菌灵敏度检测Fig.3 Sensitivity verification for Nocardia farcinica

注:M.DNA Marker DL2000;1-6.巴西诺卡菌基因2.4×108至2.4×103 copies/μL DNA,蓝色圈出2.4×104 copies/μL,大小为378 bp;7.阴性对照。图4 巴西诺卡菌灵敏度检测Fig.4 Sensitivity verification for Nocardia brasiliensis
2.5 SS-PCR对模拟痰标本的鉴定结果 结果显示试验组1-5号样本呈现单一目的条带,大小为805 bp;试验组6-10号样本呈现单一目的条带,大小为378 bp;试验组11-20号样本分别在805 bp和378 bp处呈现目的条带;对照组均无出现扩增条带。表明SS-PCR在20份痰样本中检测符合率为100%,该方法在痰样本中具有良好的灵敏度(图5)。

注:M.DNA Marker DL2000;1-5.模拟鼻疽诺卡菌阳性痰标本,目的片段805 bp;6-10.模拟巴西诺卡菌阳性痰标本,目的片段378 bp;11-20.模拟鼻疽诺卡菌和巴西诺卡菌混合痰标本;21.阳性对照;22.阴性对照;23-42.健康人痰标本阴性对照。图5 SS-PCR痰模拟样本检测Fig.5 SS-PCR sputum simulation sample detection
3 讨 论
近年来,国内外关于鼻疽诺卡菌和巴西诺卡菌病例的报道逐渐增多,由诺卡菌引起脑脓肿的发生率也在逐年增高[12-14]。目前,诺卡菌的鉴定方法主要为16SrRNA基因鉴定,然而该方法依赖于测序,鉴定时间较长,早期诊断价值较低[9]。近年来,核酸扩增技术的检测越来越多地用于细菌检测[15-17],但很少有研究报道使用特异性基因全长作为扩增目的片段。由于巢氏PCR技术需要使用第1次扩增产物作为第2次扩增的模板,导致操作复杂;而实时荧光PCR依赖实时收集荧光信号的仪器,设备昂贵。因此,高效且精准鉴定鼻疽诺卡菌和巴西诺卡菌的方法亟待解决。
本研究首次利用鼻疽诺卡菌和巴西诺卡菌的NFA_41530、O3I_RS18895基因全长设计特异性引物建立SS-PCR方法,该技术可在2 h内精确鉴定到种水平。并且具有灵敏度高和特异性强的优点,可以对分类学上易混淆的物种进行区分。与以往孙渭歌等[18]报道的PCR方法相比,后者采用多重PCR方法,同时检测诺卡菌的rpoB、secA1、16SrRNA基因(扩增体系检测灵敏度为104cfu/mL),SS-PCR采用特异性基因的灵敏度更高,可达103cfu/mL。
本研究使用的双重SS-PCR技术引物长度大于20 bp,引物之间的潜在相互作用容易形成二级结构;此外,诺卡菌的基因组GC含量较高,长串聚嘌呤或聚嘧啶加大了引物设计的难度[5]。本研究共设计16对引物通过不断优化筛选出最优引物组合,为了兼顾同一体系中鼻疽诺卡菌和巴西诺卡菌的灵敏度和特异性,我们筛选出最优的引物浓度分别为0.2 (10 μmol/L)、0.5 (10 μmol/L),体系中引物的含量的差异可能是两对引物扩增效率的不同。
本研究也存在一定局限性。鉴于临床分离的菌株种类较单一,收集的巴西诺卡菌临床菌株数量较少;此外,由于诺卡菌在临床诊断中易被忽视,增加了收集样本的难度,因此本研究只能采用模拟痰样本预估实用性。
综上所述,本研究建立的SS-PCR方法能快速检出鼻疽诺卡菌和巴西诺卡菌,快速、灵敏、特异的SS-PCR方法不仅为我们提供了一个有价值的检测工具,而且也为基层地区的防控提供了技术支持,对诺卡菌的临床诊断具有重要的潜在应用价值。
利益冲突:无

