侵染三七的三七Y病毒和中国番茄黄化曲叶病毒PCR同步检测技术
柳勤海,杨 馨#,李晓静,兰平秀,李 凡,谭冠林
• 药材与资源 •
侵染三七的三七Y病毒和中国番茄黄化曲叶病毒PCR同步检测技术
柳勤海1,杨 馨1#,李晓静1,兰平秀1,李 凡1*,谭冠林2*
1. 云南农业大学植物保护学院,云南 昆明 650201 2. 云南农业大学 现代教育技术中心,云南 昆明 650201
建立一种高效、快速、准确地同步检测侵染三七的2种病毒——三七Y病毒(virus Y,PnVY)和中国番茄黄化曲叶病毒(tomato yellow leaf curl China virus,TYLCCNV)的双重PCR技术。分别以单一感染PnVY或TYLCCNV及复合侵染了这2种病毒的染病三七植株为样品,CTAB法提取叶片总核酸作为模板,根据GenBank上已登录的PnVY和TYLCCNV这2种病毒核酸序列设计特异性检测引物。通过单一PCR技术明确染病三七样品PnVY和TYLCCNV的发生情况,筛选出可用于一步法双重PCR检测PnVY和TYLCCNV的引物组合及引物浓度,并对反应条件进行优化。对扩增产物进行克隆测序,验证一步法双重PCR检测的准确性和特异性。建立的一步法双重PCR检测技术能同步有效地检测三七病样中的PnVY和TYLCCNV,检测灵敏度高,最低检测限点为核酸原液的0.01稀释倍数,特异性强。所建立的一步法双重PCR检测技术可以高效、快速、准确、特异地同步检测三七样品中的PnVY、TYLCCNV 2种病毒。
三七;病毒检测;三七Y病毒;中国番茄黄化曲叶病毒;双重PCR技术
三七(Burk.) F. H. Chen是与人参C. A. Mey.、西洋参L.同属于五加科(Araliaceae)人参属L.的多年生药用植物,在我国已有400多年的栽培历史,是一种名贵中药材,其主要成分有三七总皂苷、黄酮、三七素、挥发油、糖类、氨基酸及微量元素等[1],对治疗中枢神经系统、心血管系统、消化系统、泌尿生殖系统等疾病具有显著而独特的疗效,药用和医疗保健价值高[2]。因三七的种植对气候要求较高,长期以来我国三七的主要产区为云南文山。近年来,由于三七需求量的扩大,以及受三七连作障碍的影响,三七的栽培范围逐渐扩大,在云南的红河、玉溪、昆明、曲靖,以及广西等地都有一定规模的种植。随着三七种植面积的不断扩大和种植年限的增加,三七病毒病的发生也日益严重[3]。云南主要三七种植区的病毒病发病率逐年增加,对生产构成严重威胁。1999年文山地区爆发的三七病毒病,导致当地多数三七园发病率高达60%[4],严重影响三七的产量与品质,造成严重的经济损失。
目前,侵染三七的病毒及卫星病毒主要有8种,分别为马铃薯Y病毒属的三七Y病毒(Y,PnVY)[5],菜豆金色花叶病毒属的中国番茄黄化曲叶病毒(tomato yellow leaf curl China virus,TYLCCNV)及其伴随的β卫星分子(tomato yellow leaf curl China betasatellite)[6],烟草花叶病毒属的番茄花叶病毒(tomato mosaic virus)[7],黄瓜花叶病毒属的黄瓜花叶病毒(cucumber mosaic virus)[8],正番茄斑萎病毒属的番茄斑萎病毒(tomato spotted wilt orthotospovirus)[9],全病毒属的三七A病毒(A)[10],以及马铃薯卷叶病毒属的烟草扭脉病毒(Tobacco vein distorting virus)[11]。在对云南省主要三七种植区的调查发现,PnVY和TYLCCNV的检出率最高,二者在田间大多以复合侵染形式出现[12]。
三七病毒病病原鉴定的方法主要有常规生物学技术、血清学技术、电镜技术和分子生物学技术[13]。常规生物学检测主要包括寄主范围测定、传播途径测定、鉴别寄主反应等,需要耗费大量时间,还受到季节、环境等限制,而三七的生长对气候要求较高,种植难度较大。电镜技术常被运用到植物病毒的鉴定中,但对制备病毒样品材料要求较高且设备昂贵,限制了电镜技术的广泛应用。血清学技术对病毒的检测准确度较高,但操作较复杂,还需制备相应的抗体,耗时长,成本高。常规PCR检测方法灵敏度高,整个检测过程所需时间短,但常规PCR技术每次只能检测一种病毒,对于多种病毒复合侵染的检测需要重复操作,整体耗时长,成本高。多重PCR技术通过在一次扩增反应中加入多对病毒的特异性检测引物,实现了多种病毒的同时检测,在保证检测结果准确性的前提下,节约了检测时间,减少了试剂耗材的损耗,极大地节约了检测成本。因此,目前多重PCR检测技术在作物多种病毒的同步检测中应用广泛,董代幸等[14]建立了能够同时检测马铃薯X病毒(potato virus X,PVX)、马铃薯Y病毒(potato virus Y,PVY)、马铃薯A病毒(potato virus A,PVA)、马铃薯卷叶病毒(potato leafroll virus,PLRV)的一步法多重RT-PCR检测技术;曾静等[15]建立了烟草花叶病毒(tobacco mosaic virus,TMV)、CMV、PVY和PVX4种病毒的多重RT-PCR检测技术;薛杨等[16]建立了葡萄2种检疫性病毒番茄环斑病毒(tomato ringspot virus,ToRSV)和烟草环斑病毒(tobacco ringspot virus,TRSV)的多重RT-PCR检测技术,这些技术实现了对多种病毒的快速同步检测。
三七作为一种名贵中药材,在云南、广西等地种植规模较大,病毒病的发生严重影响了三七的产量与品质。目前,侵染三七的病毒种类较多,且DNA病毒和RNA病毒都有报道,病毒复合侵染的现象普遍。三七病毒病的病原鉴定目前多采用常规PCR技术,尚未见三七病毒多重PCR检测的相关报道。课题组前期调查了云南主要三七种植区病毒病的发生情况,发现三七病毒病的病原中PnVY为优势病毒,在各种植区均有发生。三七病毒病的发生率随着种植年限的增加相应的增高,且复合侵染现象较为普遍,其中PnVY+TYLCCNV 2种病毒复合侵染现象最为普遍,在文山市、昆明市、红河州、曲靖市的平均检出率超过20%,在一些种植区PnVY+TYLCCNV的复合侵染检出率甚至高达50%[11]。为此,本研究建立了PnVY(RNA病毒)和TYLCCNV(DNA病毒)的同步检测技术,实现了对PnVY和TYLCCNV这2种核酸性质完全不一样的病毒的同步检测。该技术的建立与应用为三七生产中监测PnVY和TYLCCNV的发生提供了技术支撑,也将为其他构建同步检测DNA病毒和RNA病毒技术体系提供参考。
1 材料
1.1 三七病毒病样品
采自云南昆明、文山、玉溪等地单独感染PnVY、单独感染TYLCCNV以及复合感染PnVY、TYLCCNV的田间染病三七(Burk.) F. H. Chen叶片样品,保存于实验室−80 ℃超低温冰箱。
1.2 试剂
十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB,分析纯)购自生工生物工程(上海)股份有限公司;反转录试剂Reverse Transcriptase M-MLV(RNase H−)、一步法RT-PCR试剂盒PrimeScript®(One Step RT-PCR Kit Ver.2)、克隆载体pMD19-T Vector等购自宝生物工程(大连)有限公司;DNA纯化回收试剂盒购自生工生物工程(上海)股份有限公司;大肠杆菌DH5α菌株为本实验室保存。
2 方法
2.1 引物设计
根据GenBank中PnVY(GQ916624)和TYLCCNV(KJ477327)的基因组全序列,选取保守区域每一种病毒各设计3对特异性检测引物,尽量使2种病毒的引物退火温度相近。以单独侵染PnVY或TYLCCNV的三七样品总核酸为模板对引物进行常规PCR验证,选取可高效、特异检测PnVY和TYLCCNV的引物各1对,经过反复实验筛选出PnVYdF4/PnVYcRa2T、YLCCNVF1/TYLCCNVR1用于双重PCR检测技术体系的构建和优化。引物由深圳华大基因科技公司合成,引物序列见表1。

表1 PnVY和TYLCCNV双重PCR检测引物序列
2.2 总核酸提取
采用CTAB法[17]提取染病三七植株叶片总核酸,提取的总核酸保存于−20 ℃冰箱。
2.3 一步法双重PCR检测体系初步建立
利用田间采集到并经过常规PCR/RT-PCR技术检测,确定同时感染了PnVY、TYLCCNV的样品作为核酸模板。由于PnVY为RNA病毒,进行PCR扩增前需要先将病毒的RNA反转录成cDNA,而TYLCCNV为DNA病毒,其核酸模板可以直接进行PCR扩增。为了减少操作步骤和缩短检测时间,且兼顾PnVY为RNA病毒的特性,本双重PCR检测技术采用一步法RT-PCR,反应进行时将所有检测引物、试剂、核酸模板等一次性全部加入,一步完成。根据PrimeScript®One Step RT-PCR Kit Ver.2试剂盒说明书设计一步法多重检测的反应体系:5.0 µL 2×1 step Buffer,2.8 µL RNase Free water,0.4 µL PrimeScript®One Step Enzyme Mix,10 µmol/L的PnVY、TYLCCNV上、下游引物各0.2 µL,RNA模板1.0 µL,共10 µL。反应条件:50 ℃反转录30 min;94 ℃、2 min,然后94 ℃、30 s,55 ℃、30 s,72 ℃、1 min,共进行35个循环,72 ℃、10 min,4 ℃冷却保存。
2.4 一步法双重PCR检测体系的优化
初步建立的PnVY、TYLCCNV一步法双重PCR检测体系虽可以实现对2种病毒的同步检测,但检测效果不稳定,为此,进一步对该检测体系进行优化,主要对反应体系中引物的浓度(体积)进行了调整优化,设置4组引物浓度梯度组合(表2)用于复合感染PnVY、TYLCCNV三七样品的扩增,以此获得最佳引物浓度组合。
引物原始浓度均为10 µmol/L
The original concentration of primers was 10 µmol/L
2.5 一步法双重PCR检测体系的特异性分析
根据优化的一步法双重PCR检测体系,选取部分经常规PCR验证的田间复合感染PnVY、TYLCCNV的三七样品进行检测。扩增反应结束后取7.5 µL PCR产物用1.2%琼脂糖凝胶于0.5×TBE缓冲液中100 V电压下电泳45 min,观察结果。利用生工生物工程(上海)股份有限公司的SanPerp柱式DNA胶回收试剂盒,将目标扩增条带进行割胶回收,然后将割胶回收产物与pMD 19-T Vector连接进行克隆,经PCR验证后,每个扩增片段选3个阳性克隆送深圳华大基因科技有限公司进行测序,所获序列在NCBI的BLAST上进行比对分析。
2.6 一步法双重PCR检测体系的灵敏度分析
选取经常规PCR验证的田间复合侵染了PnVY和TYLCCNV的三七样品总核酸作为模板,样品总核酸质量浓度为1.0~1.3 µg/µL,进行模板核酸10倍梯度稀释,稀释倍数为1~1×10−4倍,在经过优化后的一步法双重PCR反应体系下进行扩增反应。反应结束后根据琼脂糖凝胶电泳检测结果,分析其检测灵敏度。
2.7 一步法双重PCR检测体系对田间三七样品检测
运用优化的PnVY、TYLCCNV一步法双重PCR检测技术,对采自田间的109个三七病毒病样品进行PnVY、TYLCCNV检测,任意选取其中的3个同时扩增出2条目标条带的样品,对其PCR扩增产物进行纯化,经连接、克隆后测序验证,进一步验证一步法双重PCR检测技术的准确性和实用性。
3 结果与分析
3.1 一步法双重PCR检测体系的建立
根据GenBank中登录的PnVY、TYLCCNV基因组全序列设计并筛选出可用于一步法双重检测PnVY、TYLCCNV的特异性检测引物,根据PrimeScript®One Step RT-PCR Kit Ver.2试剂盒说明书设计一步法多重检测的初始体系,利用该体系对复合侵染PnVY、TYLCCNV的三七样品进行检测时,存在部分样品只能扩增出1种病毒对应的目标条带或其中1条目标条带较弱、非特异性条带较多等现象。针对这些情况,对该一步法双重检测反应体系进行优化,主要对反应体系中特异检测引物的浓度进行调整优化,当引物体积为:PnVYdF4/PnVYcRa2(10 µmol/L)各0.35 µL,TYLCCNVF1/TYLCCNVR1(10 µmol/L)各0.25 µL时,经琼脂糖凝胶电泳检测扩增结果显示该体系能同时且稳定地扩增出与预期大小一致的2条特异性条带,大小分别为650 bp(TYLCCNV)、1032 bp(PnVY,图1)。最终确定的一步法双重PCR反应体系为:5.0 µL 2×1 step Buffer,2.4 µL RNase Free water,0.4 µL PrimeScript®One Step Enzyme Mix,引物浓度为:PnVYdF4/PnVYcRa2(10 µmol/L)各0.35 µL,TYLCCNVF1/TYLCCNVR1(10 µmol/L)各0.25 µL,RNA模板1.0 µL。反应条件:50 ℃反转录30 min;94 ℃、2 min然后94 ℃、30 s,55 ℃、30 s,72 ℃、1 min共进行35个循环,72 ℃、10 min,4 ℃冷却保存。
3.2 一步法双重PCR检测技术的特异性
以确定复合侵染PnVY、TYLCCNV的三七样品、田间健康的三七样品核酸作为模板,利用优化后的检测体系对上述样品进行检测。结果显示,在复合侵染的三七样品中能扩增出与预期大小一致的目标条带,且条带单一;健康的三七样品未扩增到目标条带(图2)。对获得的1032 bp(PnVY)、650 bp(TYLCCNV)扩增产物分别进行割胶纯化、克隆测序,经NCBI序列比对,1032 bp的扩增片段与GenBank中登录的PnVY核苷酸序列一致性最高,达97%。650 bp的扩增产物与GenBank中登录的TYLCCNV核苷酸序列一致性最高,达94%,表明所建立的一步法双重PCR技术从染病的三七叶片中得到的1032、650 bp条带是PnVY、TYLCCNV相应的扩增产物,所建立的一步法双重检测技术体系的扩增产物真实可信,证明该体系对PnVY、TYLCCNV具有良好的检测特异性,能够对同时感染PnVY和TYLCCNV的三七样品开展快速检测。
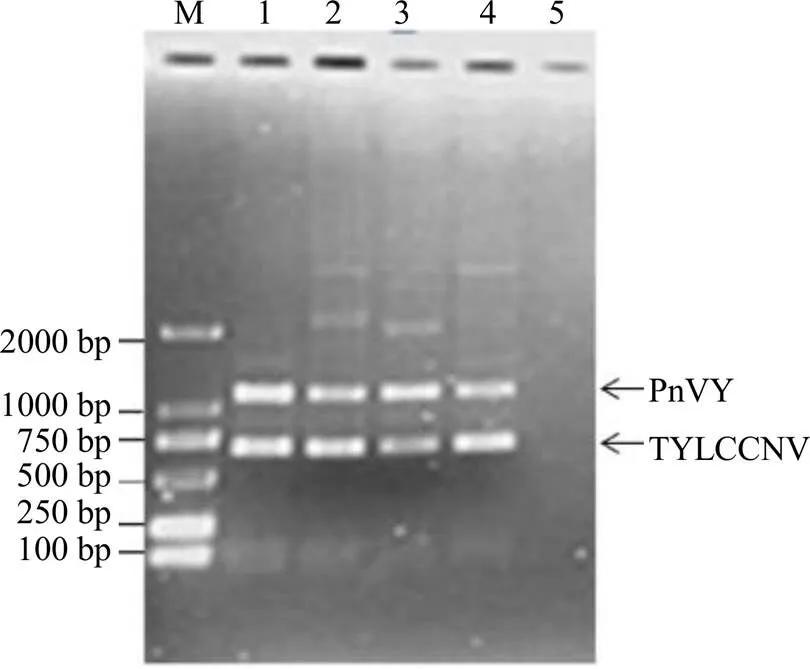
M-Marker 1~4-复合感染PnVY和TYLCCNV的三七样品 5-健康三七样品
3.3 一步法双重PCR检测体系的灵敏度分析
对经验证田间复合感染了PnVY、TYLCCNV的三七样品模板核酸进行10倍梯度稀释,稀释倍数为1~1×10−4倍,共5个浓度梯度。将上述5个不同浓度梯度的核酸作为模板,利用优化后的一步法双重PCR检测体系同时进行扩增反应。结果显示,核酸浓度为1、0.1倍时,2种病毒的扩增目标条带较清晰,易于辨识;当核酸浓度为0.01倍时,PnVY、TYLCCNV 2种病毒依然能检测到,但目标条带相对较弱(图3)。当核酸浓度为1×10−3倍时,依然可以检测到PnVY,但TYLCCNV的扩增条带很弱;核酸浓度为1×10−4倍时,均无法检测到PnVY和TYLCCNV。因此,所建立的一步法双重PCR检测体系对三七样品中PnVY和TYLCCNV的有效检测最低模板核酸稀释度为0.01倍。
3.4 一步法双重PCR检测体系对田间三七样品的检测结果
对采自云南文山、昆明、红河地区三七种植园的109个疑似病毒病样品进行PnVY、TYLCCNV 检测。结果显示,利用优化后的一步法双重PCR检测技术能够快速、高效、准确地对疑似三七病毒病样品中的PnVY、TYLCCNV进行检测鉴定。从2种病毒的检测结果可看出,当前云南主要三七种植区田间PnVY和TYLCCNV复合侵染的现象依然比较普遍,复合侵染率在28.6%~36.2%,其中文山地区2种病毒的复合侵染率最高,为36.2%,昆明的最低,但复合侵染率也在28%以上(表3)。另外,从整体来讲,2种病毒中,PnVY的检出率最高,不同地区三七的PnVY侵染率都在60%以上,其中红河地区的检出率最高,达79.4%;TYLCCNV的平均检出率为49.3%,其中文山地区的检出率最高,为57.4%。

M-Marker 1~5-依次为稀释1、0.1、0.01、1×10−3、1×10−4的三七样品核酸稀释液

表3 不同地区三七样品上PnVY和TYLCCNV的检测情况
4 讨论
三七是我国名贵的中药材,具有较高的药用保健价值,近年来,随着其在社会上的认可度提高,三七的需求量呈上升趋势[18]。三七的生长年限较长,在生长过程中易受到病毒的侵染,且由于介体昆虫的传播,病毒病极容易大范围常年发生,严重影响三七的产量与品质。据本课题组多年来对云南文山、昆明、红河、曲靖等地的三七病毒病调查及相关病毒检测结果,发现病毒病在云南三七种植区普遍发生,年平均发病率均在5%以上,且种植年限越长发病率越高,病毒病已成为三七上仅次于根腐病的主要病害[11]。三七病毒病的症状表现有多种类型,主要有皱缩、褪绿、缺刻、白化、黄化、卷叶、坏死等,同一植株上往往表现出多种症状类型。目前已在三七上发现ToMV[7]、CMV[8]、TYLCCNV和TYLCCNB[6]、PnVY[5,19]以及TVDV[11]等多种病毒,其中,PnVY已成为侵染云南三七病毒病的主要致病病毒[11],而TYLCCNV在田间三七病毒病样品中检出率也较高,而且2者存在复合侵染现象。为了能够对田间三七样品及病毒的传毒媒介昆虫进行高效、快速和准确的病毒检测,为病害发生的准确预测预报提供技术支撑,有必要建立能同时对田间发生和危害较为普遍的PnVY和TYLCCNV开展快速、灵敏及准确检测的技术体系。
目前报道的植物病毒多重PCR/RT-PCR检测技术,所检测病毒的核酸性质大多是一致的,DNA病毒与RNA病毒混合侵染植株的多重PCR/RT-PCR检测技术报道较少,唐瑶等[20]建立了同步检测甘蔗上3种RNA病毒——高粱花叶病毒(sorghum mosaic virus,SrMV)、甘蔗花叶病毒(sugarcane mosaic virus,SCMV)、甘蔗黄叶病毒(sugarcane yellow leaf virus,SCYLV)以及1种DNA病毒——甘蔗杆状病毒(sugarcane bacilliform virus,SCBV)的多重PCR检测技术,适用于目前甘蔗病毒病中常发的复合类型的检测。涉及2种核酸性质病毒的多种PCR检测技术与核酸性质一致的病毒多重PCR检测技术相比,要考虑到DNA组分病毒无需进行反转录而RNA病毒则需基因组RNA反转录成cDNA才可进行PCR检测。本研究所涉及到的2种病毒,PnVY为RNA病毒,TYLCCNV为DNA病毒,这是2种核酸性质不同的病毒,因此,为了兼顾PnVY的RNA特性及TYLCCNV的DNA特性,且减少操作步骤、缩短检测时间和节约检测成本,本研究在核酸提取时采用了能同时将RNA和DNA都提取出来的CTAB法,只提一次核酸,就能同时将染病植物里复合感染的RNA病毒和DNA病毒的核酸都提取出来,且核酸的完整性较好,不影响后续的PCR检测[17]。另外,设计的双重检测技术采用一步法RT-PCR,兼顾了RNA病毒检测时需要先进行RNA的反转录然后才能以cDNA作为模板进行PCR扩增,并通过对反应条件与反应体系的反复摸索优化,最终建立起可同时检测三七上的PnVY和TYLCCNV的一步法多重PCR检测体系,极大地提高了病毒的检测效率。所建立的检测技术体系对PnVY和TYLCCNV同步检测的模板核酸稀释梯度仅达到0.01,检测灵敏度与其他核酸性质相同的植物病毒多重检测技术相比要低[21-22]。该技术对PnVY的检测灵敏度要比TYLCCNV高10倍,目前尚不清楚这种差异是否与检测体系中针对PnVY的反转录过程有关。但该技术已成功实现对PnVY和TYLCCNV的同步检测,为田间三七上发生的PnVY、TYLCCNV的检测鉴定提供了便利,有利于及时、快速开展相关病毒病的防治工作。此外,杨馨[12]从表现皱缩症状的三七果皮上检测到PnVY,推测PnVY具有种子传播的特性。因此,该技术除了运用于田间三七叶片等组织PnVY、TYLCCNV的检测鉴定外,还可应用于三七果实甚至传播介体昆虫的PnVY和TYLCCNV鉴定,通过该技术将有助于加强三七育种育苗环节的病毒病预防工作。
PnVY的寄主范围除三七外还有茄科的黄烟、辣椒,豆科的豇豆和菜豆等[12],随着介体昆虫的传播,不排除PnVY在上述作物发生流行的可能性。本研究所建立的同步检测技术可实现PnVY、TYLCCNV的快速检测,也将为其它作物上此2种病毒的鉴定与防治工作提供技术支撑。目前,该技术只能实现PnVY、TYLCCNV 2种病毒的同步检测,为了进一步提高三七病毒病病原鉴定的检测效率,后期将进一步研究更多病毒种类数量及病毒组合类型的多重检测技术,如在实现同步检测PnVY、TYLCCNV的基础上,进一步实现与TYLCCNB、PnVA、TVDV、CMV、ToMV等的同步检测,进一步提高三七病毒病病原鉴定的全面性、高效性、准确性,为三七病毒病的预防和控制提供技术支撑。
利益冲突 所有作者均声明不存在利益冲突
[1] Wang C Z, McEntee E, Wicks S,. Phytochemical and analytical studies of(Burk.) F.H. Chen [J]., 2006, 60(2): 97-106.
[2] 马孝川. 中药三七药理作用及真伪鉴别探讨[J]. 临床合理用药杂志, 2015, 8(22): 118-119.
[3] 陈昱君, 王勇, 李晓静, 等. 三七病毒病症状类型及分布调查初报[J]. 云南农业大学学报: 自然科学, 2016, 31(1): 178-184.
[4] 陈燕芳, 金羽, 李桂芬, 等. 三七病毒病鉴定初报[J]. 植物检疫, 2004, 18(4): 212-213.
[5] Yan Z L, Song L M, Zhou T,. Identification and molecular characterization of a new potyvirus from[J]., 2010, 155(6): 949-957.
[6] Li X J, Liu F, Li Y Y,. First report of Tomato yellow leaf curl China virus with betasatellite infecting[J]., 2014, 98(9): 1284.
[7] 宋丽敏, 梁文星, 姜辛, 等. 三七上番茄花叶病毒的初步鉴定[A] // 第三次全国植物病毒和病毒防治学术研讨会论文集[C]. 昆明: 中国植物病理学, 2003:117-118.
[8] 金羽, 张永江, 陈燕芳, 等. 三七花叶症的检测与鉴定 [J]. 中国植保导刊, 2005, 25(6): 10-11.
[9] 杨建忠, 王勇, 张葵, 等. 蓟马危害三七调查初报 [J]. 中药材, 2008, 31(5): 636-638.
[10] Guo L F, Yang X, Wu W,. Identification and molecular characterization ofvirus A, which may represent an undescribed novel species of the genus, family Totiviridae [J]., 2016, 161(3): 731-734.
[11] 杨馨, 孟鈺, 李梅蓉, 等. 云南三七病毒病的发生及病毒种类检测[J]. 植物病理学报, 2019, 49(4): 456-464.
[12] 杨馨. 云南三七病毒病调查及相关病毒检测鉴定[D]. 昆明: 云南农业大学, 2016.
[13] 刘云芝, 王勇, 孙玉琴, 等. 三七皱缩型病毒病发生规律调查研究[J]. 现代农业科技, 2015(14): 105-106.
[14] 董代幸, 张祥林, 罗明, 等.马铃薯病毒一步法多重RT-PCR检测技术的构建[J]. 微生物学通报, 2011, 38(1): 131-137.
[15] 曾静, 张飞云, 李晶晶, 等. 四种广普性植物病毒高效mPCR检测方法的建立[J]. 生物技术通报, 2007(6): 108-112.
[16] 薛杨, 安德荣, 李明福. 葡萄的两种检疫性病毒的多重RT-PCR检测[J]. 植物病理学报, 2005, 35(6): 14-17.
[17] Li R, Mock R, Huang Q,. A reliable and inexpensive method of nucleic acid extraction for the PCR-based detection of diverse plant pathogens [J]., 2008, 154(1/2): 48-55.
[18] 刘立红, 刘英, 王芬, 等. 云南三七产业发展现状及发展建议[J]. 中国现代中药, 2017, 19(9): 1331-1335.
[19] 李晓静. 三七病毒病病原种类鉴定及其相关病毒分子变异分析[D].昆明: 云南农业大学, 2014.
[20] 唐瑶, 周龙武, 徐正银, 等. 同时检测甘蔗DNA病毒和RNA病毒的多重RT-PCR方法的建立和应用 [J]. 基因组学与应用生物学, 2015, 34(7): 1482-1486.
[21] Li F, Zuo R J, Jorge A,. Simultaneous detection and differentiation of four closely related sweet potato potyviruses by a multiplex one-step RT-PCR [J]., 2012, 186(1/2): 161-166.
[22] Liu F, Tan G L, Li X J,. Simultaneous detection of four causal agents of tobacco bushy top disease by a multiplex one-step RT-PCR [J]., 2014, 205(2):99-103.
Simultaneous detection technology of PnVY and TYLCCNV inby PCR
LIU Qin-hai1, YANG Xin1, LI Xiao-jing1, LAN Ping-xiu1, LI Fan1, TAN Guan-lin2
1. College of Plant Protection, Yunnan Agricultural University, Kunming 650201, China 2. Modern Education Technology Center, Yunnan Agricultural University, Kunming 650201, China
To establish an efficient, rapid and accurate method for the simultaneous detection of panax virus Y (PnVY) and tomato yellow leaf curl China virus (TYLCCNV) inby dual PCR.Diseasedleaves of single infection of PnVY, or TYLCCNV, and co-infection of PnVY and TYLCCNV were selected as test samples. Total RNAs were extracted using CTAB method. Specific detection primers were designed according to the nucleic acid sequences of the two viruses registered on GenBank. The occurrence of PnVY and TYLCCNV insamples were confirmed by conventional PCR, then the appropriate primer combination and concentration were screened for the dual detection assay about PnVY and TYLCCNV by one-step PCR, and the amplification conditions were also optimized. The accuracy and specificity of the PCR assay were tested by cloning and sequencing the amplified DNA fragments.The established one-step dual PCR detection technology could simultaneously and effectively detect PnVY and TYLCCNV in the diseasedsamples with higher detection sensitivity and specificity. The detection limits of the dual PCR method were 10-2dilution for both PnVY and TYLCCNV.The established one-step dual PCR detection technique can detect PnVY and TYLCCNV viruses simultaneously in the diseasedsamples efficiently, quickly, accurately and specifically.
(Burk.) F. H. Chen; virus detection; panax virus Y; tomato yellow leaf curl China virus; dual PCR
R286.2
A
0253 - 2670(2022)24 - 7864 - 07
10.7501/j.issn.0253-2670.2022.24.023
2022-05-20
国家自然科学基金资助项目(31660039);云南省专家工作站(202005AF150040)
柳勤海(1999—),男,硕士研究生,研究方向为植物病毒学。E-mail: hzliuqinhai@outlook.com
李 凡(1970—),男,教授,研究方向为植物病毒学。E-mail: fanli@ynau.edu.cn
谭冠林(1973—),女,副研究员,研究方向为植物病毒学。E-mail: gltan@126.com
#共同第一作者:杨 馨(1991—),女,硕士,研究方向为植物病毒学。E-mail: yangxin8046@163.com
[责任编辑 时圣明]

