三白草地上部分化学成分及抗氧化活性研究
高 秀,柏 旭,蔡 建,范 亮,王俊人,张丽芳,刘威良,董建伟
三白草地上部分化学成分及抗氧化活性研究
高 秀1, 2,柏 旭1,蔡 建1, 2,范 亮1,王俊人1,张丽芳1, 2,刘威良1, 2,董建伟3*
1. 曲靖师范学院生物资源与食品工程学院,云南 曲靖 655011 2. 曲靖师范学院 云南省高校特色果酒技术创新与应用工程研究中心,云南 曲靖 655011 3. 曲靖师范学院化学环境科学学院,云南 曲靖 655011
对三白草地上部分的化学成分及其抗氧化活性进行研究。采用MCI HP20、硅胶、Sephadex LH-20等多种色谱材料进行分离纯化,根据波谱数据鉴定化合物的结构。采用DPPH方法和ABTS方法评价各化合物的体外抗氧化活性。从三白草地上部分丙酮提取物中分离得到17个化合物,分别鉴定为里卡灵A(1)、里卡灵B(2)、二氢愈疮木脂酸(3)、rel-(8,8′)-dimethyl-(7,7′)-bis (3,4-methylenedioxyphenyl) tetrahydrofuran(4)、odoratisol C(5)、nectandrin B(6)、三白草酮(7)、surinomensin(8)、樟叶素(9)、三白草醇E(10)、三白草醇(11)、马萨婷 B(12)、stigmasta-4,22-dien-3-one(13)、(24)-24-ethylcholest-4-en-3,6-dione(14)、sauruchinenol A(15)、邻苯二甲酸二丁酯(16)、丹皮酚(17)。化合物17为首次从该属植物中分离得到,化合物4、5、13、14为首次从该植物中分离得到,化合物1、3、7、11具有一定的体外抗氧化活性。
三白草;抗氧化;里卡灵A;三白草醇;丹皮酚
三白草(Lour.) Baill为三白草科(Saururaceae)三白草属Linn.湿生草本植物,产于河北、山东、河南和长江流域及其以南各省区,生于低湿沟边、塘边或溪旁。三白草根茎或全草具有利尿消肿、清热解毒的功效,用于治疗水肿、小便不利、淋沥涩痛、带下;外治疮疡肿毒、湿疹等症[1]。从三白草中报道的化学成分包括木脂素、二萜、生物碱、黄酮等[2],其中木脂素三白草酮类化合物为主要特征成分。现代药理学研究表明,上述成分具有抗炎、抗癌[2]、抗病毒[3]、保肝、抑制血小板聚集[4]等活性。三白草甲醇提取后石油醚萃取物、醋酸乙酯萃取物对ABTS自由基有潜在的清除作用[5],其中的二芳基丁烷型木脂素sarurin A及8--4′型木脂素machilin D则具有显著的抑制低密度脂蛋白氧化的活性[6]。因此,本研究在前期研究的基础上,继续对三白草地上部分开展化学成分及其体外抗氧化活性研究,以期发现具有显著抗氧化活性的单体成分。本研究从三白草地上部分丙酮提取物开展了系统的化学成分研究,从中分离得到17个化合物,分别鉴定为里卡灵A(licarin A,1)、里卡灵B(licarin B,2)、二氢愈疮木脂酸(dihydroguaiaretic acid,3)、rel-(8,8′)-dimethyl- (7,7′)-bis (3,4-methylenedioxyphenyl) tetrahydrofuran(4)、odoratisols C(5)、nectandrin B(6)、三白草酮(sauchinone,7)、surinamensin(8)、樟叶素(polysyphorin,9)、三白草醇E(saucerneol E,10)、三白草醇(saucerneol,11)、马纳萨亭B(manassantin B,12)、豆甾-4,22-二烯-3酮(tigmasta-4,22-dien- 3-one,13)、(24)-24-ethylcholest-4-en-3,6-dione(14)、sauruchinenol A(15),邻苯二甲酸二丁酯(dibutyl phthalate,16)。其中,化合物17为首次从三白草属分离得到,化合物4、5、13、14为首次从该植物中分离得到,并且化合物13和14为首次从该植物中得到的甾体类成分。此外,本实验还进一步研究了所得天然单体化合物的体外抗氧化活性。结果显示,化合物1、3、7、11表现出了显著的抗氧化活性。
1 仪器与材料
Bruker Avance 400 MHz(瑞士Bruker公司,),Bruker Tensor-27型傅里叶变换红外光谱仪(德国Bruker公司);amaZon SL型离子阱质谱仪(美国Bruker公司);TU-1901型紫外可见分光光度仪(北京普析通用公司);MK3型酶标仪(赛默飞世尔公司);96孔板(Nest biotech);柱色谱硅胶(青岛海洋化工厂,100~200、200~300目);GF254薄层色谱硅胶板(青岛海洋化工厂);柱色谱聚酰胺(80~100目,国药集团化学试剂有限公司);MCI HP20(日本三菱化学公司);Sephadex LH-20(Pharmacia公司,瑞典);显色剂(10%硫酸乙醇溶液,喷洒后适当加热);Greagent分析纯有机试剂(泰坦科技股份有限公司);DPPH、ABTS(盖德化工);-抗坏血酸(Sigma-Aldrichh)。
药材三白草地上部分于2015年5月采自安徽亳州,并由曲靖师范学院韩利红教授鉴定为三白草(Lour.) Baill的干燥地上部分,标本(201508M)存放在曲靖师范学院生物资源与食品工程学院标本室。
2 方法
2.1 提取与分离
三白草干燥地上部分20 kg用丙酮冷浸提取3次,每次24 h,合并提取液,减压蒸馏除去有机溶剂。将提取物分散于水中用醋酸乙酯萃取3次,回收溶剂后,得醋酸乙酯部分986 g。用(80~100目)聚酰胺拌样进行MCI HP20柱色谱分离,以甲醇-水(3∶7→10∶0)梯度洗脱,经TLC分析,合并相同组分得Fr. 1~7。Fr. 1(9 g)经正相硅胶柱色谱,以石油醚-醋酸乙酯(9.8∶0.2→1∶1)梯度洗脱,TLC检测,合并相同组分,得到Fr. 1.1~1.4。Fr. 1.2经Sephadex LH-20[甲醇-水(7∶3)]色谱,得化合物11(269.8 mg)。Fr. 2(19 g)经正相硅胶柱色谱,以石油醚-醋酸乙酯(8.5∶1.5)洗脱得到Fr. 2.1~2.4,Fr. 2.3(2.54 g)经正相硅胶柱色谱,以二氯甲烷-醋酸乙酯(100∶1)洗脱得到Fr. 2.3.1~2.3.3,Fr. 2.3.3再经硅胶柱色谱,以石油醚-丙酮(8:2)洗脱得化合物10(127 mg)。Fr. 3(12.57 g)经反复硅胶柱色谱,以石油醚-丙酮(9∶1)洗脱,得Fr. 3.1~3.5,Fr. 3.2经石油醚-醋酸乙酯(8∶2)洗脱得化合物13(269 mg);Fr. 3.3经石油醚-醋酸乙酯(8.5∶1.5)洗脱得化合物14(89 mg)。Fr. 4(97 g)经反相MCI HP20柱色谱,甲醇-水(60∶40→95∶5)梯度洗脱,经TLC检测,合并相同部分得Fr. 4.1~4.7。Fr. 4.3(8.92 g)经正相硅胶柱色谱,以石油醚-醋酸乙酯(9.8∶0.2)洗脱得到Fr. 4.3.1~4.3.10。Fr. 4.3.3(2.12 g)经Sephadex LH-20[甲醇-水(7∶3)],再经正相硅胶柱色谱,以石油醚-丙酮(8.5∶1.5)洗脱得到化合物1(71.0 mg);Fr. 4.3.5(2.8 g)经反复硅胶柱色谱,以石油醚-丙酮(9∶1),石油醚-醋酸乙酯(8∶2)反复洗脱得到化合物15(69 mg),化合物16(112 mg)。Fr. 4.7(5.26 g)经正相硅胶柱色谱,以二氯甲烷-醋酸乙酯(9.8∶0.2)洗脱得到化合物6(121.0 mg)。Fr. 4.4(2.47 g)经反复硅胶柱色谱,以石油醚-醋酸乙酯(8.5∶1.5→1∶1)梯度洗脱,TLC检测,合并相同组分,得到Fr. 4.4.1~4.4.4。Fr. 4.4.3经正相硅胶柱色谱,以石油醚-丙酮(7.5∶2.5→1∶1)梯度洗脱,再经Sephadex LH-20[甲醇-水(7∶3)]色谱,得化合物3(82.2 mg)。Fr. 4.4.2经正相硅胶柱色谱,以石油醚-醋酸乙酯(8.5∶1.5)洗脱,得化合物5(64.5 mg)。Fr. 5(3.72 g)经正相硅胶柱色谱,以石油醚-丙酮(7.5∶2.5)洗脱得到Fr. 5.1~5.4,Fr. 5.3(1.65 g)经正相硅胶柱色谱,经Sephadex LH-20[甲醇-水(7∶3)]色谱,Fr.5.3.3再经硅胶柱色谱,以石油醚-丙酮(7∶3)洗脱得化合物7(200 mg)。Fr. 5.2(1.27 g)经正相硅胶柱色谱,以石油醚-丙酮(8∶2)洗脱得化合物12(156 mg)。Fr. 6(4.78 g)经正相硅胶柱色谱,以石油醚-丙酮(9.8∶0.2→9∶1)梯度洗脱,TLC检测,合并相同组分,得到Fr. 6.1~6.4。Fr. 6.1(1.65 g)经正相硅胶柱色谱,以石油醚-醋酸乙酯(9.8∶0.2)洗脱,得化合物4(16.9 mg)。Fr. 6.2(2.67 g)经正相硅胶柱色谱,以石油醚-醋酸乙酯(80∶1)洗脱,TLC检测,合并相同组分,得到Fr. 6.2.1~6.2.4。Fr. 6.2.3经反复硅胶柱色谱,以石油醚-醋酸乙酯(8∶2),石油醚-丙酮(9∶1)洗脱,TLC检测,得化合物8(33.6 mg)和9(20.3 mg)。Fr. 6.3(2 g)经正相硅胶柱色谱,以石油醚-丙酮(9.8∶0.2→1∶1)梯度洗脱,TLC检测,得化合物17(21 mg),合并剩余相同组分,经丙酮反复重结晶,得化合物2(168 mg)。
2.2 抗氧化活性实验
2.2.1 DPPH法 将2 mmol/mL浓度的20 μL DPPH乙醇溶液加入到96孔板,然后加入20 μL抗坏血酸,160 μL无水乙醇和不同质量浓度(1、0.8、0.5、0.4、0.2、0.1、0.05 mg/mL)的待测化合物溶液,并在室温下避光放置30 min。在波长513 nm处,通过酶标仪测量每个孔的吸光度()值,并计算其DPPH的清除活性。
2.2.2 ABTS法 将100 μL过硫酸钾溶液和ABTS的混合溶液(1∶1,在室温下暗处放置12~16 h)加入到96孔板中,然后加入20 μL ABTS溶液,再分别加入180 μL抗坏血酸或不同质量浓度(1、0.8、0.5、0.4、0.2、0.1、0.05 mg/mL)的待测化合物溶液,以PB溶液为空白对照,室温下避光放置20 min后,于波长734 nm处检测值,计算其ABTS清除活性。
3 结果
3.1 结构鉴定
化合物1:淡黄色油状液体,ESI-MS/: 349 [M+Na]+。1H-NMR (400 MHz, CDCl3): 6.87 (2H, s, H-2, H-6), 6.78 (1H, d,= 1.7 Hz, H-6¢), 6.67 (1H, d,= 8.6 Hz, H-2¢), 6.25 (1H, d,= 15.7 Hz, H-7¢), 6.00 (1H, dd,= 15.7, 6.6 Hz, H-8¢), 4.99 (1H, d,= 9.4 Hz, H-7), 3.78 (3H, s, 3-OCH3), 3.74 (3H, s, 5¢-OCH3), 3.33 (1H, m, H-5¢), 1.78 (3H, d,= 6.6 Hz, H-9¢), 1.23 (3H, d,= 6.8 Hz, H-9);13C-NMR (100 MHz, CDCl3)C132.1 (C-1), 109.0 (C-2), 146.6 (C-3), 145.9 (C-4), 114.2 (C-5), 120.0 (C-6), 93.8 (C-7), 45.7 (C-8), 17.6 (C-9), 132.3 (C-1¢), 109.3 (C-2¢), 144.2 (C-3¢), 146.8 (C-4¢), 133.3 (C-5¢), 113.4 (C-6¢), 131.0 (C-7¢), 123.5 (C-8¢), 18.4 (C-9¢), 56.0 (OCH3), 56.1 (OCH3)。以上谱学数据与文献报道基本一致[7],故鉴定化合物1为里卡灵A。
化合物2:淡黄色油状液体,ESI-MS/: 347 [M+Na]+。1H-NMR (400 MHz, CDCl3): 6.90 (1H, d,= 1.8 Hz, H-2), 6.82 (1H, dd,= 8.0, 1.8 Hz, H-6), 6.76 (1H, s, H-2¢), 6.72 (1H, s, H-6¢), 6.71 (1H, d,= 8.0 Hz, H-5), 6.31 (1H, d,= 15.6 Hz, H-7¢), 6.07 (1H, dq,= 15.7, 6.6 Hz, H-8¢), 5.83 (2H, s, -OCH2O-), 5.04 (1H, d,= 9.1 Hz, H-7), 3.83 (3H, s, OCH3), 3.39~3.27 (1H, m, H-8), 1.82 (3H, dd,= 6.6 Hz, H-9¢), 1.31 (3H, d,= 6.8 Hz, H-9);13C-NMR (100 MHz, CDCl3): 133.8 (C-1), 108.1 (C-2), 147.7 (C-3), 146.6 (C-4), 109.4 (C-5), 120.2 (C-6), 93.4 (C-7), 45.8 (C-8), 17.8 (C-9), 132.2 (C-1¢), 107.5 (C-2¢), 147.98 (C-3¢), 144.8 (C-4¢), 134.4 (C-5¢), 113.4 (C-6¢), 131.1 (C-7¢), 123.3 (C-8¢), 18.5 (C-9¢), 101.2 (-OCH2O-), 55.9 (OCH3)。以上谱学数据与文献报道基本一致[7],故鉴定化合物2为里卡灵 B。
化合物3:淡黄色油状液体,ESI-MS/: 353 [M+Na]+。1H-NMR (400 MHz, CDCl3): 6.52 (2H, d,= 2.0 Hz, H-2, 2′), 6.79 (2H, d,= 7.9 Hz, H-5, 5′), 6.58 (2H, dd,= 8.0, 2.0 Hz, H-6, 6′), 2.52~2.38 (4H, m, H-7, 7′), 1.73 (2H, m, H-8, 8′), 0.82 (6H, d,= 6.6 Hz, H-9, 9′), 3.80 (6H, s, OCH3×2);13C-NMR (100 MHz, CDCl3): 133.6 (C-1, 1′), 111.3 (C-2, 2′), 146.2 (C-3, 3¢), 143.5 (C-4, 4¢), 113.9 (C-5, 5′), 121.7 (C-6, 6′), 41.1 (C-7, 7′), 37.5 (C-8, 8′), 13.9 (C-9, 9′), 55.8 (-OCH3×2)。以上谱学数据与文献报道基本一致[8],故鉴定化合物3为二氢愈疮木脂酸。
化合物4:淡黄色油状液体,ESI-MS/: 363 [M+Na]+。1H-NMR (400 MHz, CDCl3): 6.91 (2H, d,= 1.6 Hz, H-2, 2′), 6.77 ( 2H, d,= 8.0 Hz, H-5, 5′), 6.83 (2H, dd,= 8.1, 1.6 Hz, H-6, 6′), 4.6 (2H, d,= 9.3 Hz H-7, 7′), 1.74 (2H, m, H-8, 8′), 1.02 (6H, d,= 6.1 Hz, H-9, 9′), 5.94 (4H, s, -OCH2O-);13C-NMR (100 MHz, CDCl3):119.8 (C-1, 1′), 119.78 (C-2, 2′), 147.8 (C-3, 3´), 147.0 (C-4, 4´), 106.6 (C-5, 5′), 107.9 (C-6, 6′), 88.3 (C-7, 7′), 51.0 (C-8, 8′), 13.9 (C-9, 9′), 101.0 (-OCH2O-×2)。以上谱学数据与文献报道基本一致[9],故鉴定化合物4为rel-(8,8′)-dimethyl- (7,7′)-bis(3,4-methylenedioxyphenyl) tetrahydrofuran。
化合物5:淡黄色油状液体,ESI-MS/: 367 [M+Na]+。1H NMR (400 MHz, CDCl3): 7.04 (1H, d,= 1.9 Hz, H-2), 6.92 (1H, d,= 8.1 Hz, H-5), 6.98 (1H, dd,= 8.2, 1.9 Hz, H-6), 4.40 (1H, d,= 9.3 Hz, H-7), 1.83–1.74 (1H, m, H-8), 1.05 (3H, d,= 6.6 Hz, H-9), 6.83 (1H, d,= 1.9 Hz, H-2′), 6.84 (1H, d,= 8.1Hz, H-5′), 6.88 (1H, dd,= 8.1, 2.3 Hz, H-6′), 5.11 (1H, d,= 8.6 Hz, H-7′), 2.29 –2.18 (1H, m, H-8′), 0.66 (3H, d,= 7.0 Hz, H-9′), 3.90 (3H, s, 3-OCH3), 3.85 (3H, s, 3′-OCH3);13C-NMR (100 MHz, CDCl3): 133.2 (C-1), 109.5 (C-2), 146.6 (C-3), 145.2 (C-4), 114.2 (C-5), 119.3 (C-6), 87.4 (C-7), 47.7 (C-8), 14.9 (C-9), 132.8 (C-1′), 109.8 (C-2′), 146.2 (C-3′), 144.6 (C-4′), 113.9 (C-5′), 119.9 (C-6′), 83.2 (C-7′), 46.0 (C-8′), 15.0 (C-9′), 55.9 (-OCH3), 55.9 (-OCH3′)。以上谱学数据与文献报道基本一致[10],故鉴定化合物5为odoratisols C。
化合物6:淡黄色油状液体C20H24O5,1H-NMR (400 MHz, acetone-6): 0.66 (6H, d,= 5.6 Hz, H-9, 9¢), 2.27 (2H, m, H-8, 8¢), 3.86 (6H, s, 2×OCH3), 5.42 (2H, d,= 6.5 Hz, H-7, 7¢), 5.70 (2H, brs, 2×OH), 6.73~6.86 (6H, m, Ar-H);13C-NMR (100 MHz, acetone-6): 134.2 (s, C-1, 1), 111.3 (d, C-2, 2), 148.7 (s, C-3, 3), 146.6 (s, C-4, 4), 115.8 (d, C-5, 5), 120.2 (d, C-6, 6), 85.7 (d, C-7, 7¢), 44.6 (d, C-8, 8¢), 14. 7 (q, C-9, 9¢), 56.4 (OCH3×2)。以上谱学数据与文献报道基本一致[11],故鉴定化合物6为nectandrin B。
化合物7:无色针状晶体(丙酮),ESI-MS/: 349 [M+Na]+。1H NMR (400 MHz, CDCl3): 6.41 (1H, s, H-3), 6.85 (1H, s, H-6), 3.05 (1H, d,= 5.0 Hz, H-7), 2.47, (1H, m, H-8), 1.23 (3H, d,= 7.1 Hz, H-9), 2.53 (1H, m, H-1′), 1.92 (1H, m, H-7′ax), 1.66 (1H, m, H-7′eq), 0.74 (3H, d,= 7.8 Hz, H-9′), 5.94 (2H, d,= 1.3 Hz, -OCH2O-), 5.92 (2H, d,= 16.0 Hz, 4-OCH2O-5), 5.66 (2H, d,= 20.0 Hz, 4′-OCH2O-5′), 2.50 (1H, d,= 5.0 Hz, H-6′);13C-NMR (100 MHz, CDCl3): 115.7 (C-1), 144.9 (C-2), 99.1 (C-3), 143.2 (C-4), 146.6 (C-5), 106.5 (C-6), 35.0 (C-7), 34.7 (C-8), 21.2 (C-9), 37.5 (C-1′), 199.7 (C-2′), 100.1 (C-3′), 168.6 (C-4′), 100.4 (C-5′), 37.5 (C-6′), 25.2 (C-7′), 33.4 (C-8′), 20.9 (C-9′), 101.3 (-OCH2O-), 98.6 (-OCH2O-)。以上谱学数据与文献报道基本一致[12],故鉴定化合物7为sauchinone。
化合物8:淡黄色油状液体,C22H28O6,1H-NMR (400 MHz, CDCl3): 6.87 (1H, s, H-3¢), 6.86 (1H, d,= 8.2 Hz, H-6¢) 6.79 (1H, dd,= 8.2, 1.9 Hz, H-5¢), 6.54 (2H, s, H-2, 6), 6.28 (1H, d,= 15.7 Hz, H-7¢), 6.08 (1H, dd,= 15.7, 6.6 Hz, H-8¢), 4.53 (1H, d,= 8.2 Hz, H-7), 4.03 (1H, dd,= 8.2, 6.3 Hz, H-8), 3.89~3.72 (12H, m, OCH3), 1.81 (3H, dd,= 6.6, 1.5 Hz, H-9¢), 1.13 (3H, d,= 6.3 Hz, H-9);13C-NMR (100 MHz, CDCl3): 135.6 (C-1), 104.2 (C-2), 153.2 (C-3), 137.6 (C-4), 153.2 (C-5), 104.2 (C-6), 78.7 (C-7), 84.1 (C-8), 17.2 (C-9), 133.5 (C-1¢), 109.1 (C-2¢), 150.7 (C-3¢), 146.6 (C-4¢), 118.8 (C-5¢), 119.0 (C-6¢), 130.4 (C-7¢), 125.0 (C-8¢), 18.4 (C-9¢), 60.8 (4-OMe), 56.1 (3, 5-OMe)。以上谱学数据与文献报道基本一致[13],故鉴定化合物8为surinamensin。
化合物9:无色油状液体,C23H30O7,1H-NMR (400 MHz, CDCl3): 6.51 (1H, s, H-2), 6.50 (1H, s, H-6), 6.26 (1H, d,= 15.7 Hz, H-7¢), 6.10 (1H, dd,= 15.6, 6.5 Hz, H-8¢), 4.52 (1H, d,= 8.3 Hz, H-7), 3.87~3.70 (15H, m, OMe), 1.80 (3H, dd,= 6.6, 1.6 Hz, H-9¢), 1.15 (3H, d,= 6.2 Hz, H-9);13C-NMR (100 MHz, CDCl3): 136.3 (C-1), 104.1 (C-2), 153.1 (C-3), 137.4 (C-4), 153.1(C-5), 104.1 (C-6), 79.3 (C-7), 86.4 (C-8), 17.6 (C-9), 133.8 (C-1¢), 102.7 (C-2¢), 152.7 (C-3¢), 136.4 (C-4¢), 152.7 (C-5¢), 102.7 (C-6¢), 130.6 (C-7¢), 125.6 (C-8¢), 18.3 (C-9¢), 60.7 (4-OMe), 56.0 (3, 5, 3¢, 5¢-OMe)。以上谱学数据与文献报道基本一致[14],故鉴定化合物9为polysyphorin。
化合物10:黄色油状液体,C30H34O8。1H-NMR (400 MHz, CDCl3): 6.97 (1H, d,= 8.2 Hz, H-5¢), 6.92~6.87 (3H, m, H-2¢, 2², 6²), 5.94 (2H, s, 3-OCH2-4), 5.44 (2H d,= 5.9 Hz, H-7, 7¢), 4.62 (1H, d,= 8.4 Hz, H-7²), 4.10 (1H, dd,= 8.2, 6.3 Hz, H-8²), 3.90 (6H s, OMe), 2.27 (2H dd,= 11.2, 6.2 Hz, H-8, 8¢), 1.15 (3H d,= 6.2 Hz, H-9²), 0.70 (6H d,= 6.3, Hz, H-9, 9¢);13C-NMR (100 MHz, CDCl3): 134.0 (s, C-1), 107.5 (d, C-2), 147.7 (s, C-3), 146.4 (s, C-4), 108.0 (d, C-5), 119.0 (d, C-6), 83.5 (d, C-7), 44.0 (d, C-8), 14.7 (q, C-9), 136.6 (s, C-1¢), 110.1 (d, C-2¢), 150.5 (s, C-3¢), 146.3 (s, C-4¢), 118.7 (d, C-5¢), 118.8 (d, C-6¢), 83.3 (d, C-7¢), 44.0 (d, C-8¢), 14.7 (q, C-9¢). 133.1 (s, C-1²), 108.9 (d, C-2²), 144.4 (s, C-3²), 147.2 (s, C-4²), 113.9 (d, C-5²), 121.0 (d, C-6²), 78.3 (d, C-7²), 83.8 (d, C-8²), 16.8 (q, C-9²), 101.0 (3-OCH2O-4), 55.9 (4²-OMe), 55.8 (3²-OMe)。以上谱学数据与文献报道基本一致[15],故鉴定化合物10为sauceneol E。
化合物11:黄色油状液体,ESI-MS/: 561 [M+Na]+。1H-NMR (400 MHz, CDCl3): 6.76~7.00 (9H, m, Ar-H), 5.44 (2H, d,= 6.3 Hz, H-7, 7′), 2.26 (2H, m, H-8, 8′), 0.69 (6H, t,= 6.0 Hz, H-9, H-9′), 4.66 (1H, d,= 8.0 Hz, H-7′′), 4.20 (1H, dq,= 8.0, 6.2 Hz, H-8′′), 1.15 (3H, d,= 6.2 Hz, H-9′′), 3.93~3.76 (12H, m, OCH3);13C-NMR (100 MHz, CDCl3): 133.1 (C-1), 109.2 (C-2), 144.7 (C-3), 146.3 (C-4), 119.0 (C-5), 114.3 (C-6), 83.3 (C-7), 44.0 (C-8), 14.8 (C-9), 136.3 (C-1′), 110.3 (C-2′), 150.4 (C-3′), 146.6 (C-4′), 118.8 (C-5′), 118.1 (C-6′), 83.3 (C-7, 7′), 44.0 (C-8′), 14.8 (C-9′), 132.8 (C-1′′), 110.2 (C-2′′), 149.0 (C-3′′), 148.8 (C-4′′), 111.0 (C-5′′), 120.0 (C-6′′), 78.1 (C-7′′), 83.7 (C-8′′), 16.8 (C-9′′), 55.9 (-OCH3)。以上谱学数据与文献报道基本一致[16],故鉴定化合物11为saucerneol。
化合物12:黄色油状液体,ESI-MS/: 725 [M+Na]+。1H-NMR (400 MHz, CDCl3): 7.00~6.75 (12H, m, H-Ar), 5.47 (2H, d,= 5.8 Hz, H-7, 7′), 2.29 (2H, m, H-8, 8′), 0.71 (6H, d,= 6.0 Hz, H-9, 9′), 4.66 (1H, d,= 8.0 Hz, H-7′′), 4.62 (1H, d,= 8.0 Hz, H-7′′′), 4.17 (2H, m, H-8′′, 8′′′), 1.15 (6H, t,= 7.0 Hz, H-9′′, 9′′′), 5.91 (2H, s, -OCH2O-), 3.97~3.68 (12H, s, OCH3);13C-NMR (100 MHz, CDCl3): 136.2 (C-1), 110.1 (C-2), 146.2 (C-3), 150.4 (C-4), 108.0 (C-5), 118.1 (C-6), 83.4 (C-7), 44.0 (C-8), 14.8 (C-9), 136.3 (C-1′), 110.1 (C-2′), 146.3 (C-3′), 150.3 (C-4′), 107.5 (C-5′), 118.3 (C-6′), 83.4 (C-7′), 44.0 (C-8′), 14.8 (C-9′), 132.6 (C-1′′), 110.1(C-2′′), 147.3 (C-3′′), 148.7 (C-4′′), 118.7 (C-5′′), 119.9 (C-6′′), 83.3 (C-7′′), 83.2 (C-8′′), 16.7 (C-9′′), 134.1 (C-1′′′), 110.8 (C-2′′′), 147.7 (C-3′′′), 148.9 (C-4′′′), 118.7 (C-5′′′), 121.0 (C-6′′′), 78.1 (C-7′′′), 83.2 (C-8′′′), 16.8 (C-9′′′), 101.0 (-OCH2O), 55.8 (-OCH3)。以上谱学数据与文献报道基本一致[16],故鉴定化合物12为manassantin B。
化合物13:无色油状液体,ESI-MS/: 725 [M+Na]+。1H-NMR (400 MHz, CDCl3): 7.08 (1H, dq,= 3.0, 1.5 Hz, H-3), 4.53 (1H, brs, H-4), 3.11 (1H, dd,= 9.1, 2.5 Hz, H-5), 4.98 (1H, d,= 10.1 Hz, H-6), 2.14 (2H, m, H-8), 6.79 (1H, t,= 7.4 Hz, H-10), 2.30~2.22 (4H, m, H-9, 12), 2.03 (2H, m, H-13), 5.05 (1H, t,= 7.3 Hz, H-14), 1.60 (3H, s, H-16), 1.52 (3H, s, H-17), 1.70 (3H, s, H-19), 1.74 (3H, s, H-20);13C-NMR (100 MHz, CDCl3): 206.4 (C-1), 142.7 (C-2), 155.3 (C-3), 76.3 (C-4), 56.2 (C-5), 120.1 (C-6), 140.5 (C-7), 38.4 (C-8), 26.9 (C-9), 144.8 (C-10), 131.5 (C-11), 26.8 (C-12), 27.6 (C-13), 123.5 (C-14), 132.5 (C-15), 25.8 (C-16), 17.7 (C-17), 173.1 (C-18), 16.9 (C-19), 10.3 (C-20)。以上谱学数据与文献报道基本一致[17],故鉴定化合物13为sauruchinenols A。
化合物14:无色针晶(醋酸乙酯),ESI-MS/: 433 [M+Na]+。1H-NMR (400 MHz, CDCl3): 5.65 (1H, s, H-4), 5.07 (1H, dd,= 15.2, 8.5 Hz, H-22), 4.96 (1H, d,= 8.4 Hz, H-23);13C-NMR (100 MHz, CDCl3): 35.6 (C-1), 34.0 (C-2), 199.8 (C-3), 123.8 (C-4), 171.8 (C-5), 33.0 (C-6), 32.0 (C-7), 35.6 (C-8), 53.8 (C-9), 38.6 (C-10), 21.0 (C-11), 39.5 (C-12), 42.3 (C-13), 55.9 (C-14), 24.3 (C-15), 28.9 (C-16), 55.9 (C-17), 12.2 (C-18), 17.4 (C-19), 40.5 (C-20), 21.1 (C-21), 138.2 (C-22), 129.4 (C-23), 51.2 (C-24), 31.9 (C-25), 21.2 (C-26), 19.0 (C-27), 25.4 (C-28), 12.3 (C-29)。以上谱学数据与文献报道基本一致[18],故鉴定化合物14为stigmasta-4,22-dien-3-one。
化合物15:无色针晶(醋酸乙酯),ESI-MS/: 449 [M+Na]+。1H-NMR (400 MHz, CDCl3): 6.08 (1H, s, H-4);13C-NMR (100 MHz, CDCl3): 35.48 (C-1), 34.0 (C-2), 202.3(C-3), 125.4 (C-4), 161.1 (C-5), 199.5 (C-6), 46.8 (C-7), 34.2 (C-8), 50.9 (C-9), 39.8 (C-10), 20.9 (C-11), 39.1 (C-12), 42.5 (C-13), 56.5 (C-14), 24.0 (C-15), 28.0 (C-16), 55.8 (C-17), 11.98 (C-18), 17.5 (C-19), 36.0 (C-20), 18.7 (C-21), 33.8 (C-22), 26.0 (C-23), 45.7 (C-24), 29.1 (C-25), 19.0 (C-26), 19.9 (C-27), 23.0 (C-28), 11.9 (C-29)。以上谱学数据与文献报道基本一致[19-20],故鉴定化合物15为(24)-24-ethylcholest-4-en-3, 6-dione。
化合物16:白色粉末,ESI-MS/: 301 [M+Na]+。1H-NMR (400 MHz, CDCl3): 7.71 (2H, dd,= 5.7, 3.3 Hz, H-3, 6), 7.52 (2H, dd,= 5.7, 3.3 Hz, H-4, 5), 4.31 (4H, t,= 6.7 Hz, H-1′), 1.72 (2H, tt,= 8.0, 6.6 Hz, H-2′), 1.44 (4H, m, H-3′), 0.96 (6H, t,= 7.4 Hz, H-4′);13C-NMR (100 MHz, CDCl3): 167.7 (COO-), 132.3 (C-1, 2), 130.9 (C-4, 5), 128.8 (C-3, 6), 65.6 (C-1′), 30.6 (C-2′), 19.2 (C-3′), 13.7 (C-4′)。以上谱学数据与文献报道基本一致[21],故鉴定化合物16为邻苯二甲酸二丁酯。
化合物17:无色针晶(醋酸乙酯),ESI-MS/: 189 [M+Na]+。1H-NMR (400 MHz, CDCl3):7.63 (1H, d,= 8.7 Hz, H-6), 6.43 (1H, m, H-5), 6.46 (1H, m, H-3), 3.85 (3H, s, OCH3), 2.56 (3H, s, H-9);13C-NMR (100 MHz, CDCl3): 113.9 (s, C-1), 165.2 (s, C-2), 100.8 (d, C-3), 166.1 (s, C-4), 107.6 (d, C-5), 132.3 (d, C-6), 202.6 (s, C-7), 26.2 (q, C-8), 55.5 (OCH3)。以上谱学数据与文献报道基本一致[22],故鉴定化合物17为丹皮酚。
3.2 体外抗氧化活性实验结果
文献报道三白草石油醚萃取物、醋酸乙酯萃取物对ABTS自由基有潜在的清除作用[5],三白草中的二芳基丁烷型木脂素sarurin A及8--4′型木脂素machilin D具有显著的抑制低密度脂蛋白氧化的活性[6]。因此,本实验还进一步研究了所得化合物1~16的体外抗氧化活性。
结果(表1)显示,与阳性对照-抗坏血酸相比,化合物1、3、7、11均表现出了一定的抗氧化活性,但体外抗氧化活性不如-抗坏血酸。从化合物结构类型看,所得天然产物中,木脂素类成分较萜类和甾体类有较好的体外抗氧化活性。
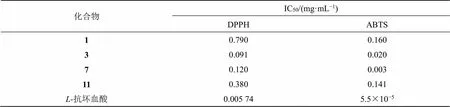
表1 化合物体外抗氧化活性
4 讨论
本实验从三白草地上部分共分离得到17个单体化合物,其中,合物17为首次从该属植物中分离得到,化合物4、5、13、14为首次从该植物中分离得到。此外,本实验还首次对从三白草中得到的单体化合物进行体外抗氧化活性测试,结果表明,木脂素类成分具有一定的体外抗氧化活性,其中,里卡灵A(1)、二氢愈疮木脂酸(3)、sauchinone(7)、三白草醇(11)显示出一定的的抗氧化活性。该结果为三白草在体内、体外抗氧化活性研究提供了较为坚实的物质基础,同时也为其进一步的开发利用提供了理论依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部: 2020.
[2] Zhuang T, Li F, Huang L R,. Secondary metabolites from the plants of the family Saururaceae and their biological properties [J]., 2015, 12(2): 194-220.
[3] Cui H, Xu B, Wu T Z,. Potential antiviral lignans from the roots ofwith activity against Epstein-Barr virus lytic replication [J]., 2014, 77(1): 100-110.
[4] Tsai W J, Shen C C, Tsai T H,. Lignans from the aerial parts of: Isolation, structural characterization, and their effects on platelet aggregation [J]., 2014, 77(1): 125-131.
[5] 尹震花, 顾雪竹, 张一冰, 等. 三白草体外抗氧化活性 [J]. 中国实验方剂学杂志, 2012, 18(4): 99-102.
[6] Ahn B T, Lee S, Lee S B,. Low-density lipoprotein-antioxidant constituents of[J]., 2001, 64(12): 1562-1564.
[7] Shin K H, Kim O N, Woo W S. Isolation of hepatic drug metabolism inhibitors from the seeds of[J]., 1988, 11(3): 240-243.
[8] Moon T C, Seo C S, Haa K,. Meso-dihydroguaiaretic acid isolated frominhibits cyclooxygenase-2 and 5-lipoxygenase in mouse bone marrow-derived mast cells [J]., 2008, 31(5): 606-610.
[9] Bandara Herath H M T, Anoma Priyadarshani A M. Two lignans and an aryl alkanone from[J]., 1996, 42(5): 1439-1442.
[10] Phan M G, Phan T S, Matsunami K,. New neolignans and lignans from Vietnamese medicinal plantNEES [J].(), 2006, 54(3): 380-383.
[11] Hattori M, Hada S, Kawata Y,. New 2,5-bis-aryl-3, 4-dimethyltetrahydrofuran lignans from the aril of[J]., 1987, 35(8): 3315-3322.
[12] Liu Y H, Wang L S, Zhao D Q,. Ent-sauchinone from[J]., 2008, 75(5): 1241.
[13] Rye C E, Barker D. Asymmetric synthesis and anti-protozoal activity of the 8,4′-oxyneolignans virolin, surinamensin and analogues [J]., 2013, 60: 240-248.
[14] Zhang H J, Tamez P A, Vu D H,. Antimalarial compounds from[J]., 2001, 64(6): 772-777.
[15] Hwang B Y, Lee J H, Nam J B,. Lignans frominhibiting the transcription factor NF-kappaB [J]., 2003, 64(3): 765-771.
[16] Rao K V, Oruganty R S. An improved method for the isolation of the lignan constituents ofby reverse phase column chromatography [J]., 1997, 20(19): 3121-3134.
[17] Gao X, He J, Wu X D,. Sauruchinenols A and B, unprecedented monocyclic diterpenes with new carbon skeleton from the aerial parts of[J]., 2017, 116: 116-120.
[18] Shu Y H, Jones S R, Kinney W A,. The synthesis of spermine analogs of the shark aminosterol squalamine [J]., 2002, 67(3/4): 291-304.
[19] Kovganko N, Yu C.13C NMR Spectra of 6- hydroximinosteroids of the stigmastane series [J].2001,(4): 351-355.
[20] Aiello A, Fattorusso E, Magno S,. Steroids of the marine sponge: Isolation of cholest-4-ene-3,6-and (24)-24-ethylcholest-4- ene-3, 6-[J]., 1991, 54(1): 281-285.
[21] Li J T, Yin B L, Liu Y,. Mono-aromatic constituents of[J].. 2009,(2): 234-236.
[22] 晏通, 丁林芬, 程彬, 等. 白斑枪刀药的化学成分研究[J]. 中草药, 2018, 49(8): 1767-1772.
Anti-oxidant chemical constituents from aerial parts of
GAO Xiu1, 2, BO Xu1, 2, CAI Jian1, 2, FAN Liang1, 2, WANG Jun-ren1, ZHANG Li-fang1, 2, LIU Wei-liang1, 2, DONG Jian-wei3
1. College of Biological Resources and Food Engineering, Qujing Normal University, Qujing 655011, China 2. Yunnan Engineering Research Center of Fruit Wine, Qujing Normal University, Qujing 655011, China 3. College of Chemistry and Environmental Science, Qujing Normal University, Qujing, 655011, China
Objective To study the chemical constituents and antioxidant activity of the aerial parts of Sanbaicao (). Methods The chemical constituents were isolated and purified by column chromatography on MCI HP20, silica gel, and Sephadex LH-20. Their structures were elucidated on the basis of spectroscopic data. DDPH and ABTS method were used to determine the antioxidant activity of the isolated compounds. Results Seventeen compounds were isolated from acetone extract of. The structures were identified as licarin A (1), licarin B (2), dihydroguaiaretic acid (3), rel-(8,8′)-dimethyl-(7,7′)-bis (3,4-methylenedioxyphenyl) tetrahydrofuran (4), odoratisol C (5), sauchinone (6), sauchinone (7), surinomensin (8), polysyphorin (9), and sauceneol E (10), saucerneol (11), manassantin B (12), tigmasta-4,22-dien-3-one (13), (24)-24-ethylcholest-4-en-3,6-dione (14), sauruchinenol A (15), dibutyl phthalate (16), paconol (17). Conclusion Compound 17 is isolated fromgenus for the first time, compounds 4, 5, 13, and 14, are isolated from this plant for the first time. In addition, Compounds 1, 3, 7, and 11 were found to have potential antioxidant activities.
(Lour.) Baill.; antioxidant activity; licarin A; saucerneol; paconol
R284.1
A
0253 - 2670(2022)24 - 7672 - 07
10.7501/j.issn.0253-2670.2022.24.004
2022-05-18
云南省科技厅-云南省地方本科高校基础研究联合专项项目(2017FH001-094 and 2017FH001-092);云南省教育厅科学研究基金资助性项目(2016ZZX208);地方高校国家级大学生创新创业训练计划项目(201610684010);云南省科技厅应用基础研究青年项目(2018FD081)
高 秀(1984—),女,博士研究生,从事天然药物化学研究。E-mail: 44417039@qq.com
董建伟(1991—),男,博士研究生,从事天然药物化学研究。E-mail: jwdongyn@mail.qjnu.edu.cn
[责任编辑 王文倩]

