基于代谢组学技术探讨鳖血柴胡“清肝退热”作用的“物质-效应”机制
宁艳梅,任 远*,吴国泰,王瑞琼,段海婧,张金保,吴平安,窦翰辰,王 蕊
基于代谢组学技术探讨鳖血柴胡“清肝退热”作用的“物质-效应”机制
宁艳梅1, 2,任 远1, 2*,吴国泰1, 2,王瑞琼1, 2,段海婧1, 2,张金保1, 2,吴平安1, 3,窦翰辰1,王 蕊1
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃省中药药理与毒理学重点实验室,甘肃 兰州 730000 3. 甘肃省中药质量与标准研究重点实验室,甘肃 兰州 730000
基于代谢组学技术探讨鳖血柴胡炮制前后“物质-效应”变化,阐释炮制对其“清肝退热”作用的影响。通过中药非靶标代谢组学结合网络药理学分析,阐释物质基础变化与“清肝退热”作用相关性;通过2,4-二硝基苯酚致发热大鼠模型及肝脏代谢组学评价鳖血柴胡的解热作用,阐释效应变化与“清肝退热”作用相关性。鳖血柴胡炮制前后的物质基础变化,在中医证候学上更侧重影响肝经,与风热、火热、湿热、血热等热证呈现证素相关性。解热药效学显示鳖血柴胡具有与生柴胡相似的解热作用,并对发热过程中的肝脏代谢物的影响较显著,具有肝脏损伤保护的优势。“物质-效应”的代谢组学变化显示,炮制可促进鳖血柴胡“清肝退热”的综合作用。
柴胡;鳖血;炮制;代谢组学;功效;清肝退热
柴胡为伞形科植物柴胡DC.或狭叶柴胡Willd.的干燥根,分别习称为“北柴胡”和“南柴胡”,药性苦、辛,微寒,主入肝、胆、肺经,功效解表退热、疏肝解郁、升举阳气[1],为中医传统解表退热的药物,始载于《神农本草经》,列为上品[2]。柴胡具有多种炮制品,如醋柴胡、酒柴胡、鳖血柴胡等[3],以鳖血柴胡尤为特色,古人期望以鳖血阴液之性,增强柴胡清肝退热之效[3]。鳖血柴胡为江西樟树帮地方炮制沿用[4],但这种用药的地域化也造成了其使用的局限性[5],内在炮制机制的科学价值阐释对其合理推广应用具有实际意义。
中药炮制机制是用于阐明中药炮制的目的以及中药炮制后对机体产生的作用,即解决中药为什么要炮制的问题[6]。中药所含成分在辅料与炮制工艺的共同作用下,发生“质”和“量”上复杂的化学变化,并成为中药炮制前后性味、功能改变的重要原因[7-8]。基于辅料作用的炮制增效减毒机制研究重在阐明加辅料炮制后所引起的成分变化及该变化对药理效应的影响,包括中药的化学成分/组分构成与药效、传统功效之间的潜在关系。现代研究对鳖血柴胡的化学成分规律有所阐释,如皂苷类成分[9]、挥发性成分[10]和多糖类成分[11]等,但相对全面的成分变化解析才能更好地解释炮制机制[12]。
代谢组学旨在识别生物系统内源性代谢物在内在和外在因素影响下的变化,倾向于一系列事件的最终结果[13-14],利用代谢组学的方法,可以筛选出所有与药效作用有关的潜在生物标志物,并对与之相关的代谢途径进行分析,从整体出发,探究中药炮制增效的内在原因。因此本研究以代谢组学技术为主要研究策略,通过炮制前后物质基础与药效变化机制,探究炮制对鳖血柴胡“清肝退热”作用的影响。
1 材料
1.1 动物
SPF级SD大鼠,雌雄各半,6~7周龄,体质量(200±20)g,购自甘肃中医药大学科研实验动物中心,实验动物许可证号SCXK(甘)2011-0001-6200100000050。动物饲养于甘肃中医药大学科研实验中心的SPF级实验动物中心,饲养区通风良好,室温18~25 ℃,相对湿度50%~70%,12 h光照/黑暗交替,普通饲料喂养,自由饮水。动物实验经甘肃中医药大学动物实验伦理委员会批准(批准号2022-127)。中华鳖购自甘肃省兰州市滩尖子农贸市场。
1.2 药材
柴胡饮片(批号20210601)购自甘肃省兰州市安宁区医药公司,由陇西县百宝药业有限责任公司生产,经甘肃中医药大学王明伟副教授鉴定为伞形科植物北柴胡DC.的干燥根,符合《中国药典》2020年版规定。
1.3 药品与试剂
LC-MS级甲醇、乙腈、甲酸购自NW Technologies;-2-氯苯丙氨酸(质量分数≥98%)购自上海恒柏生物科技有限公司;阿司匹林肠溶片(2 mg/片,批号13010441)购自山西晋新双鹤药业有限公司;大鼠白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒(批号MM-0047R2)、大鼠IL-6 ELISA试剂盒(批号MM-0190R2)、大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号MM-0180R2)、大鼠环磷酸腺苷(cyclic adenosine monophosphate,cAMP)ELISA试剂盒(批号MM-0549R2)、大鼠精氨酸加压素(antidiuretic hormone,AVP)ELISA试剂盒(批号MM-20932R2)均购自江苏酶免实业有限公司;2,4-二硝基苯酚购自中国华东师范大学化工厂。
1.4 仪器
Nexera UHPLC LC-30A型超高效液相色谱仪(日本岛津公司);Triple TOF 5600型高分辨质谱(AB Sciex公司);7890A型气相色谱仪(美国Agilent公司);PEGASUS HT型质谱仪(LECO公司);Heraeus Fresco17型离心机、Forma 900 series型超低温冰箱(美国Thermo Fisher Scientific公司);BSA124S-CW型天平、BT125D型十万分之一分析天平(德国Sartorius公司);JXFSTPRP-24型号研磨仪(上海净信科技有限公司);明澈D24 UV型号纯水仪(Merck Millipore公司);YM-080S型超声仪(深圳市方奥微电子有限公司);DHG-9023A型烘箱(上海一恒科学仪器有限公司);LNG-T98型真空干燥仪(太仓市华美生化仪器厂);AL104型万分之一分析天平(上海梅特勒-托利多仪器有限公司);HX502T型电子天平(慈溪市天东衡器厂);MC-106B型电子体温计(大连欧姆龙有限公司);组织精密匀浆器(上海易扩仪器有限公司);DDL-5型超速冷冻离心机(日本三洋电器有限公司);R811型水平振荡器(长沙诺达仪器设备有限公司);101A-1型恒温孵育箱(北京福意电器有限公司);C21-ST21125型酶标仪(南京德铁实验设备有限公司)。
2 方法
2.1 药材炮制
2.1.1 生柴胡炮制 将原药材除去杂质和残茎,用水润透,干燥所得[3]。
2.1.2 鳖血柴胡炮制 将用适量纯净水稀释1倍后的新鲜鳖血与生柴胡,按照药材-鳖血(100∶20)的比例进行炮制,4 ℃储藏闷润,至辅料被完全吸尽后,用文火加热炒干晾凉即得[3,15]。
2.2 鳖血柴胡“清肝退热”作用的物质基础机制分析
2.2.1 鳖血柴胡炮制前后化学成分UHPLC-QTOF/MS分析
(1)色谱条件:Waters Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱:0~3.5 min,95% A;3.5~6.0 min,95%~85% A;6.0~12 min,85%~70% A;12~18 min,70%~30% A;18~25 min,30%~0 A。柱温35 ℃;体积流量0.4 mL/min;进样量5 μL。
(2)质谱条件:在Analyst TF 1.7、AB Sciex控制下基于IDA功能进行一级、二级质谱数据采集。在每个数据采集循环中,筛选出强度最强且大于100的分子离子进行采集对应的二级质谱数据。轰击能量40 eV;碰撞能差20 V;ESI离子源;雾化气压(GS1)379.225 kPa;辅助气压379.225 kPa;气帘气压241.325 kPa;温度550 ℃;喷雾电压5500 V(正离子模式)、−4000 V(负离子模式)。
(3)数据处理:使用Progenesis QI软件将质谱原始导入,进行保留时间矫正、峰识别、峰提取、峰积分、峰对齐等工作,同时创建样品中相应中药代谢库,利用百趣生物(www.biotree.cn)自建二级质谱数据库及相应裂解规律匹配法对含有MS数据的峰进行物质鉴定。
(4)化学模式识别:采用SIMCA V16.0.2软件建模,分别对生柴胡与鳖血柴胡成分相对含量值进行主成分分析(principal component analysis,PCA),以观测各组样本之间的总体差异和组内样本之间的变异度大小。进一步通过正交偏最小二乘法-判别分析(orthogonal projections to latent structures- discriminant analysis,OPLS-DA),滤过与分类变量不相关的正交变量,并对非正交变量和正交变量分别分析,从而获取更加可靠的组间差异与实验组的相关程度信息。通过2(的累积模型变化)和2(累积的预测变化)预测模型可靠性。采用OPLS-DA模型第一主成分的VIP>1并结合检验的<0.05来寻找差异性表达代谢物。
2.2.2 鳖血柴胡潜在药效影响成分的解热作用及中医性效相关性分析 通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)检索显著差异成分对应的Canonical SMILES(线性结构表达式)信息,输入FAFdrugs4(http://fafdrugs4.mti.univ-paris-diderot.fr),以ADMET[吸收(absorption)、分布(distribution)、代谢(metabolism)、排泄(excretion)、毒性(toxicity)]参数预测潜在药效影响成分。将筛选出的潜在药效影响成分信息导入MetaboAnalyst 5.0(http://www.metaboanalyst.ca/)网站进行代谢通路预测分析。将潜在药效影响成分Canonical SMILES信息导入STITCH(http://stitch.embl.de/)、SwissTargetPrediction(http://swisstargetprediction.ch/)和SEA(http://sea.bkslab.org)数据库进行化合物靶点预测。通过GeneCards(https://www.genecards.org/)、DisGeNET(http://www.disgenet.org/)数据库,以fever为关键词,检索发热的疾病靶点。通过基奥数据库(https://www.omicshare.com)取成分与疾病交集靶点,导入Metascape数据库(http://metascape.org/)、String数据库(https://string-db.org/)、SymMap数据库(http://www.symmap.org)进行生物定位、生物功能信息富集及关联中医证候信息分析,并通过Cytoscape_v3.6.0软件将结果可视化。
2.3 鳖血柴胡“清肝退热”作用的内在效应机制分析
2.3.1 药物制备 分别精密称取生柴胡和鳖血柴胡,各加适量蒸馏水浸泡30 min,煎煮提取2次,每次水沸后煎煮5 min,滤过,合并滤液,浓缩至0.1 g/mL,备用。阿司匹林肠溶片粉碎后,用适量蒸馏水充分搅拌溶解成0.02 g/mL的混悬液,备用。
2.3.2 各组大鼠肛温测定 将电子温度计探头上涂抹适量的液体石蜡,探入大鼠肛门测量肛温,2次/d,连续3 d,筛除体温≥38 ℃、温度变化≥0.5 ℃的大鼠。将合格大鼠随机分为对照组、模型组、阿司匹林(0.18 g/kg)组、生柴胡(0.9 g/kg)组及鳖血柴胡(0.9 g/kg)组,每组8只,雌雄各半。各给药组ig相应药物,对照组和模型组ig等体积蒸馏水,1次/d,连续7 d。实验第7天,每间隔0.5 h测定体温1次,取3次平均值作为正常体温,给药30 min后,除对照组外,各组大鼠sc 2,4-二硝基苯酚(28 mg/kg)复制发热模型[16],并在造模后30、60、90、150、180 min分别监测并记录各组大鼠体温,计算每个时间段与正常体温的体温差(∆)。
2.3.3 各组大鼠解热药效学指标测定 体温测试完毕,各组大鼠ip 1 mL 0.5%戊巴比妥钠溶液麻醉,股动脉取血,3000 r/min离心15 min,低温静置15 min后,取上清液,按照ELISA试剂盒说明书测定血清中IL-1β、IL-6、TNF-α水平。
取血后迅速断头取脑,去除小脑及脑干后,称定质量,在冰浴下剥离大鼠下丘脑及脑腹中隔区脑组织,并在冰水浴中制成10%的匀浆,3000 r/min离心15 min,低温静置15 min后,取上清液,按照ELISA试剂盒说明书检测下丘脑中cAMP和脑腹中隔区AVP含量。
取血后迅速分别收集对照组、模型组、生柴胡组、鳖血柴胡组大鼠肝脏组织,暂存于液氮中,之后转移至−80 ℃冰箱保存,用于代谢组学分析。
2.3.4 鳖血柴胡炮制前后解热作用肝脏代谢组学分析
(1)检测方法:Agilent 7890型气相色谱-飞行时间质谱联用仪配有Agilent DB-5MS型毛细管柱(30 m×250 μm,0.25 μm),载气为氦气;进样量1 μL;以Splitless Mode分流;体积流量1.0 mL/min;吹扫体积流量3.0 mL/min;柱箱升温程序为50 ℃保持1 min,以10 ℃/min升至310 ℃,保持8 min;前进样口温度和传输线温度均为280 ℃;离子源温度250 ℃;电离电压−70 eV;扫描范围/50~500,扫描速率12.5 spectra/s;溶剂延迟时间6.25 min。
(2)数据处理:使用Chroma TOF V4.3x软件对质谱数据进行峰提取、基线矫正、解卷积、峰积分、峰对齐等分析,使用LECO-Fiehn Rtx5数据库对物质进行定性(包括质谱匹配及保留时间指数匹配),最后,将质控样本中检出率<50%或RSD>30%的峰去除。
(3)化学模式识别:同“2.2.1(4)”项。
(4)代谢途径和功能分析:将筛选出的差异代谢标志物,导入MetaboAnalyst 5.0(http://www. metaboanalyst.ca/)网站进行代谢途径预测。

3 结果
3.1 鳖血柴胡“清肝退热”作用的物质基础机制分析
3.1.1 鳖血柴胡炮制前后化学成分UHPLC-QTOF/MS分析 共提取5898个峰,经过数据预处理后5893个峰被保留。如图1-A所示,在无监督的PCA得分图中,样本均有明显的聚类趋势。为进一步评价炮制前后成分差异,对生柴胡和鳖血柴胡进行有监督的OPLS-DA分析,正、负离子模式下,2组样本数据均呈现有效区分度,组间存在显著差异。正、负离子模式下分别筛选出48种和52种代谢物,以火山图的形式进行可视化(图1-B),组间层次聚类分析共筛选37个显著差异成分,以热力图进行可视化(图1-C)。柴胡皂苷是柴胡最主要的药效成分,其中《中国药典》2020年版规定柴胡中柴胡皂苷a、柴胡皂苷d总质量分数不少于0.30%。但在本研究中未检测到柴胡皂苷a,可能与其结构不稳定,在提取或放置过程中发生转化有关[17-18]。
3.1.2 鳖血柴胡潜在药效影响成分的解热作用及中医性效相关性分析
(1)鳖血柴胡潜在药效影响成分筛选及其代谢通路预测:本研究侧重探究药效变化趋势,故以ADMET参数预测对药效具有影响的成分。分别将差异成分的Canonical SMILES(线性结构表达式)输入FAFdrugs4数据库,共筛选出20个鳖血柴胡潜在药效影响成分,主要为脂肪酸类和木脂素类,但柴胡皂苷d未通过筛选,可能与其具有一定的肝毒性相关[19],UHPLC-QTOF/MS分析数据见表2。这些成分主要对苯丙氨酸、酪氨酸和色氨酸生物合成、苯丙氨酸代谢等代谢途径具有潜在影响(图2)。
(2)鳖血柴胡潜在药效影响成分与解热作用的生物效应相关性分析:如图3所示,共获取鳖血柴胡潜在药效影响成分的382个靶点及7640个发热的疾病靶点,二者的交集靶点有282个。将282个交集靶点导入Metascape数据库进行生物定位及生物功能信息富集分析,靶点主要定位在肝脏和免疫系统相关组织,与蛋白磷酸化、炎症、免疫、内分泌及激素的生物效应调节相关。将282个交集靶点导入String数据库进行蛋白互作分析,并将结果输入Cytoscape_v3.6.0软件进行网络拓扑分析,以度值、中心度值、接近中心度值为参照,筛选排名前10的靶点作为关键靶点,依次为热休克蛋白90α(heat shock protein 90α,HSP90AA1)、细胞肿瘤抗原p53(cellular tumor antigen p53,TP53)、GTP酶HRAS(GTPase HRas,HRAS)、磷脂酰肌醇4(phosphatidylinositol 4,PIK3CA)、有丝分裂原激活蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、MAPK3、酪氨酸蛋白激酶Lck(tyrosine-protein kinase Lck,LCK)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、酪氨酸蛋白激酶Fyn(tyrosine-protein kinase Fyn,FYN)、Ras相关C3肉毒杆菌毒素底物1(Ras-related C3 botulinum toxin substrate 1,RAC1)。

A-PCA和OPLS-DA分析 B-差异成分分析火山图 C-显著差异成分分析热图,红色表示该物质含量相对高表达,蓝色表示该物质含量相对低表达,9-oxo-10E,12Z,15Z-octadecatrienoic acid和icariside F2(淫羊藿次苷F2)为正、负离子模式下均检测到的成分

表2 鳖血柴胡潜在药效影响成分
淫羊藿次苷F2为正、负离子模式下均检测到的潜在药效影响成分
icariside F2 is detected in both positive and negative ion modes

A-离子流图 B-潜在药效影响成分的代谢途径分析
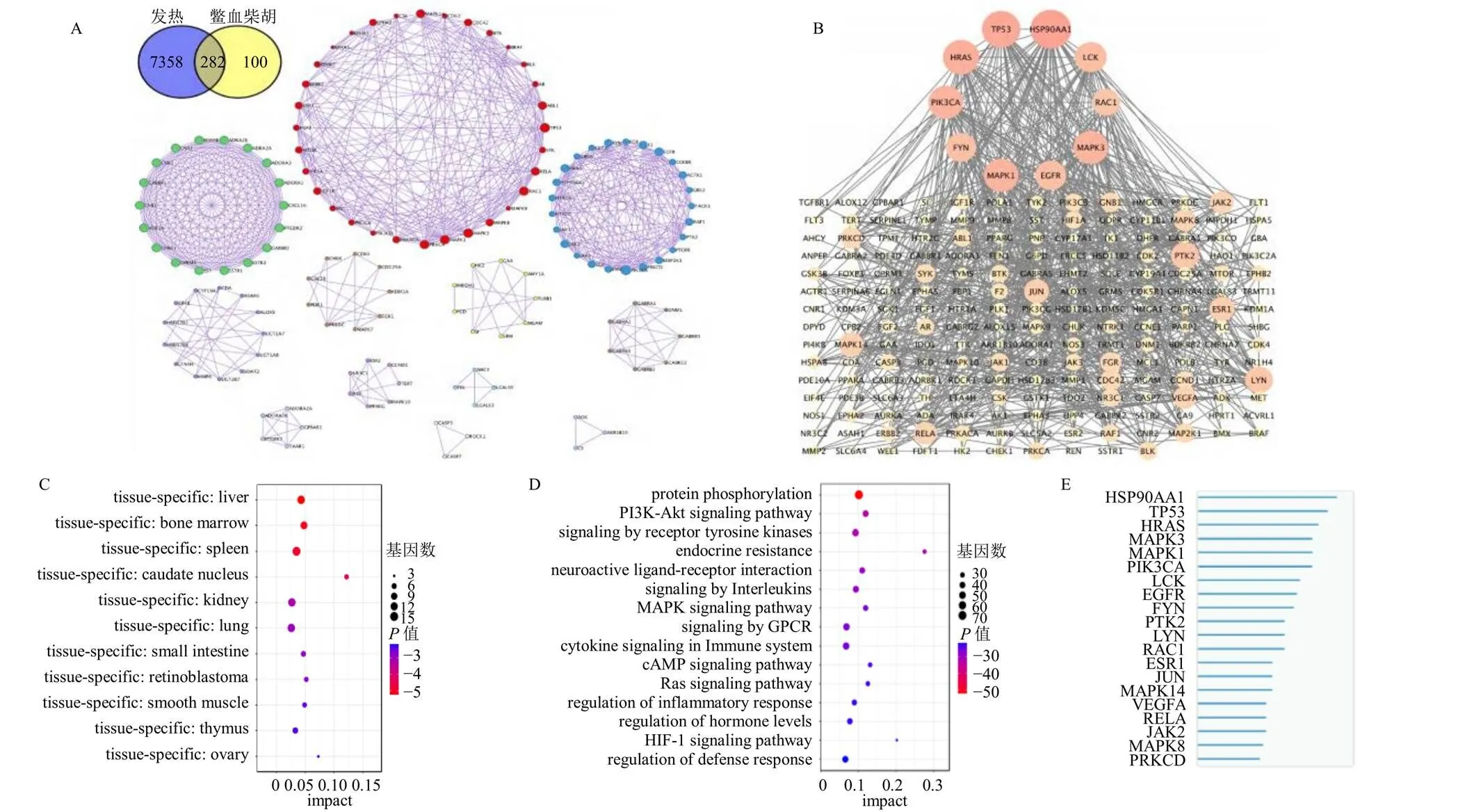
A-鳖血柴胡与发热病症交集靶点的PPI网络图 B-关键靶点的筛选网络图 C-交集靶点生物定位的富集分析 D-交集靶点的生物功能的富集分析 E-关键靶点的排序
(3)鳖血柴胡潜在药效影响成分的解热作用关键靶点的中医证候信息关联分析:将关键靶点输入SymMap数据库检索靶点关联中医证候信息,再导入到Cytoscape_v 3.6.0软件分析预测鳖血柴胡与中医证候的关联属性并可视化,如图4所示,鳖血柴胡潜在药效影响成分的解热作用关键靶点的中医归经显著定位在肝经,与风热、火热、湿热、血热等热证之证候相关性高。
3.2 鳖血柴胡“清肝退热”作用的内在效应机制分析
3.2.1 鳖血柴胡对2,4-二硝基酚所致发热大鼠的解热药效学分析 如图5所示,与模型组比较,生柴胡和鳖血柴胡均能明显降低发热大鼠的体温(<0.05);相较于生柴胡,鳖血柴胡的解热作用相对缓慢,但对持续性高热的作用相对显著。与模型组比较,生柴胡显著降低发热大鼠血清中TNF-α、IL-1β水平(<0.01),降低下丘脑cAMP水平(<0.01);鳖血柴胡能显著降低发热大鼠血清中TNF-α、IL-1β和IL-6水平(<0.01),降低下丘脑cAMP和脑腹中隔区AVP水平(<0.01),鳖血柴胡的效果相对显著。
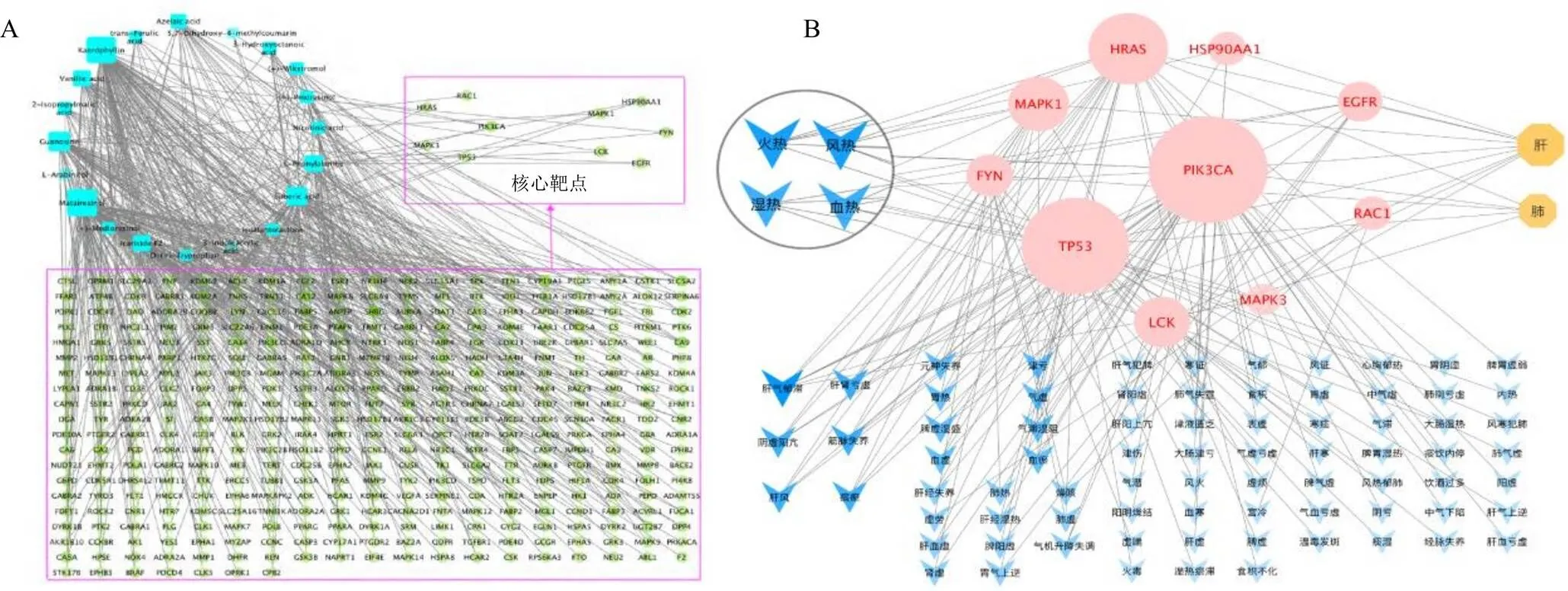
A-“成分-靶点”关联网络 B-关键靶点与中医证候关联网络,红色为靶点,蓝色为中医证候,黄色为归经;颜色越深,图形越大则网络关联度越高

与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01
3.2.2 鳖血柴胡解热作用的肝脏代谢组学分析
(1)各组大鼠肝脏差异代谢物筛选和多元统计分析:以解热药效数据为依据,每组取4只大鼠肝脏组织进行代谢组学分析,并设3个质控组。如图6所示,共提取818个峰,经过数据预处理后781个峰被保留,整体轮廓存在一定的差异。在无监督的PCA得分图中,样本均有明显的聚类趋势,为进一步评价药效差异,对对照组、模型组、生柴胡组、鳖血柴胡组进行有监督的OPLS-DA分析,样本数据均呈现有效区分度,组间存在显著差异。

A-各组大鼠肝脏组织样本的GC-MS总离子流图 B-PCA分析 C-OPLS-DA分析
(2)各组大鼠肝脏组织差异代谢物鉴定及通路分析:采用OPLS-DA模型第一主成分的VIP>1,并结合检验的<0.05来寻找差异代谢物,以火山图的形式进行可视化。进一步将各组差异代谢物按照定量值计算欧式距离矩阵,分别进行组间层次聚类分析,筛选显著差异代谢物,以热图进行可视化。如图7-A所示,模型组与对照组有35个显著差异代谢物,为发热大鼠肝脏生物标志物;生柴胡与模型组有59个显著差异代谢物,其中11个为发热大鼠肝脏生物标志物;鳖血柴胡与模型组有55个显著差异代谢物,其中19个为发热大鼠肝脏生物标志物;生柴胡与鳖血柴胡具有共同回调的9个发热大鼠肝脏生物标志物。
将发热大鼠肝脏代谢生物标志物、生柴胡与鳖血柴胡共同回调9个生物标志物及鳖血柴胡自有10个生物标志物分别导入MetaboAnalyst 5.0网站进行代谢通路分析。如图7-B所示,发热大鼠的肝脏代谢标志物主要涉及嘌呤代谢、丙氨酸、天冬氨酸和谷氨酸代谢、泛酸和辅酶A生物合成、柠檬酸循环等代谢途径,与之相比生柴胡与鳖血柴胡均能影响嘌呤代谢和脂肪酸相关代谢途径发挥解热作用,鳖血柴胡除了影响丙氨酸、天冬氨酸和谷氨酸代谢、泛酸和辅酶A生物合成等代谢途径外,还影响半乳糖代谢、氮代谢、维生素B6代谢达到解热的目的。

A-模型组与对照组差异代谢物火山图 B-生柴胡组与模型组差异代谢物火山图 C-鳖血柴胡组与模型组差异代谢物火山图 D-生柴胡组与鳖血组差异代谢物火山图 E-各组大鼠肝脏代谢标志物热图,浅蓝色框为生柴胡与鳖血柴胡共同具有回调的9个生物标志物,深蓝色框为鳖血柴胡区别于生柴胡显著影响的10个生物标志物 F-模型组影响代谢通路 G-生柴胡与鳖血柴胡共同影响代谢通路 H-鳖血柴胡影响代谢通路
4 讨论
柴胡主入肺、肝经,具有疏散风热之功效,为中医解表退热常用药材[1]。鳖血柴胡是柴胡的一种特殊炮制品,据记载其可增强柴胡清肝退热之效[3]。本研究以代谢组学技术为主要的研究策略,阐释了其中的“物质-效应”变化机制,为其合理推广应用提供科学依据。
首先以中药非靶标代谢组学技术(UHPLC-QTOF-MS)对鳖血柴胡炮制前后内源性代谢产物变化(即化学成分变化)进行鉴定分析。结果显示鳖血柴胡炮制前后的化学成分发生了变化,虽然种类未发现明显差异,但相对定量值存在变化。化学成分是中药药性和药效的物质基础[20],所以用鳖血炮制后柴胡的物质基础的确发生了改变,这将引起药性和药效的变化,于是本研究采用网络药理学方法对此进行预测分析。结合ADMET信息分析共筛选出20个潜在药效影响成分,这些成分主要对苯丙氨酸、酪氨酸和色氨酸生物合成、苯丙氨酸代谢等肝脏代谢途径[21]具有影响。20个潜在药效影响成分与发热病证具有282个交集靶点,生物功能分析显示这些靶点主要定位在肝脏和免疫器官,并与蛋白磷酸化、炎症、内分泌及激素调节等生物效应相关。发热的发病机制是外源性致热原侵入机体,激活巨噬细胞、单核细胞、淋巴细胞等免疫细胞,产生并释放内源性致热原,进而直接或间接通过血-脑脊液屏障作用于体温调节中枢,最终引起发热反应,而内生致热原主要为IL-1β、IL-6及TNF等炎症细胞因子[22]。进一步的“成分-靶点-中医证候”的生物信息关联分析显示,鳖血柴胡生物效应更侧重影响肝经,显著关联风热、火热、湿热、血热等热证,反映与“清肝退热”功效具有证素相关性。由此可见,炮制引起物质基础变化与鳖血柴胡“清肝退热”作用具有潜在的相关性。
其次,通过大鼠解热药效学实验对生柴胡与鳖血柴胡的“清肝退热”作用的效应机制进行对比分析。2,4-二硝基苯酚为代谢刺激剂,可引起实验动物体温显著上升,一方面通过抑制呼吸与阻止二磷酸腺苷的磷酸化,引起发热,另一方面通过刺激巨噬细胞等产生致热细胞因子[16],与鳖血柴胡的解热物质基础机制相符合,因此,本研究以2,4-二硝基苯酚为致热剂复制大鼠发热模型。研究显示柴胡解热作用机制主要与降低血中炎症因子IL-1β、IL-6、TNF-α等的含量和调节下丘脑cAMP及脑腹中隔区AVP的合成分泌有关[23],IL-1β、TNF-α、IL-6是典型的内生性致热原,当机体大量分泌时,进入血液引起发热[24]。IL-6是多种致热原引起发热的重要介质,在体内防御机制和急性期反应中起重要作用,血清中水平可反映组织损伤程度[25]。cAMP是重要的中枢性发热正调节介质,而AVP是一种内源性解热物质,为中枢性发热负调节介质,能显著抑制致热性细胞因子的致热效应[26]。因此,本研究除了体温监测外,还以血清TNF-α、IL-1β、IL-6含量及下丘脑cAMP的含量和脑腹中隔区AVP的含量为解热效应的生化标志物,对药效学进行评价。结果显示,生柴胡与鳖血柴胡均可减低发热大鼠的体温,而鳖血柴胡起效相对缓慢,对持续性高热效果较生柴胡更为显著。生柴胡与鳖血柴胡均可降低发热大鼠血清TNF-α、IL-1β、IL-6含量及下丘脑cAMP的含量和脑腹中隔区AVP的含量,鳖血柴胡的综合效应更为显著。
以物质基础机制分析结果为依据,进一步通过肝脏代谢组学分析探索内在的效应机制。与生柴胡相比较,鳖血柴胡回调的发热大鼠的肝脏代谢标志物种类更多。生柴胡与鳖血柴胡均能通过回调肝脏组织中黄嘌呤、软脂酸、甲基丙二酸、5-(4-羟基丁基)-1-乙内酰脲、-半乳糖醛酸2、α--氨基葡萄糖1-磷酸酯、4-羟基丁酸酯、2-脱氧赤藓糖醇、1-单棕榈酸甘油酯而显著影响嘌呤代谢和脂肪酸代谢。嘌呤的最终代谢产物为尿酸,尿酸盐结晶可使单核细胞释放TNF-α与IL-1β引起血管内皮细胞活化,调节抗炎与促炎平衡[27],炎症可以引起脂质代谢紊乱,而脂质代谢失衡也可诱导炎症的发生[28],说明鳖血柴胡与生柴胡具有相似的解热机制,均能调节炎症反应以解热。发热具有防御和损害双重作用,一定程度的发热可以清除机体内的病原体,然而持续高热会导致机体内糖类、脂肪及蛋白质过度损耗,造成器官组织损伤[29],故而,鳖血柴胡与生柴胡还具有防止发热中脂肪过度损耗而引起肝脏损伤的保护作用。而鳖血柴胡还能显著回调泛酸、单硬脂酸甘油酯、马来酰亚胺、二十四烷酸、吡喃果糖-5-葡糖苷1、谷酰胺1、雄酮1、4-吡啶氧酸、3,6-脱水-半乳糖4、3,6-脱水--半乳糖,又能显著影响丙氨酸、天冬氨酸和谷氨酸代谢、泛酸和辅酶a生物合成、类固醇生物合成、半乳糖代谢、氮素代谢、维生素B6代谢等途径。高热患者蛋白质分解代谢加强,尿素氮明显增高,呈负氮平衡;蛋白质分解加强可为肝脏提供大量游离氨基酸,用于急性期反应蛋白的合成和组织的修复[30]。其中维生素B6别名吡哆醛、吡哆醇,是辅酶的重要组成成分,参与糖、蛋白质、脂肪的正常代谢[31]。以上结果说明,鳖血柴胡还能防止持续高热导致的肝脏糖类及蛋白质过度损耗,而具有更显著的解热及肝脏损伤保护的作用优势。由此可见,炮制引起药效学变化与鳖血柴胡“清肝退热”作用亦存在密切的相关性。
综上所述,鳖血柴胡是柴胡的特色炮制品,但内在炮制机制不明确,对其广泛开发应用造成一定的影响。炮制后化学成分变化所引起性味、功能的改变,是鳖血炮制增强柴胡清肝退热功效的物质基础。鳖血柴胡内在关联生物效应和药理综合效应机制与加强柴胡清肝退热功效的传统炮制意义相符合,本研究对鳖血柴胡的炮制目的的阐明和合理化应用具有一定的指导价值。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 293.
[2] 魏·吴普等述, 清·孙星衍, 孙冯翼辑. 神农本草经 (三卷) [M]. 新1版. 北京: 人民卫生出版社, 1963: 27.
[3] 龚千锋. 中药炮制学 [M]. 第4版. 北京: 中国中医药出版社, 2016: 199-201.
[4] 乔欣, 叶耀辉, 马亚男, 等. 柴胡经鳖血炮制后五种皂苷成分变化规律研究 [J]. 时珍国医国药, 2022, 33(1): 111-114.
[5] 刘鹏. 鳖血柴胡背后的用药地域化与医家争论 [J]. 中药材, 2020, 43(11): 2821-2824.
[6] 吴皓, 李飞. 中药炮制学 [M]. 第2版. 北京: 人民卫生出版社, 2016: 23.
[7] 蔡宝昌, 秦昆明, 吴皓, 等. 中药炮制过程化学机理研究 [J]. 化学进展, 2012, 24(4): 637-649.
[8] 刘晓, 孙戡平, 秦昆明, 等. 基于UHPLC-Q-TOF-MS技术研究炮制对白术芍药散中化学成分的影响 [J]. 中草药, 2022, 53(13): 3920-3928.
[9] 陈文彬, 史毅, 马亚男, 等. 基于UPLC/Q-TOF-MS/MS分析鳖血柴胡皂苷类化学成分 [J]. 现代食品科技, 2019, 35(7): 247-253.
[10] 叶耀辉, 张博文, 郑红梅, 等. 顶空进样GC-MS分析柴胡不同炮制品的挥发性成分 [J]. 中国实验方剂学杂志, 2017, 23(18): 11-14.
[11] 李小宁, 于欢, 龚千锋, 等. 柴胡总多糖提取工艺优化及其不同炮制品中总多糖的含量比较 [J]. 中国实验方剂学杂志, 2016, 22(14): 27-30.
[12] 许枬, 贾天柱, 周翎. 基于组学的中药炮制研究 [J]. 世界科学技术—中医药现代化, 2010, 12(4): 553-557.
[13] Nicholson J K, Lindon J C, Holmes E. Metabonomics: Understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data [J]., 1999, 29(11): 1181-1189.
[14] Johnson C H, Ivanisevic J, Siuzdak G. Metabolomics: Beyond biomarkers and towards mechanisms [J]., 2016, 17(7): 451-459.
[15] 宁艳梅, 杨韬. 鳖血柴胡不同比例炮制品解热镇痛作用的实验研究 [J]. 甘肃中医学院学报, 2014, 31(6): 5-8.
[16] 徐小蓉, 唐进法, 张辉, 等. 青黛对2,4-二硝基苯酚诱导发热大鼠模型的解热活性及潜在机制研究 [J]. 中国中药杂志, 2021, 46(13): 3205-3212.
[17] 陈晶, 傅欣彤, 陈有根, 等. 基于UHPLC-QE Plus-MS/MS法分析柴黄颗粒及柴胡中化学成分 [J]. 中草药, 2022, 53(15): 4634-4644.
[18] 郭智, 彭冰, 李宗阳, 等. UPLC-QTof-MS测定不同提取条件下柴胡皂苷a和柴胡皂苷d的转化规律 [J]. 天然产物研究与开发, 2014, 26(5): 716-720.
[19] 李芝奇, 范琦琦, 陈美琳, 等. 中药肝毒性的物质基础与作用机制研究进展 [J]. 中草药, 2021, 52(13): 4082-4095.
[20] 张廷, 崔瑛, 申玲玲, 等. 中药药性复杂性与药性物质研究的思考 [J]. 中华中医药杂志, 2013, 28(3): 585-587.
[21] Valdivieso F, Gimenez C, Mayor F.inhibition of rat liver phenylalanine hydroxylase by-chlorophenylalanine and esculin. Experimental model of phenylketonuria [J]., 1975, 12(1): 72-78.
[22] Ogoina D. Fever, fever patterns and diseases called fever: A review [J]., 2011, 4(3): 108-124.
[23] 石亮, 张智慧, 李晓宇, 等. 柴胡水提物对大鼠解热作用机制研究 [J]. 中国药物警戒, 2016, 13(9): 513-516.
[24] Lisa R L. Molecular biology of thermo regulation invited reviw: Cytokine regulation of fever: Studies using gene knockout mice [J]., 2002, 92(6): 2648-2655.
[25] Sundgren-Andersson A K, Ostlund P, Bartfai T. IL-6 is essential in TNF-alpha-induced fever [J]., 1998, 275(6): R2028-R2034.
[26] Roth J. Endogenous antipyretics [J]., 2006, 371(1/2): 13-24.
[27] 周慧. KCNQ1在尿酸盐晶体引起单核巨噬细胞分泌IL-1β中的作用研究 [D]. 青岛: 青岛大学, 2017.
[28] van der Veen J N, Kennelly J P, Wan S,. The critical role of phosphatidylcholine and phosphatidylethanolamine metabolism in health and disease [J]., 2017, 1859(9 Pt B): 1558-1572.
[29] 陈升富, 李晓琳, 王维刚, 等. 中药解热作用研究进展 [J]. 中国临床药理学与治疗学, 2022, 27(3): 334-344.
[30] le Floc'h N, Melchior D, Obled C. Modifications of protein and amino acid metabolism during inflammation and immune system activation [J]., 2004, 87(1): 37-45.
[31] Mascolo E, Verni F. Vitamin B6and diabetes: Relationship and molecular mechanisms [J]., 2020, 21: 3669.
“Substance-effect” mechanism ofprocessed with’s blood on “liver-clearing and fever-relieving” based on metabolomics
NING Yan-mei1, 2, REN Yuan1, 2, WU Guo-tai1, 2, WANG Rui-qiong1, 2, DUAN Hai-jing1, 2, ZHANG Jin-bao1, 2, WU Ping-an1, 3, DOU Han-chen1, WANG Rui1
1. Gansu University of Chinese Medicine, Lanzhou 730000, China 2. Gansu Province Key Laboratory of Pharmacology and Toxicology of Traditional Chinese Medicine, Lanzhou 730000, China 3. Key Laboratory of Standard and Quality of Chinese Medicine Research of Gansu Province, Lanzhou 730000, China
To explore the changes of “substance-effect” before and after processing of Chaihu () processed with’s blood for the sake of illustrating the effect of processing on its efficiency of “liver-clearing and fever-relieving” based on metabolomics.Non-target metabolomics and network pharmacology were used to analyze the correlation between changes of material basis and the effect of “liver-clearing and fever-relieving” ofprocessed with’s blood. The antipyretic effect ofprocessed with’s blood was evaluated by 2,4-dinitrophenol-induced fever rats and metabolomics of liver, which in order to interpret the correlation between the pharmacodynamic mechanism and the efficiency of “liver-clearing and fever-relieving” ofprocessed with’s blood.The changes of material basis ofprocessed with’s blood before and after processing were focused on affecting the liver meridian in TCM syndromes, which was related to syndrome elements with wind-heat, fire-heat, damp-heat, blood-heat, therefore corresponding efficiency was “liver-clearing and fever-relieving”. Antipyretic pharmacodynamics showed thatprocessed with’s blood had a similar effect on, and it had a significant effect on the metabolites in a fever, and it had the advantage of liver damage protection.The metabolomic changes of “substance-effect” show that processing can promote the comprehensive effect of “liver-clearing and fever-relieving” ofprocessed with’s blood.
;’s blood; processing; metabolomics; effect; liver-clearing and fever-relieving
R285.5
A
0253 - 2670(2022)24 - 7763 - 11
10.7501/j.issn.0253-2670.2022.24.014
2022-08-05
甘肃省中医药研究中心2019—2020年度开放课题立项(zyzx-2020-19);教育部第二批高校思想政治工作精品项目(教思政司函[2019]2号);第四次全国中药资源普查甘肃省试点工作中医药公共卫生专项(财社[2011]76号)
宁艳梅(1977—),女,博士研究生,副教授,研究方向为中药药理与毒理、中药药性理论与应用。E-mail: Hiningyanmei@qq.com
任 远,教授,博士生导师,从事中药药理与毒理研究。E-mail: Leyuan988@163.com
[责任编辑 李亚楠]

