经典名方固阴煎基准样品HPLC指纹图谱研究
葛 楠,李志能,闫广利,孙 晖,张喜武,李 丹,王喜军*
经典名方固阴煎基准样品HPLC指纹图谱研究
葛 楠1,李志能1,闫广利1,孙 晖1,张喜武1,李 丹2,王喜军1*
1. 黑龙江中医药大学 教育部经典名方有效性评价及产业化开发工程研究中心,黑龙江 哈尔滨 150040 2. 京津冀联创药物研究(北京)有限公司,北京 100025
建立经典名方固阴煎基准样品HPLC指纹图谱,结合多元统计分析对15批固阴煎基准样品进行质量评价,为其基准样品质量控制研究提供参考。采用Waters SymmetryRC18(250 mm×4.6 mm,5 μm)色谱柱,以乙腈-0.1%磷酸水溶液为流动相,梯度洗脱(0~10 min,0~5%乙腈;10~20 min,5%~10%乙腈;20~33 min,10%~11%乙腈;33~42 min,11%~18%乙腈;42~50 min,18%乙腈;50~80 min,18%~40%乙腈;80~100 min,40%~100%乙腈),体积流量1 mL/min,柱温40 ℃,检测波长230 nm,进样体积5 μL,建立固阴煎基准样品HPLC指纹图谱,并进行方法学考察。采用“中药色谱指纹图谱相似度评价系统”(2012版)对15批固阴煎基准样品指纹图谱进行相似度评价,匹配共有峰,并对各共有峰进行归属研究。结合聚类分析、主成分分析(principal component analysis,PCA)与正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)对共有峰结果进行统计学分析,评价不同批次固阴煎基准样品的质量差异,并找寻造成批间质量差异的主要成分及药味来源。固阴煎基准样品HPLC指纹图谱方法学验证良好,15批固阴煎基准样品与对照指纹图谱的相似度均大于0.9。共标定了24个共有峰,经与混合对照品比对,鉴定11个色谱峰,分别为1号峰没食子酸、3号峰5-羟甲基糠醛、6号峰莫诺苷、7号峰绿原酸、9号峰马钱苷、11号峰甘草苷、12号峰金丝桃苷、13号峰毛蕊花糖苷、14号峰3,6′-二芥子酰基蔗糖、22号峰甘草酸、23号峰五味子醇甲。聚类分析和PCA可将15批基准样品分为2类,分析结果可互相印证。OPLS-DA(VIP>1)找到莫诺苷、5-羟甲基糠醛、绿原酸在内的11个差异性色谱峰,分别归属于单味药制远志、炒菟丝子、山茱萸、炙甘草和熟地黄。建立的固阴煎基准样品HPLC指纹图谱专属性强、灵敏度高、分离度好、重复性、稳定性良好,除人参和炒山药以外均有表征,可为其后续制剂开发和质量控制研究提供参考。
经典名方;固阴煎;基准样品;HPLC;指纹图谱;质量控制;聚类分析;主成分分析;正交偏最小二乘-判别分析;没食子酸;5-羟甲基糠醛;莫诺苷;绿原酸;马钱苷;甘草苷;金丝桃苷;毛蕊花糖苷;3,6′-二芥子酰基蔗糖;甘草酸;五味子醇甲;远志;菟丝子;山茱萸;甘草;地黄;人参;山药;五味子
经典名方是指“至今仍广泛应用、疗效确切、具有明显特色与优势的古代中医典籍所记载的方剂”。如何实现经典名方基准样品质量控制技术的突破,以建立起规范、完善的质量标准体系,是经典名方制剂研制面临的关键问题。固阴煎(Guyin Decoction,GYJ)是国家中医药管理局颁布的《古代经典名方目录(第一批)》第64首方剂[1]。首载于张景岳《景岳全书》(公元1624年)卷之五十一德集•新方八阵之固阵篇中,原文记载:“固阴煎:治阴虚滑泄,带浊淋遗,及经水因虚不固等证,此方专主肝肾。人参随宜,熟地三、五钱,山药(炒)二钱,山茱萸一钱半,远志(炒)七分,炙甘草一、二钱,五味十四粒,菟丝子(炒香)二、三钱。水二盅,煎七分,食远温服”[2]。
固阴煎在《景岳全书》中出现11处,主要用于治疗遗精、小便淋浊、崩淋经漏、肾虚经乱;思虑过度,以致遗精滑泄及经脉错乱,病在肝肾不固;有伤冲任之络而恶露不止;元气虚弱而带下,阴虚滑脱所致阴挺;妇人交接,阴户即出血者;若肝肾阴虚不守,脾肾气虚下陷而多带[3]。后世古籍中均采用固阴煎治疗上述病证。现代临床研究表明,固阴煎治疗多囊卵巢综合征[4-5]、更年期综合征[6]、肾虚型月经过少[7]、月经间期出血[8]、功能性子宫出血[9-10]等妇科疾病具有显著疗效。
中药指纹图谱可以科学、系统、全面地反映中药及中药复方的复杂化学成分体系[11],聚类分析、主成分分析(principal component analysis,PCA)与正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)技术可以将多个指标进行分类、整合、降维处理,可应用于对指纹图谱共有峰结果的初步探索[12],二者结合可以更加系统、全面地评价中药材的质量,有助于寻找造成中药复方批间质量差异的主要成分(色谱峰),已被广泛用于经典名方开发研究。目前,经典名方固阴煎的相关研究主要集中于临床应用方面,对其质量控制方面的研究相对较少。因此,本课题对经典名方固阴煎进行HPLC指纹图谱研究,期望为全面控制和评价固阴煎基准样品提供研究依据,为其经典名方复方制剂开发提供参考。
1 仪器与材料
1.1 仪器
Waters2695高效液相色谱仪,2996光电二极管阵列检测器,美国Waters公司;Unique-R202型多功能超纯水系统,厦门锐思捷水纯化技术有限公司;XSE105型Dual Range电子分析天平,瑞士Mettler Toledo公司;KQ-250DB型超声波清洗器,昆山市超声仪器有限公司;Modulyod型冷冻干燥机,美国Thermo公司。
1.2 药品与试剂
对照品没食子酸(批号111730-201916,质量分数98.20%)、5-羟甲基糠醛(批号111626-201912,质量分数99.20%)、莫诺苷(批号111998-201703,质量分数97.4%)、绿原酸(批号110753-201817,质量分数96.8%)、马钱苷(批号111640-201707,质量分数99.2%)、甘草苷(批号111610-201908,质量分数95.0%)、金丝桃苷(批号111521-201809,质量分数94.9%)、毛蕊花糖苷(批号111530- 201914,质量分数95.4%)、3,6′-二芥子酰基蔗糖(批号111848-201805,质量分数96.6%)、甘草酸铵(批号110731-202021,质量分数96.2%)、五味子醇甲(批号110857-201714,质量分数98.4%),均购置于中国食品药品检定研究院。色谱级甲醇、乙腈,Dikma科技有限公司;色谱级磷酸,上海阿拉丁生化科技股份有限公司;分析级甲醇,天津市富宇精细化工有限公司。
制备15批固阴煎基准样品所用的药材均源自道地产地或主产区,由神威药业集团有限公司提供,产地及批号信息详见表1。经黑龙江中医药大学中药鉴定学方向吴修红教授鉴定,地黄为玄参科地黄属植物地黄Libosch.的新鲜或干燥块根,菟丝子为旋花科菟丝子属植物菟丝子Lam.的干燥成熟种子,人参为五加科人参属植物人参C. A. Mey.的干燥根和根茎,山药为薯蓣科薯蓣属植物薯蓣Thunb.的干燥根茎,山茱萸为山茱萸科山茱萸属植物山茱萸Sieb.et Zucc.的干燥成熟果肉,甘草为豆科甘草属植物甘草Fisch.的干燥根和根茎,远志为远志科远志属植物远志Willd.的干燥根,五味子为木兰科五味子属植物五味子(Turcz.) Baill.的干燥成熟果实。依照《中国药典》2020年版地黄和甘草药材项下饮片炮制规范,分别炮制为熟地黄和炙甘草。远志依照《北京市中药饮片炮制规范》(2008年)炮制为制远志,菟丝子依照《山东省中药饮片炮制规范》(2012年)炮制为炒菟丝子,山药依照《天津市中药饮片炮制规范》(2018年)炮制为炒山药。
2 方法与结果
2.1 基准样品的制备
参考国家中医药管理局、国家药品监督管理局制定公布的《古代经典名方关键信息表(7首方剂)》中序号6枇杷清肺饮(《医宗金鉴》清•吴谦)处方、制法及用法的现代对应情况,由于清朝沿袭明朝度量衡,固阴煎出自明朝,所以本研究中1钱暂定为3.73 g,水1盅为现代200 mL,煎7分为煎至1盅的7分,为现代140 mL[13]。固阴煎原文中人参(随宜),参考清代《竹林女科证治》卷二,安胎上记载固阴煎“人参一二钱”[14],韩百灵《百灵妇科》记载固阴煎“人参三钱”[15],故本研究中人参用量为2钱7.46 g;熟地3、5钱,按4钱计算为14.92 g;山药(炒)2钱,为7.46 g;山茱萸1钱半,为5.60 g;远志(炒)7分,1钱的7分为2.61 g;炙甘草1、2钱,按1.5钱计算为5.60 g;五味(14粒),参照《经典名方开发指引》,五味子14粒约为2 g[16],故本研究中暂定五味子用量为2.00 g;菟丝子(炒香)2、3钱,按2.5钱计算为9.33 g;水2盅,煎7分,即固阴煎现代用水量为400 mL,煎至140 mL。根据《医疗机构中药煎药室管理规范》【2009】3号文件第十二条要求“煎药应该使用符合国家卫生标准饮用水”,确定固阴煎煎煮用水为符合国家卫生标准的饮用水[17]。
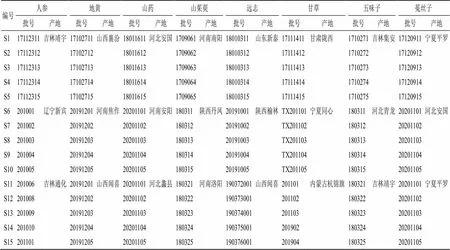
表1 15批固阴煎基准样品(S1~S15)组方药材产地及批号信息
综上所述,固阴煎基准样品制备工艺为取固阴煎日剂量饮片(人参7.46 g、熟地黄14.92 g、炒山药7.46 g、山茱萸5.60 g、制远志2.61 g、炙甘草5.60 g、五味子2.00 g、炒菟丝子9.33 g),置于苏泊尔煎药砂锅中,加水400 mL,浸泡60 min,使用九阳电陶炉武火10 min(1800 W)煮沸后改用文火(400 W)煎煮75 min,药液趁热滤过(120目滤布),约得到140 mL煎液。然后将煎液在低温无水乙醇浴(−60 ℃)中冷冻旋转,使药液均匀布满冻干瓶内壁直至完全成固态后,在−80 ℃保存24 h,采用冷冻干燥机进行冷冻干燥18 h后得到固阴煎基准样品(冻干粉呈黄褐色疏松粉末,气香,味先微甜后转苦)。将固阴煎基准样品使用密封机密封,并置于干燥器中保存待用。
2.2 溶液的制备
2.2.1 供试品溶液 取固阴煎基准样品约1.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇20 mL,称定质量,超声处理30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液过0.45 μm微孔滤膜,即得。
2.2.2 阴性对照液及各单味药对照液 按照“2.1”项下固阴煎基准样品的制备方法,分别制备缺人参、缺熟地黄、缺炒山药、缺山茱萸、缺制远志、缺炙甘草、缺五味子、缺炒菟丝子阴性冻干粉以及各单味药冻干粉。按“2.2.1”项下供试品溶液的制备方法分别制备缺人参、缺熟地黄、缺炒山药、缺山茱萸、缺制远志、缺炙甘草、缺五味子、缺炒菟丝子阴性对照液及各单味药对照液。
2.2.3 混合对照品溶液 精密称取没食子酸、5-羟甲基糠醛、莫诺苷、绿原酸、马钱苷、甘草苷、金丝桃苷、毛蕊花糖苷、3,6′-二芥子酰基蔗糖、甘草酸铵、五味子醇甲,置于11个20 mL量瓶中,分别加甲醇配制成精确质量浓度依次为0.695 2、1.096 4、0.984 5、1.064 6、1.059 5、0.962 5、1.195 5、0.957 0、0.671 5、0.746 0、0.896 0 mg/mL的对照品储备液,分别精密吸取上述对照品储备液的稀释液适量,置于20 mL量瓶中,加甲醇稀释并定容至刻度,摇匀,制得没食子酸、5-羟甲基糠醛、莫诺苷、绿原酸、马钱苷、甘草苷、金丝桃苷、毛蕊花糖苷、3,6′-二芥子酰基蔗糖、甘草酸、五味子醇甲各成分质量浓度分别为6.952、21.928、19.690、21.292、10.595、4.813、5.978、0.957、6.715、7.460、1.792 μg/mL的混合对照品溶液。
2.3 色谱条件
色谱柱为Waters Symmetry®C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液;洗脱方式为线性梯度洗脱:0~10 min,0~5%乙腈;10~20 min,5%~10%乙腈;20~33 min,10%~11%乙腈;33~42 min,11%~18%乙腈;42~50 min,18%乙腈;50~80 min,18%~40%乙腈;80~100 min,40%~100%乙腈;体积流量为1 mL/min;柱温40 ℃;检测波长230 nm;进样体积5 μL。
2.4 方法学考察
2.4.1 稳定性试验 取固阴煎基准样品对应实物1份(S1),按“2.2.1”项下供试品溶液制备方法制备供试品溶液,分别在制备后0、3、6、9、12、18、24 h按“2.3”项下色谱条件进样分析,分别采集HPLC指纹色谱图,以12号峰金丝桃苷为参照峰(s),计算各共有峰的相对保留时间和相对峰面积,结果为各共有峰相对保留时间的RSD均小于0.07%,相对峰面积的RSD均小于4.03%,说明供试品溶液在24 h内稳定。
2.4.2 精密度试验 取固阴煎基准样品对应实物1份(S1),按“2.2.1”项下供试品溶液制备方法制备供试品溶液,按“2.3”项下色谱条件连续进样6次,以12号峰金丝桃苷为参照峰(s),计算各共有峰的相对保留时间和相对峰面积,结果为各共有峰相对保留时间的RSD均小于0.07%,相对峰面积的RSD均小于3.21%,表明仪器精密度良好。
2.4.3 重复性试验 取固阴煎基准样品对应实物适量,按“2.2.1”项下供试品溶液制备方法平行制备6份供试品溶液,按“2.3”项下色谱条件进行测定,以12号峰金丝桃苷峰为参照峰(s),计算各共有峰的相对保留时间和相对峰面积,结果为各共有峰相对保留时间的RSD均小于0.05%,相对峰面积的RSD均小于4.52%,表明该方法重复性较好。
2.5 固阴煎指纹图谱的建立及相似度评价
取15批固阴煎基准样品适量,按“2.2.1”项下方法制备供试品溶液,按“2.3”项下色谱条件测定,记录色谱图。将上述色谱数据结果导入“中药色谱指纹图谱相似度评价系统”软件(2012版),以S1为参照图谱,采用平均数法,时间窗宽度为0.1 min,进行峰多点校正和全峰自动匹配,得到15批样品叠加图及共有模式(对照指纹图谱,R)图(图1-A),共标定了24个共有峰,经与混合对照品(图1-B)的色谱采集结果进行比较分析,同时结合紫外光谱图,可鉴定出其中11个色谱峰,分别为1号峰没食子酸、3号峰5-羟甲基糠醛、6号峰莫诺苷、7号峰绿原酸、9号峰马钱苷、11号峰甘草苷、12号峰金丝桃苷、13号峰毛蕊花糖苷、14号峰3,6′-二芥子酰基蔗糖、22号峰甘草酸、23号峰五味子醇甲。15批基准样品相似度评价结果分别为0.954、0.900、0.904、0.921、0.925、0.986、0.941、0.939、0.986、0.950、0.990、0.953、0.979、0.957、0.953,平均值为0.949,详见表2,说明15批固阴煎基准样品指纹图谱的相似度良好。表明各不同产地、不同批次供试品之间的主要物质群差异较小,制备工艺稳定。

1-没食子酸 3-5-羟甲基糠醛 6-莫诺苷 7-绿原酸 9-马钱苷 11-甘草苷 12-金丝桃苷 13-毛蕊花糖苷 14-3,6′-二芥子酰基蔗糖 22-甘草酸 23-五味子醇甲,图2同

表2 15批GYJ基准样品指纹图谱的相似度评价结果
2.6 共有峰归属
制备缺人参、缺熟地黄、缺炒山药、缺山茱萸、缺制远志、缺炙甘草、缺五味子、缺炒菟丝子阴性对照液及各单味药对照液,按“2.3”项下色谱条件测定,记录色谱图。结合各色谱峰的保留时间及紫外吸收图,通过对比分析,对24个共有峰进行归属研究,色谱图对比结果如图2所示:3号峰(5-羟甲基糠醛)、13号峰(毛蕊花糖苷)来自熟地黄;1号峰(没食子酸)、2号峰、3号峰(5-羟甲基糠醛)、4号峰、6号峰(莫诺苷)、8号峰、9号峰(马钱苷)来自山茱萸;5号峰、8号峰、10号峰、11号峰(甘草苷)、14号峰(3,6′-二芥子酰基蔗糖)、18号峰、19号峰、20号峰、21号峰来自制远志;7号峰(绿原酸)、10号峰、12号峰(金丝桃苷)、16号峰、17号峰来自炒菟丝子;5号峰、10号峰、11号峰(甘草苷)、15号峰、22号峰(甘草酸)、24号峰来自炙甘草;23号峰(五味子醇甲)来自五味子。其中3号峰(5-羟甲基糠醛)在熟地黄和山茱萸单味药中均存在,所以固阴煎基准样品中5-羟甲基糠醛有以上2个药味来源。11号峰甘草苷除了在炙甘草单味药中具有明显色谱峰,在制远志单味药中也有响应,是因为制远志炮制过程中以甘草水煎液为辅料。由于炒山药中主要含有多糖类、核苷类、氨基酸类、环肽类、脂肪酸类化合物[18],同时人参中主要皂苷类成分为紫外末端吸收,所以在本实验条件下,无共有峰归属于炒山药和人参。后续计划进一步开发关于固阴煎基准样品中人参皂苷类成分和山药中特有成分的特征指纹图谱,以便建立更完善的固阴煎质量标准评价体系。
2.7 聚类热图分析
以15批固阴煎物质基准的24个共有峰的峰面积为变量,将数据结果导入Metware Cloud在线数据分析平台(https://cloud.metware.cn/#/tools/tool-list)进行高级聚类分析,结果如图3所示。从纵向分析,各批次聚类结果为S1~S5被归为一类,S6~S15被归为一类。分析原因可能由于药材产地不同导致固阴煎样品中各成分的含量具有一定的差异(S1~S5、S6~S10、S11~S15,每5批药材来自同一产地)。从横向聚类结果分析,发现11、21、13、22、7、10、12号峰被归为一类(1类);2、9、8、14、17号峰被归为一类(2类);1、5、6、15、19、3、18、16、20、4、23、24号峰被分为一类(3类)。与峰归属结果对比分析,发现归属菟丝子的7、10、12号色谱峰被归为一类(1类);归属山茱萸的2、8、9号色谱峰被归为一类(2类);归属山茱萸的1、3、4、6号色谱峰被归为一类(3类);归属炙甘草的5、15、24号色谱峰被归为一类(3类);归属制远志的5、18~20号色谱峰被归为一类(3类);归属炙甘草的11、22号峰和归属制远志的11、21号峰归为一类(1类),可以发现聚类分析结果与峰归属结果具有一定的相关性,可以互相印证。从整体热图角度分析,将不同批次的峰面积进行标准化处理并以热图的形式展示,颜色越深代表相对含量越高,可以发现1类色谱峰(11、21、13、22、7、10、12号峰)在S6~S10批次中含量较高,2类色谱峰(2、9、8、14、17号峰)在S1~S5和S6~S10批次中含量相对较高,3类色谱峰(1、5、6、15、19、3、18、16、20、4、23、24号峰)在S1~S5批次中含量较高。综合分析,说明各产地药材质量优劣顺序为S1~S5>S6~S10>S11~S15。
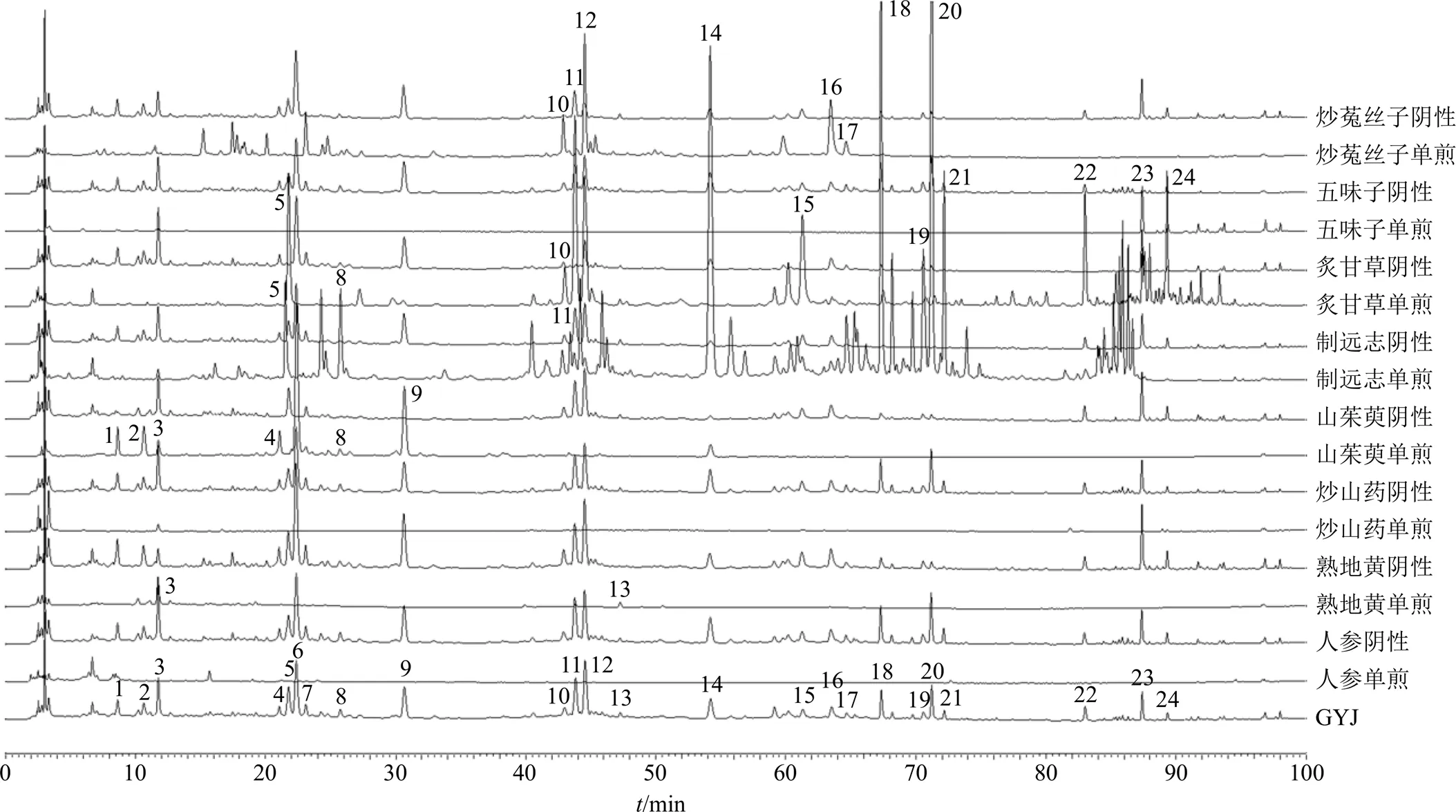
图2 固阴煎基准样品指纹图谱共有峰归属色谱图

图3 15批固阴煎基准样品指纹图谱共有峰聚类热图分析
2.8 PCA
以15批固阴煎物质基准的24个共有峰的峰面积为变量,将数据结果导入Metware Cloud在线数据分析平台(https://cloud.metware.cn/#/tools/tool-list)进行高级PCA,结果如图4-A所示,S1~S5聚集在一起,S6~S15聚集在一起,发现PCA结果与聚类分析结果一致。
2.9 OPLS-DA
以15批固阴煎物质基准的24个共有峰的峰面积为变量,将数据结果导入Metware Cloud在线数据分析平台(https://cloud.metware.cn/#/tools/tool-list)进行高级OPLS-DA,结果如图4-B、C所示,以变量投影重要性(variable importance for the projection,VIP)值>1为判定标准,筛选差异组分色谱峰包括峰20、16、18、19、2、15、3(5-羟甲基糠醛)、6(莫诺苷)、7(绿原酸)、5、17。
与峰归属结果对比分析发现,峰20、18、19来源于制远志;峰16、7(绿原酸)、17来源于炒菟丝子;峰2、6(莫诺苷)来源于山茱萸;峰15、5来源于炙甘草;峰3(5-羟甲基糠醛)来源于熟地黄。说明以上5味药材是影响不同批次、组别样品质量差异性的重要来源,所以如果想更好的控制固阴煎基准样品的稳定性,应在药材源头进行质量稳定性控制并重点关注上述药材。
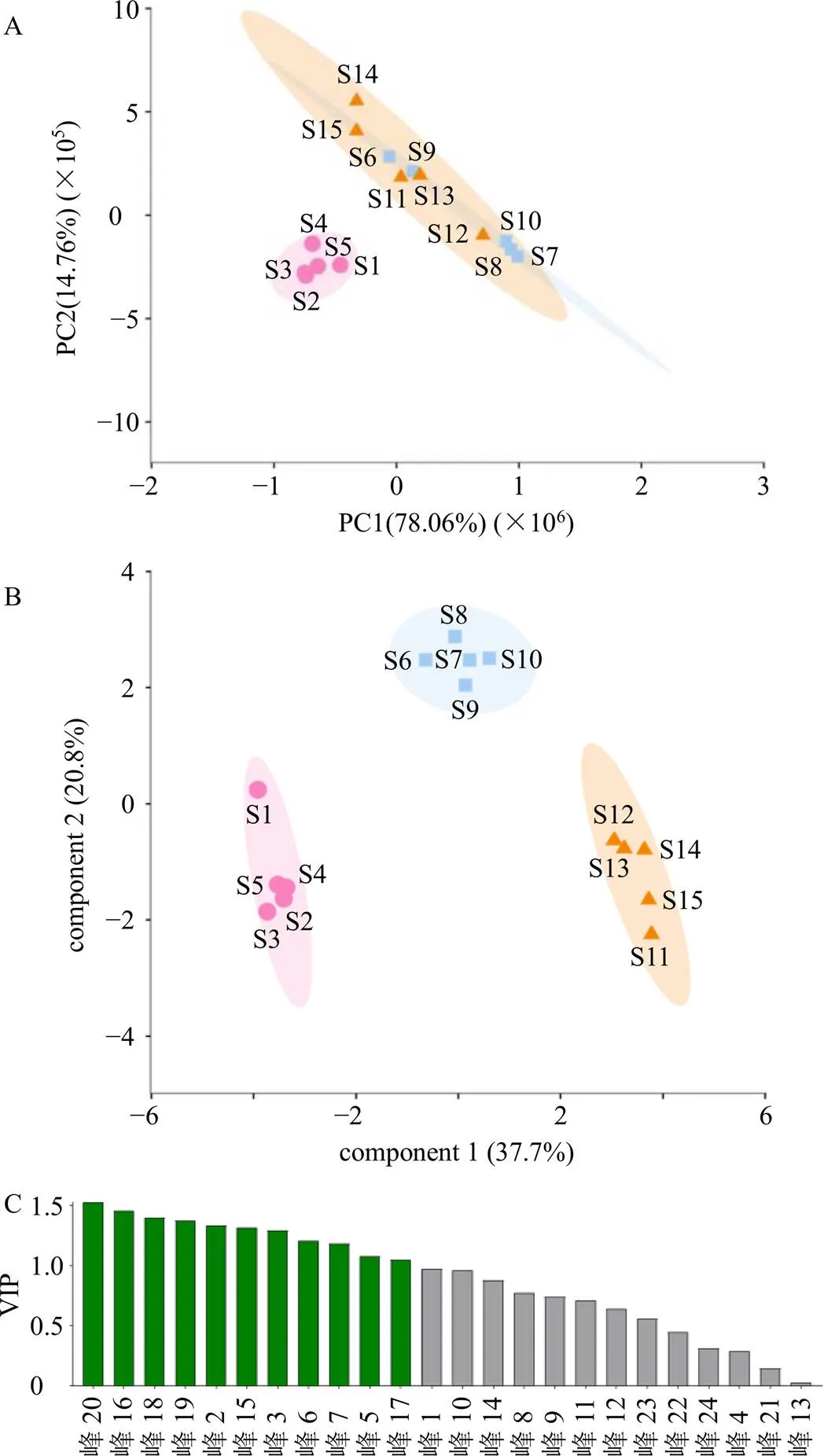
A-PCA得分图 B-OPLS-DA得分矩阵 C-VIP值
3 讨论
固阴煎由人参、熟地黄、炒山药、山茱萸、制远志、炙甘草、五味子、炒菟丝子8味中药组成,基准样品成分复杂,为了尽可能全面地分析其所含的化学成分,本研究对供试品溶液制备方法和色谱条件进行了考察。
供试品溶液的制备,首先考差了提取方法及提取时间,包括超声15、30、45、60 min和回流30、60、90 min,比较各共有峰在不同提取条件下的峰面积,结果发现超声提取30 min即可达到有效成分的充分提取,且操作相对简便。同时进行了提取溶剂考察,包括25%、50%、75%、100%甲醇,比较各色谱图结果,发现采用100%甲醇提取时,色谱图基线更平稳。
固定提取溶剂体积(20 mL),考察不同取样量0.50、1.00、2.00 g,确定最佳供试品溶液浓度,比较各共有峰单位浓度峰面积及峰强度,结果发现最适取样量为1.00 g。色谱条件考察,首先将供试品溶液经紫外全波长(200~400 nm)扫描,比较发现检测波长为230 nm时,能获得较多的指纹峰且各峰强度适中,基线也相对稳定,所以选择230 nm作为固阴煎基准样品指纹图谱检测波长。
流动相组成分别考察了乙腈-0.05%磷酸水溶液、乙腈-0.10%磷酸水溶液、乙腈-0.15%磷酸水溶液,发现乙腈-0.10%磷酸水溶液色谱图分离度更好,基线更平稳。色谱柱考察分别对比了3个不同生产厂家的色谱柱Symmetry®C18(250 mm×4.6 mm,5 μm;Waters)、Capcell Pak C18(250 mm×4.6 mm,5 μm;Shiseido)、Diamonsil C18(200 mm×4.6 mm,5 μm;Dikma),发现Waters Symmetry®C18色谱柱分离效果最好。并重点考察了梯度洗脱程序,尽可能使色谱峰分离度更好,分布更均匀,色谱峰数量更多,采集时间更短。
同时对柱温(30、35、40 ℃)和进样量(2.5、5、10 μL)进行了考察,发现柱温为40 ℃各峰分离情况更好,进样体积为5 μL时,色谱图基线更平稳。通过以上研究,确立了固阴煎基准样品HPLC指纹图谱的分析方法。
固阴煎基准样品HPLC指纹图谱方法学验证良好,精密度、重复性和稳定性试验RSD值均小于4.52%。15批固阴煎基准样品与对照指纹图谱的相似度均大于0.9,说明各不同产地、不同批次供试品之间的主要物质群差异较小,制备工艺稳定。基于“中药色谱指纹图谱相似度评价系统”(2012版)生成对照指纹图谱,共标定了24个共有峰,经与混合标准品比对,鉴定了其中11个色谱峰。
共有峰归属研究发现,基准样品中5-羟甲基糠醛有2个药味来源,分别为熟地黄和山茱萸。由于炒山药和人参中所含成分的特殊性,在本实验条件下,未检测到明显的特征峰。后续计划进一步开发关于固阴煎基准样品中人参皂苷类成分和山药中特有成分的特征指纹图谱,以便建立更完善的固阴煎质量标准评价体系。聚类分析和PCA可将15批基准样品分为2类,两者可互相印证。分析原因可能由于药材产地不同导致固阴煎样品中各成分的含量具有一定的差异,同时发现各色谱峰的聚类分析结果与峰归属结果具有一定的相关性。
从整体热图角度分析,发现各产地药材质量优劣顺序为S1~S5>S6~S10>S11~S15。但由于指纹图谱中未能体现人参和炒山药相关色谱峰,所以该质量分析结果不适用于评价人参和山药的药材质量。OPLS-DA(VIP>1)找到莫诺苷、5-羟甲基糠醛、绿原酸在内的11个差异性色谱峰,分别归属于单味药制远志、炒菟丝子、山茱萸、炙甘草和熟地黄。顾和亚等[19]在芪葵缓释片中活性成分在兔血浆中的药动学研究发现莫诺苷、马钱苷、金丝桃苷的相对生物利用度相对于芪葵颗粒分别为169.1%、213.3%、169.3%,均大于100%,李娴[20]在六味地黄丸中成分在健康大鼠和肾阴虚大鼠体内药动学研究中同样监测了血浆中马钱苷、莫诺苷的浓度变化,郑东昆等[21]基于UHPLC-MS/MS测定了大鼠血浆中毛蕊花糖苷的药动学特征,张磊等[22]在基于临床疗效的注射用益气复脉(冻干)质量标志物确证中将五味子醇甲做为益气复脉可能的质量标志物,以上均说明上述成分在体内具有较好的吸收与代谢,且可能与疗效相关。
固阴煎功效为补肝肾,滋阴血,主治肝肾两亏证,上述成分在本研究中也得到了表征,提示上述成分可能是固阴煎发挥临床疗效相关的药效成分,但仍需进一步实验验证。同样,如果想更好地控制基准样品的质量,在重点关注药材源头外,还应寻找方剂发挥临床疗效的药效物质基础,有针对性的对方剂的质量标志物进行控制,才能更好地保证制剂的稳定可靠。
综上,本研究建立的固阴煎基准样品HPLC指纹图谱专属性强、灵敏度高、分离度好、重复性、稳定性良好,为固阴煎基准样品的质量控制提供了新的借鉴,对固阴煎的进一步利用和开发提供了数据参考,也为其后续制剂开发提供了研究基础。但由于在本实验条件下,来源于人参和炒山药中的化学成分未能充分表征,后续会继续开展相关实验研究,尝试建立人参和山药的特征指纹图谱,以期为固阴煎建立全面可靠的质量标准体系,进一步促进其经典名方开发研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家中医药管理局. 国家中医药管理局关于发布《古代经典名方目录(第一批)》的通知[EB/OL]. [2018-04-16]. http://kjs.satcm.gov.cn/zhengcewenjian/2018-04-16/ 7107.html.
[2] 李志能, 张宁, 葛楠, 等. 经典名方固阴煎古代文献考证与分析 [J]. 中国药房, 2021, 32(20): 2556-2560.
[3] 明·张介宾. 景岳全书 [M]. 北京: 中国中医药出版社, 1994: 690.
[4] 万凌屹, 黄佳梅, 刘莉, 等. 基于阴阳学说应用《景岳全书》固阴煎治疗多囊卵巢综合征排卵障碍 [J]. 浙江中西医结合杂志, 2020, 30(4): 336-337.
[5] 刘颖群, 周莹, 张小翠, 等. 固阴煎加减对育龄期卵巢低反应肾阴虚型患者卵巢储备功能的影响 [J]. 中国实验方剂学杂志, 2019, 25(10): 87-92.
[6] 朱也君. 固阴煎加减治疗更年期综合征38例 [J]. 新中医, 2009, 41(9): 72-73.
[7] 洪丽美. 固阴煎加减治疗肾虚型月经过少的临床效果分析 [J]. 医学理论与实践, 2019, 32(8): 1207-1209.
[8] 朱文燕, 吕美. 加味固阴煎治疗经间期出血47例 [J]. 山东中医杂志, 2011, 30(8): 552.
[9] 章轶立. 中医药治疗功能性子宫出血 [J]. 长春中医药大学学报, 2012, 28(5): 841-843.
[10] 王颖, 刘瑶. 功能性子宫出血的临床探索和分析 [J]. 中国医药指南, 2017, 15(17): 67.
[11] 张涛, 张青, 易海燕, 等. 基于指纹图谱结合化学计量法对何首乌不同炮制品多指标成分分析 [J]. 中草药, 2022, 53(15): 4653-4662.
[12] 孙立丽, 王萌, 任晓亮. 化学模式识别方法在中药质量控制研究中的应用进展 [J]. 中草药, 2017, 48(20): 4339-4345.
[13] 国家中医药管理局. 关于发布《古代经典名方关键信息考证原则》《古代经典名方关键信息表(7首方剂) 》的通知[EB/OL]. [2020-11-10]. http://kjs.satcm.gov. cn/zhengcewenjian/2020-11-10/18132.html.
[14] 清·叶桂. 叶氏女科证治 [M]. 施仁潮等校注. 北京: 中国中医药出版社, 2015: 31.
[15] 韩百灵. 百灵妇科 [M]. 哈尔滨: 黑龙江人民出版社, 1980: 61.
[16] 陈士林, 刘安. 经典名方开发指引 [M]. 北京: 科学出版社, 2020: 593-597.
[17] 国家中医药管理局, 卫生部. 国家中医药管理局、卫生部关于印发医疗机构中药煎药室管理规范的通知(国中医药发〔2009〕3号) [J]. 中华人民共和国卫生部公报, 2009(6): 29-31.
[18] 陈梦雨, 刘伟, 侴桂新, 等. 山药化学成分与药理活性研究进展 [J]. 中医药学报, 2020, 48(2): 62-66.
[19] 顾和亚, 江静怡, 周洪亮,等. 芪葵缓释片中6种活性成分在兔血浆中的药动学研究 [J]. 中草药, 2019, 50(12): 2891-2898.
[20] 李娴. 六味地黄丸中成分在健康大鼠和肾阴虚大鼠体内药动学研究 [D]. 济南: 山东大学, 2010.
[21] 郑东昆, 陈伟康, 马双成, 等. UHPLC-MS/MS同时测定大鼠血浆中裸花紫珠3个酚苷类成分及其药动学研究 [J]. 中草药, 2015, 46(23): 3533-3538.
[22] 张磊, 苏小琴, 李德坤, 等. 基于临床疗效的注射用益气复脉(冻干) 质量标志物确证 [J]. 中草药, 2021, 52(18): 5741-5750.
HPLC fingerprinting study of classical formula Guyin Decoction
GE Nan1, LI Zhi-neng1, YAN Guang-li1, SUN Hui1, ZHANG Xi-wu1, LI Dan2, WANG Xi-jun1
1. Heilongjiang University of Chinese Medicine, Engineering Research Center for Effectiveness Evaluation and Industrialization Development of Classic Prescription, Harbin 150040, China 2. Beijing-Tianjin-Hebei Lianchuang Drug Research (Beijing) Co., Ltd., Beijing 100025, China
To establish HPLC fingerprints of the benchmark samples of the classical formula Guyin Decoction (GYJ) and to analyze and evaluate 15 batches of the benchmark samples by combining multivariate statistical analysis, so as to provide reference for the development of its benchmark samples.A Waters SymmetryRC18(250 mm × 4.6 mm, 5 μm) column was used with acetonitrile (A) and 0.1% phosphoric acid aqueous solution (B) as the mobile phase and gradient elution (0—10 min, 0—5% A; 10—20 min, 5%—10% A; 20—33 min, 10%—11% A; 33—42 min, 11%—18% A; 42—50 min, 18% A; 50—80 min, 18%—40% A; 80—100 min, 40%—100% A) at a flow rate of 1 mL/min, column temperature of 40 ℃, detection wavelength of 230 nm, injection volume of 5 μL, to establish the HPLC fingerprints of the GYJ benchmark samples and conduct methodological investigation. The fingerprints of the 15 batches of GYJ samples were evaluated by using the “Similarity Evaluation System for Chromatographic Fingerprints of Traditional Chinese Medicine” (2012 version) to match the shared peaks, and the attribution of the shared peaks was studied. The results were combined with cluster analysis, principal component analysis (PCA) and orthogonal partial least squares-discriminant analysis (OPLS-DA) to evaluate the quality differences among the batches of GYJ benchmark samples and to find the main components and source flavors that caused the quality differences between batches.The methodological validation of the HPLC fingerprints of the benchmark samples of GYJ was good, and the similarity between the fingerprints of the 15 batches of the benchmark samples and the control was greater than 0.9. A total of 24 shared peaks were found, and 11 peaks were identified by comparison with the mixed standards, namely, gallic acid (peak 1), 5-hydroxymethylfurfural (peak 3), morroniside (peak 6), chlorogenic acid (peak 7), loganin (peak 9), liquiritin (peak 11), hyperoside (peak 12), verascoside (peak 13), 3,6′-disinapoylsucrose (peak 14), glycyrrhizic acid (peak 22), schisandrin (peak 23). Cluster analysis and PCA analysis could classify the 15 batches of benchmark samples into two categories, and the results could be corroborated with each other. OPLS-DA (VIP > 1) excavated 11 differential peaks including morroniside, 5-hydroxymethylfurfural, and chlorogenic acid, which were derived from Yuanzhi (etdecoction processed), fried Tusizi (), Shanzhuyu (), Zhigancao (etcum) and Shudihuang (), respectively.The established HPLC fingerprints of the benchmark samples of GYJ are highly specific, sensitive, well separated, reproducible and stable, and were characterized except foretand fried, which can provide reference for its subsequent formulation development and quality control studies.
classical formula; Guyin Decoction; benchmark sample; fingerprinting; quality control; cluster analysis; principal component analysis; orthogonal partial least squares-discriminant analysis; gallic acid; 5-hydroxymethylfurfural; morroniside; chlorogenic acid; loganin; liquiritin; hyperoside; verascoside; 3',6-Disinapoylsucrose; glycyrrhizic acid; schisandrin;;;;et;;et;
R283.6
A
0253 - 2670(2022)24 - 7730 - 10
10.7501/j.issn.0253-2670.2022.24.011
2022-07-07
河北省自然科学基金资助项目(H2022106061);黑龙江省重点研发计划指导类(GZ20210125);经典名方《固阴煎》颗粒剂的开发研究(2017SW-KF058)
葛 楠,博士研究生,主要从事中药药效物质基础与质量控制研究。E-mail: 976077771@qq.com
王喜军,教授,博士生导师,主要从事中药血清药物化学及中医方证代谢组学研究。E-mail: xijunw@sina.com
[责任编辑 郑礼胜]

