桃花型性状dCAPs标记的开发与应用
高帆, 冯贝贝, 宋聪豪, 连晓东, 郑先波, 张海朋, 王小贝, 谭彬, 冯建灿
(河南农业大学园艺学院,河南 郑州 450002)
桃(Prunuspersica)属于蔷薇科李属桃亚属,起源于中国西北地区,种质资源丰富。桃在亚洲,尤其是在中国,不仅是重要的果树作物,也是一种重要的观花树种[1]。很多地方通过举办“桃花节”等也带动了当地第三产业的发展。
栽培桃花型分为铃型(non-showy,SH)和蔷薇型(showy,sh)2种类型。蔷薇型花朵大、花冠大,色彩鲜艳,易吸引蜜蜂和其他昆虫,有利于传粉。马瑞娟等[2]对507个栽培桃资源花型进行调查分析,发现铃型花资源79个,占15.6%,蔷薇型花资源428个,占84.4%,说明栽培桃品种以蔷薇型花为主。桃花型性状受一对等位基因控制(SH/sh),其中铃型(SH)对蔷薇型(sh)为显性[3]。CHAPARRO等[4]通过9个F2分离群体对桃花型性状的遗传规律进行分析,F2后代中铃型花与蔷薇型花的分离比为3∶1,符合孟德尔遗传规律,为质量性状。FAN等[5]将该性状作为一个形态学标记锁定在桃第8号连锁群上,位于标记CPPT006与PacC13之间。MICHELETTI等[6]对1 580份桃种质资源进行GWAS分析,发现位于第8号连锁群上有18个SNP标记与花型性状紧密相关,范围为4.3 Mb。随后CAO等[7]利用GWAS分析发现位于第8号连锁群13 740 117 bp处存在一个与花型性状关联度较高的SNP位点。河南农业大学桃生物学与种质创新团队基于重测序数据对‘黄水蜜’(sh)和‘中油桃14号’(SH)F1杂交群体后代进行GWAS分析,发现位于8号染色体上的PpB3-1基因启动子区域的1个SNP关联度最高,并通过测序发现该SNP位点与花型性状共分离,且PpB3-1基因在不同花型的花瓣中差异表达,将PpB3-1基因确定为桃花型性状候选基因[8]。
衍生酶切扩增多态性(derived cleaved amplified polymorphic sequence,dCAPs)标记是针对酶切扩增多态性(cleaved amplified polymorphic sequence,CAPs)标记的一种改良法[9],CAPs标记检测限制于突变位点发生在限制性内切酶的识别位点上,而实际上有很大一部分突变位点并非发生在酶切识别位点处。通过在突变位点附近引入错配碱基而衍生出dCAPs标记,该标记具有共显性、位点特异、操作简单和成本低等优点,在品种分类和分子标记辅助育种中得到了广泛的应用。如基于小麦AL型三系杂交小麦雄性不育性状开发的dCAPs标记,可以检测含有不育基因的材料[10]。基于茄果皮着色光敏性基因候选区段内SNP设计开发dCAPs-9标记表现较高的特异性,杂交群体和自然群体的准确度分别达到了98.4%和91.9%[11]。
本研究依托河南农业大学桃生物学与种质创新团队前期成果,对已获得的控制桃花型性状PpB-1基因的差异SNP位点开发相应的dCAPs标记,在桃杂交群体和自然群体中进行鉴定,分析了桃花型性状dCAPs标记与桃花型的相关性,为针对花型性状的分子标记早期辅助选择及提高选择效率提供理论依据。
1 材料与方法
1.1 材料
本试验所用112份桃自然群体试验材料来源于河南农业大学毛庄科教园区和中国农业科学院郑州果树研究所。构建杂交群体所使用的母本‘黄水蜜’(sh)、父本‘中油桃14号’(SH)和73株F1杂种单株均保存于河南农业大学三区桃种质资源圃。
1.2 方法
1.2.1 基因组DNA提取 采用一步法植物基因组DNA提取试剂盒(购于北京诺贝莱生物科技有限公司)提取桃叶片基因组DNA,具体步骤如下:取80~100 mg桃叶片在液氮中充分研磨,倒入装有600 μL Buffer ATS 的离心管中混匀,加入10 μL RNase A(25 mg·mL-1)震荡混匀,静置10 min,其间颠倒混匀3次,12 000 r·min-1离心3 min;取500 μL上清液,并加入250 μL异丙醇,充分混匀后转入吸附柱(spin columns AC)中,12 000 r·min-1离心1 min,弃废液;向吸附柱AC中加入600 μL Buffer WB进行洗脱,12 000 r·min-1离心1 min,倒掉废液,重复洗脱1次;将吸附柱AC放回空收集管,12 000 r·min-1离心2 min,将吸附柱AC放入新离心管,向吸附膜中央悬空滴加60 μL Buffer EB,室温放置5 min,12 000 r·min-1离心1 min,收集DNA溶液。-20 ℃保存DNA。使用质量分数1%的琼脂糖凝胶电泳对提取的DNA样品的完整性进行检测,使用NanoDrop 2000C spectrophotometer(Thermo Scientific)检测DNA的质量浓度,将DNA样品稀释到50~100 mg·L-1待用。
1.2.2 引物设计 依据‘中油桃14号’基因组序列(http://www.stylebio.cn/),下载PpB3-1(Pp08G015510)基因上游包含SNP位点的启动子序列(500 bp),设计SNP位点的正向引物为SNP-SH-F:5’-TTCTTTATCATCTCTCGGAATCAGT-3’,反向引物为SNP-SH-R:5’-CGTTTGTCGGGAGGGGG-3’。根据SNP位点处的基因序列,利用在线软件dCAPS Finder 2.0 (http://helix.wustl.edu/dCAPs/dCAPs.html)设计上游引物,Primer Premier 5.0软件设计下游引物,送至郑州尚亚国际贸易有限公司进行引物合成。
1.2.3 PCR扩增及产物纯化 PCR 反应采用50 μL的扩增反应体系:25 μL 2×Taq Master Mix(购于南京诺唯赞生物科技股份有限公司),2.5 μL正向引物,2.5 μL反向引物(正、反向引物浓度为10 μmol·L-1),2.5 μL DNA模板,17.5 μL ddH2O。具体反应条件为:95 ℃预变性5 min,1个循环;95 ℃变性30 s,58 ℃退火 30 s,72 ℃延伸20 s,35个循环;72 ℃充分延伸7 min,4 ℃保存。使用微柱浓缩DNA凝胶回收试剂盒(购于北京庄盟国际生物基因科技有限公司)进行PCR产物纯化。
1.2.4 酶切体系及酶切产物检测 采用25 μL的酶切反应体系:2.5 μL CutSmart,0.5 μLSalI-HF限制性内切酶,1 μg PCR纯化产物,补足ddH2O至25 μL(SalI-HF限制性内切酶购于NEB公司)。采用水浴的方式进行酶切,37 ℃酶切5 h。对酶切产物稀释1倍后使用聚丙烯酰胺凝胶电泳的方式进行检测[12]。
2 结果与分析
2.1 桃花型性状PpB3-1基因dCAPs标记的开发及验证
桃PpB3-1基因的SNP位点处A/C等位基因的变异导致桃花型的改变,基因型A/C和C/C为铃型花(图1-A),基因型A/A为蔷薇型花(图1-B)。由于PpB3-1基因SNP位点没有位于限制性内切酶的酶切位点,根据SNP位点处碱基的差异,在特异性扩增引物F端引入可以使用SalI-HF限制性内切酶进行酶切的错配碱基G,得到用于dCAPs标记PpB3-1标记开发的正向引物为B3-1-F:5’-ATATACGTGTACAATAGATAGTCGA-3’,反向引物为B3-1-R:5’-ATACTTTCCTATGATCGTAGTTTCT-3’(图1-C)。
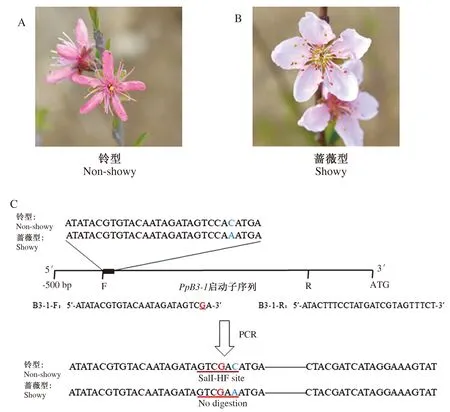
蓝色字母C,A表示SNP位点;红色字母G表示错配碱基。
对10份已知花表型的桃种质资源PpB3-1基因SNP位点进行测序,PpB3-1基因SNP位点出现3种变异类型(表1,图2-A)。使用PpB3-1基因开发的dCAPs标记对这10份桃种质资源进行PCR扩增,得到308 bp的PCR产物(图2-B)。理论上,蔷薇型花(基因型,A/A)DNA扩增出来的条带无酶切位点,不能被切开,条带长度为 308 bp;铃型花(基因型,A/C,C/C)DNA扩增出来的条带有酶切位点,可被SalI-HF限制性内切酶切成26 和282 bp。对dCAPs标记验证结果显示(图2-C),共产生3种类型条带:308、282+308和282 bp,而26 bp的条带较小在胶上不可见。上述结果与这10份桃种质资源花型的田间调查和SNP测序结果一致(表1),表明基于PpB3-1基因开发的dCAPs标记可准确地鉴定出10份桃种质资源的花型。
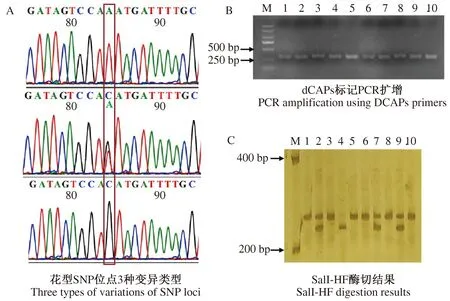
M:DNA Marker;1:春美;2:秋蜜红;3:松森;4:中油蟠2;5:大久保;6:黄水蜜;7:瑞光28;8:春蕾;9:乳玉;10:佩加苏。
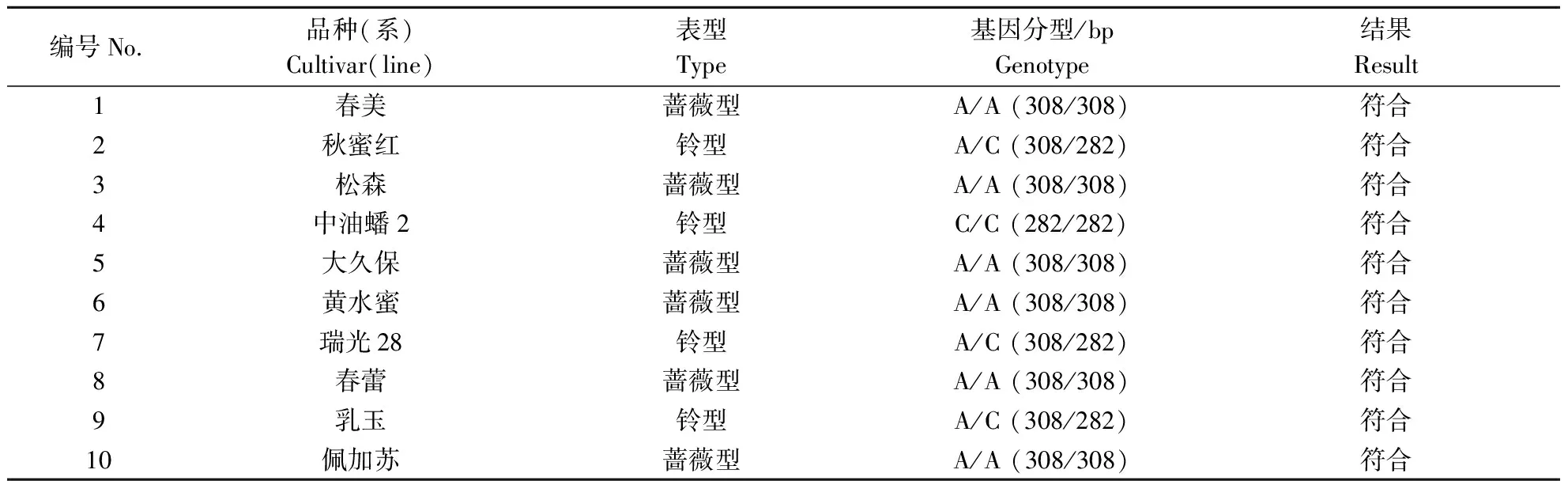
表1 dCAPs标记在10个桃种质资源中的验证Table 1 Validation of dCAPs markers in 10 peach germplasms
2.2 桃花型性状PpB3-1基因dCAPs标记在桃蔷薇型/铃型杂交群体中的应用
对以‘黄水蜜’(蔷薇型花,sh/sh)为母本,‘中油桃14号’(铃型花,SH/sh)为父本杂交获得的73株杂种后代,利用dCAPs标记对桃铃型/蔷薇型杂交群体进行验证,结果显示,所有杂种后代单株出现两种特异片段类型,分别为308 bp纯合片段和308 与282 bp杂合片段(图3),与在田间调查得到的表型和基于SNP基因分型结果一致,符合率为100%(表2),表明桃花型性状PpB3-1基因dCAPs标记适用于桃花型铃型/蔷薇型性状的早期选择。
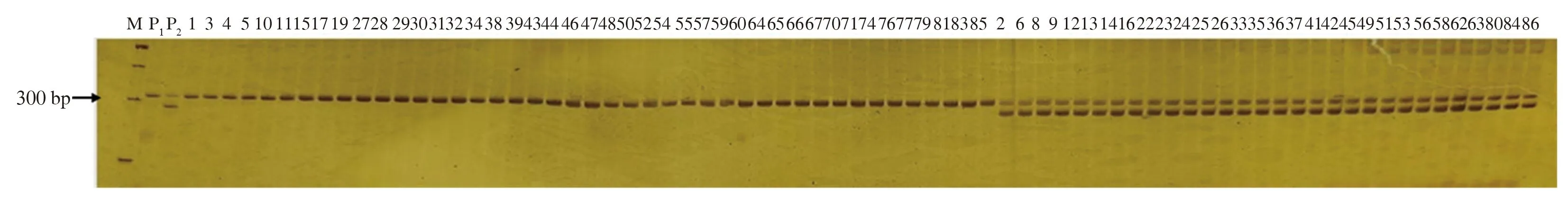
M:DNA Marker;P1:母本;P2:父本;1,3,4~86:杂种后代。
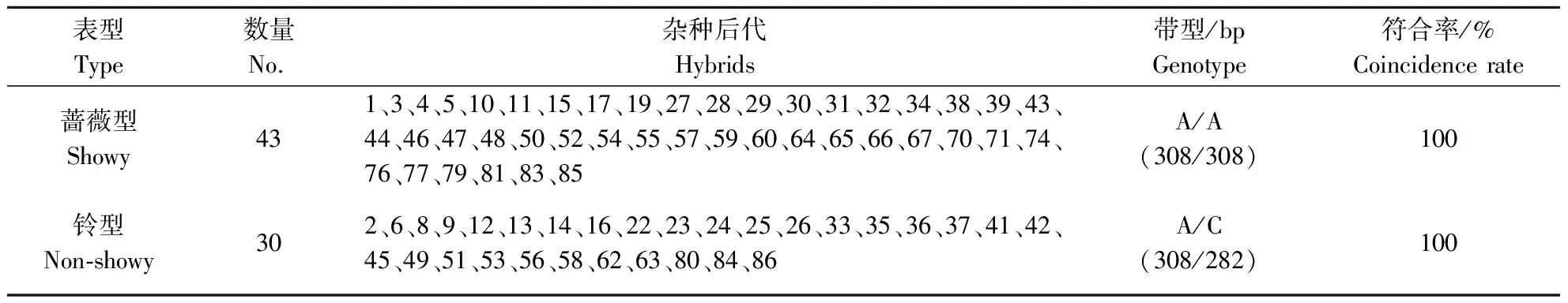
表2 后代表型鉴定与标记检测结果Table 2 IdentificationofflowerphenotypeandmarkertestinF1 hybrids
2.3 桃花型性状PpB3-1基因dCAPs标记在桃自然群体中的应用
将开发的PpB3-1基因dCAPs标记用于102份自然群体的桃种质资源,包含68份蔷薇型材料,34份铃型材料(表3)。PpB3-1基因dCAPs标记检测结果如图4所示,铃型花DNA扩增出来的条带可以被酶切,产生2种类型特异片段:308和282 bp 2条特异片段(杂合显性,A/C)和282 bp 1条特异片段(纯合显性,C/C),而蔷薇型花DNA扩增出来的条带不能被酶切,产生1条308 bp特异片段(纯合隐性,A/A)。PpB3-1基因dCAPs标记在102个自然群体中的检测结果和表型结果完全一致,符合度为100%。
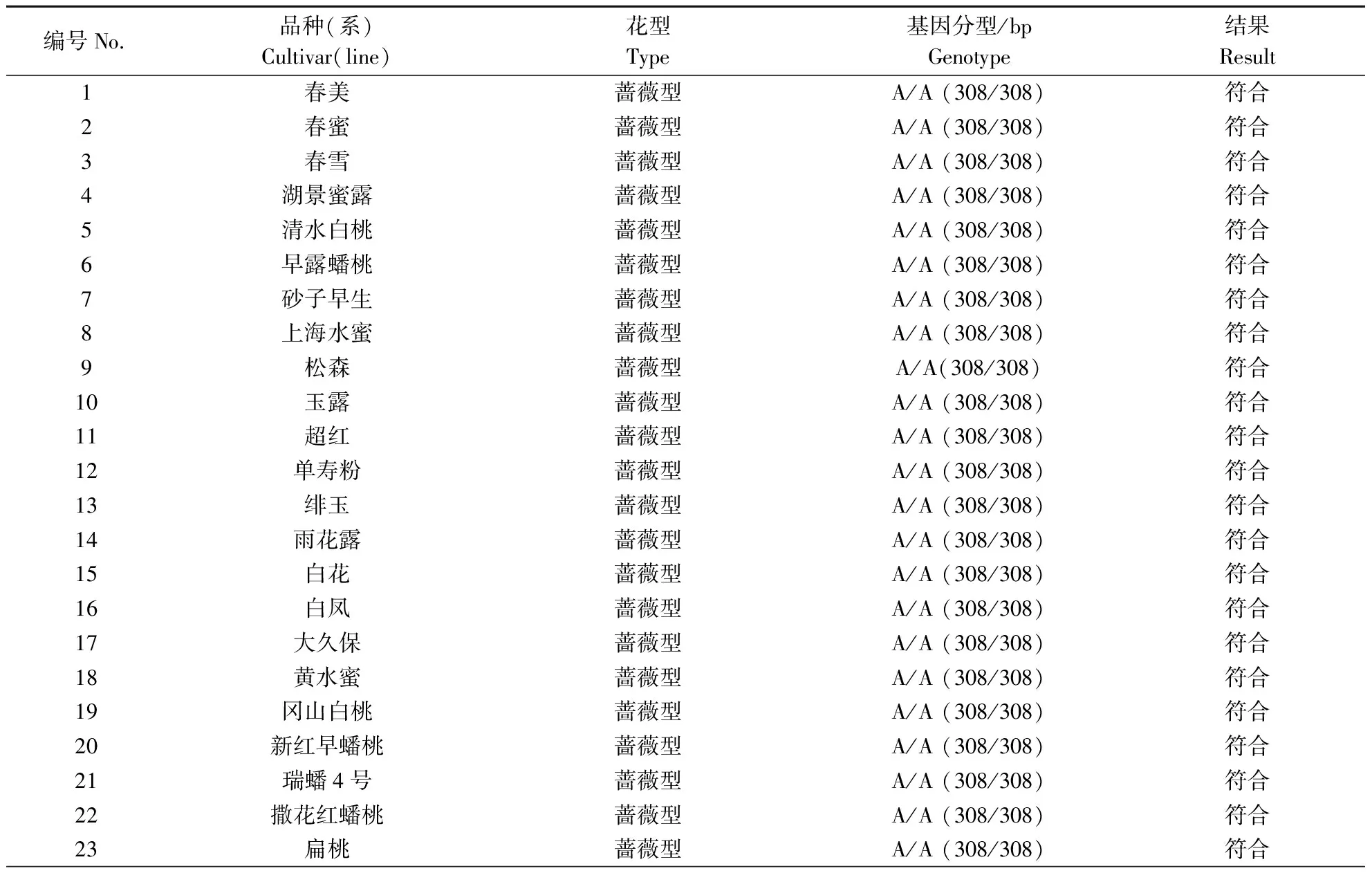
表3 dCAPs标记在自然群体中的验证Table 3 Validation of dCAPs markers in natural populations
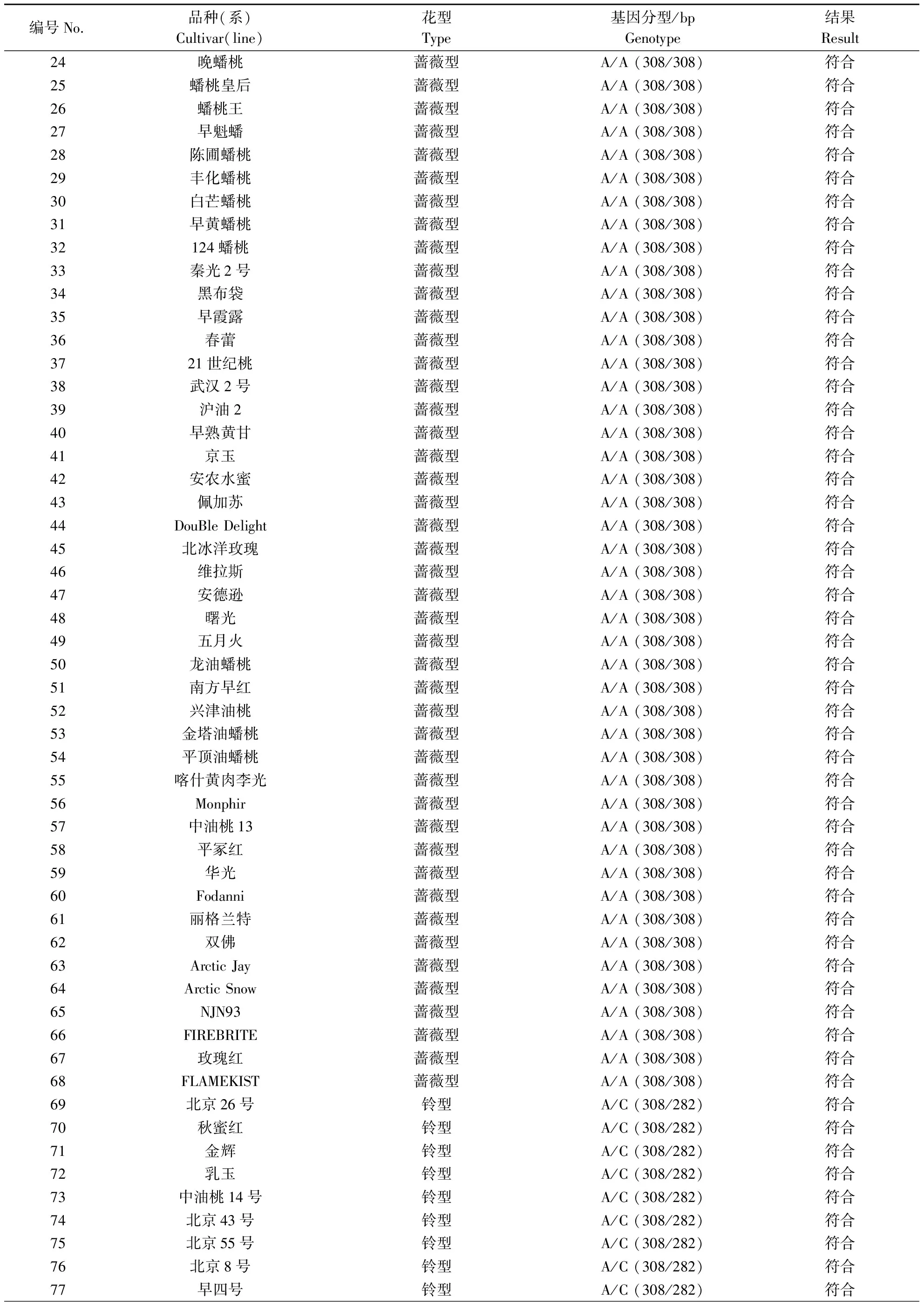
续表 Continuing table
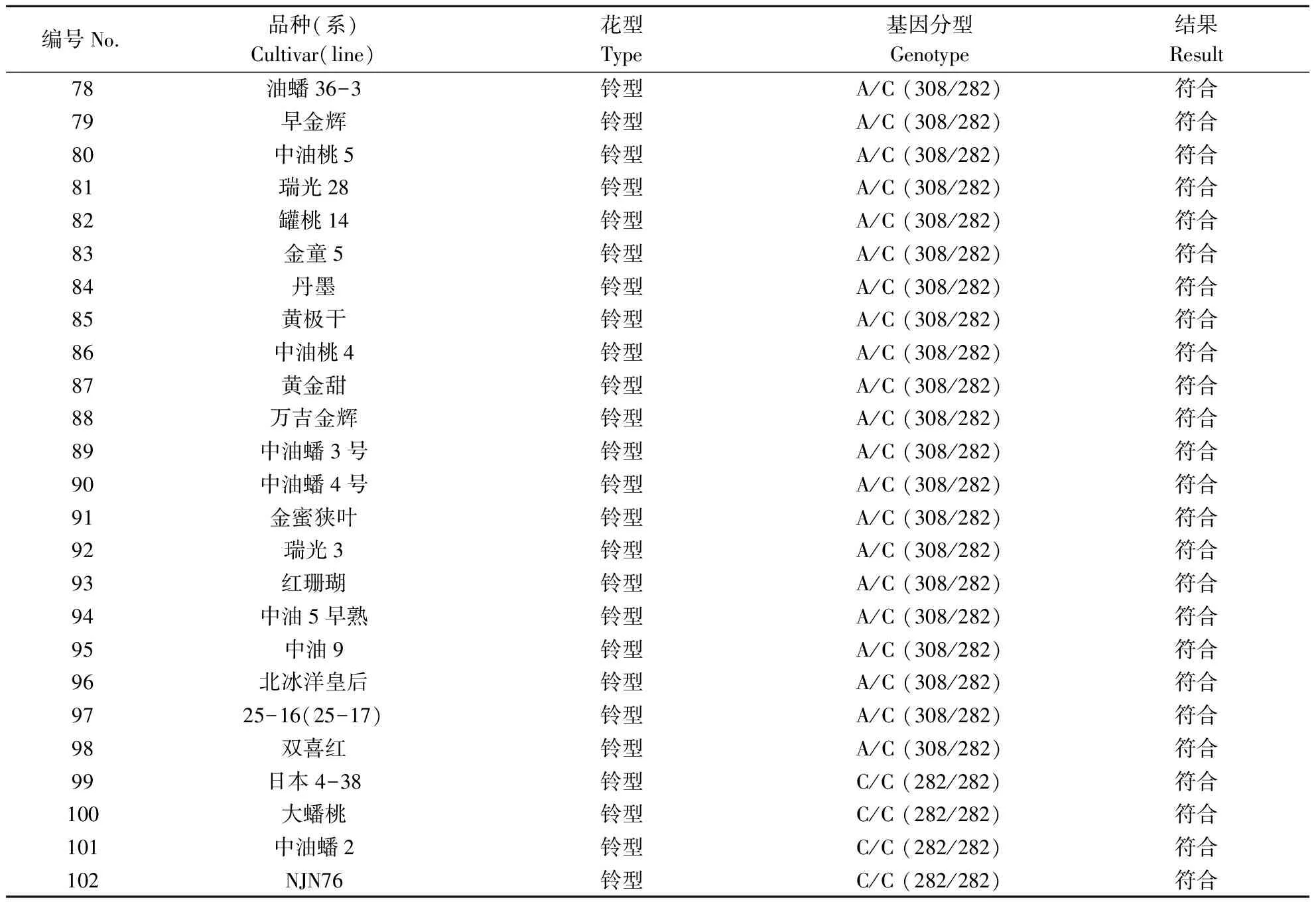
续表 Continuing table

M:DNA Marker;1~102:不同桃种质资源。
3 讨论与结论
在果树遗传育种中,由于童期导致后代表型鉴定存在周期长、占用土地资源与人力成本高等问题。重要性状标记开发和基因挖掘等工作相对滞后,不能满足杂交后代早期选择的需求。近几年来,桃主要性状定位研究取得突破性进展,特别是桃基因组测序及高质量基因组的组装,加速了目标性状基因的定位[8,13-16],进而为分子标记开发,实现早期、准确的基因型鉴定和表型预测提供了重要的理论依据和基础[17]。
桃树型相关矮化[18-19]、分枝角度[20],与果实相关的果实形状[13]、茸毛有无[21]、核黏离性[22]、果肉质地[22]、果实颜色[23]及果实酸与非酸等性状关键基因均被定位,基于定位基因开发相应的分子标记,可以实现对表型的分子鉴定。冯建灿等[24]利用控制茸毛性状PpeMYB25基因变异信息开发的IndelG标记对107份桃种质资源茸毛性状基因型进行了鉴定,符合度为100%;鲁振华等[25]对控制桃果肉颜色(白/黄)性状基因CCD4(carotenoid cleavage dioxygenases 4)的3种等位基因进行相应的Indel、SSR和SNP标记开发,对122份桃种质资源进行了基因分型,为种质材料基因型鉴定和黄肉桃品种选育奠定了基础。
LIAN等[8]前期定位到控制桃花型(铃型/蔷薇型)性状关键基因PpB3-1,位于PpB3-1基因启动子区域的SNP位点与花型性状紧密连锁,为后续开发相关分子标记提供了理论基础[8]。SNP标记具有稳定性、广泛性和代表性,已经成为目前研究最多的分子标记,但由于其检测成本较高限制了其应用。而基于SNP位点开发的CAPs或dCAPs标记,具有共显性、低成本等优点,被广泛用于分子标记辅助育种中。CAPs或dCAPs标记不需要大型特殊的仪器设备[26],仅需少量样品的DNA进行PCR扩增,对扩增产物酶切后通过聚丙烯酰胺凝胶或琼脂糖电泳检测,且对样品DNA的质量浓度要求不严格[27]。与CAPs标记不同,dCAPs标记设计引物时在突变位点附近引入错配碱基,引物在扩增期间将错配碱基带入靶序列并与鉴定的突变位点结合,产生独特的限制性内切酶识别位点[28],可用于检测突变位点处不含限制性内切酶识别位点的情况[29]。利用番茄粉色和红色果实高度相关的SNP位点开发的dCAPs标记,在后代群体中验证番茄果实颜色符合率达到95%以上[30];利用水稻耐冷基因COLD1中的SNP位点开发的分子标记,能准确鉴定粳稻、籼稻及杂合基因型[31]。本研究中,基于定位到的花型性状关键基因紧密连锁SNP位点开发的dCAPs标记,不仅在杂交群体中准确率100%,在自然群体的鉴定中准确率也达到100%。本研究利用开发的花型性状dCAPs标记B3-1对102份桃种质资源和73个杂种后代花型性状基因型进行鉴定,标记检测准确率为100%,花型性状dCAPs标记B3-1的开发为基于花型性状的杂交组合亲本选择选配、后代花型性状早期鉴定、提高选择效率和缩短育种周期奠定基础。

