基于新型比色探针的分光光度法测定β-淀粉蛋白寡聚体的含量
周信光,于妍妍
(1.深圳市北测检测技术有限公司,深圳 518000;2.徐州医科大学 药学院,江苏省新药研究与临床药学重点实验室,徐州 221004)
阿尔茨海默病(AD)是一种常见的与年龄相关的神经变性疾病,主要表现为记忆丧失和进行性认知障碍,其致病机制目前尚不清楚,但脑细胞外β-淀粉蛋白(Aβ)斑块沉积和过度磷酸化的tau蛋白引起的细胞内神经原纤维缠结被认为是AD的主要病理标志[1]。Aβ的过度积累和Aβ寡聚体(Aβo)在大脑中的形成会损害突触,最终导致记忆丧失。更重要的是,与Aβ聚集体的其他异构体(Aβ纤维丝或原纤维蛋白)相比,Aβo通常具有更高的神经毒性[2]。许多动物试验表明,降低Aβo的水平,可提高转基因小鼠模型的学习能力和记忆。此外,大脑中已经形成的Aβo还可引起脑内其他蛋白(α-syn和Pr P)的聚集,并促进tau蛋白的聚集,最终导致大脑内代谢紊乱[3]。因此,Aβo被认为是一个有前途的,可用于AD诊断和治疗的潜在生物标志物和治疗指标。
近年来,电化学法[4]、表面等离子体共振法[5]和荧光光谱法[6]等分析方法已经被开发用于Aβo的测定。介孔二氧化硅纳米粒子(MSN)由于其独特的孔道结构、大的比表面积、可调谐的孔径和体积、较好的生物相容性和易功能化等优势,成为承载各种尺寸功能分子的理想选择,在生物技术和纳米医学领域得到了广泛的应用[7-8]。小信号分子可以填充到MSN的介孔中,并且可利用不同的“守门人”(如聚合物分子、有机分子、纳米粒子、超分子)进行封堵,随后利用竞争反应、光、酸碱度等条件进行刺激,实现信号分子的释放[9],完成对微核糖核酸(mi RNA)、生物毒素、黄曲霉毒素等多种生物分子的检测[7,10-11]。这也为检测Aβo提供了一种思路。
基于以上研究背景,本工作首先将葡萄糖信号分子包载在聚乙烯亚胺(PEI)功能化介孔二氧化硅纳米粒子(PEI-MSN)内部孔道内,然后进一步修饰m-载脂蛋白E(mAPOE)多肽标记的金纳米粒子(mAPOE-Au NPs),进而对MSN封堵,构建一种能够对Aβo高效检出的比色探针(PEI-MSN/mAPOEAu NPs)。在目标物Aβo的存在下,由于竞争置换反应的发生,mAPOE-Au NPs从PEI-MSN表面脱离,葡萄糖被释放出来。借助葡萄糖氧化酶将葡萄糖催化为过氧化氢,并利用二硫化钼纳米片(MoS2NSs)的过氧化物酶活性,对释放出来的葡萄糖进行灵敏比色分析,从而间接实现对Aβo的光学检测(图1),并进一步利用AD小鼠脑组织样本进行了验证。
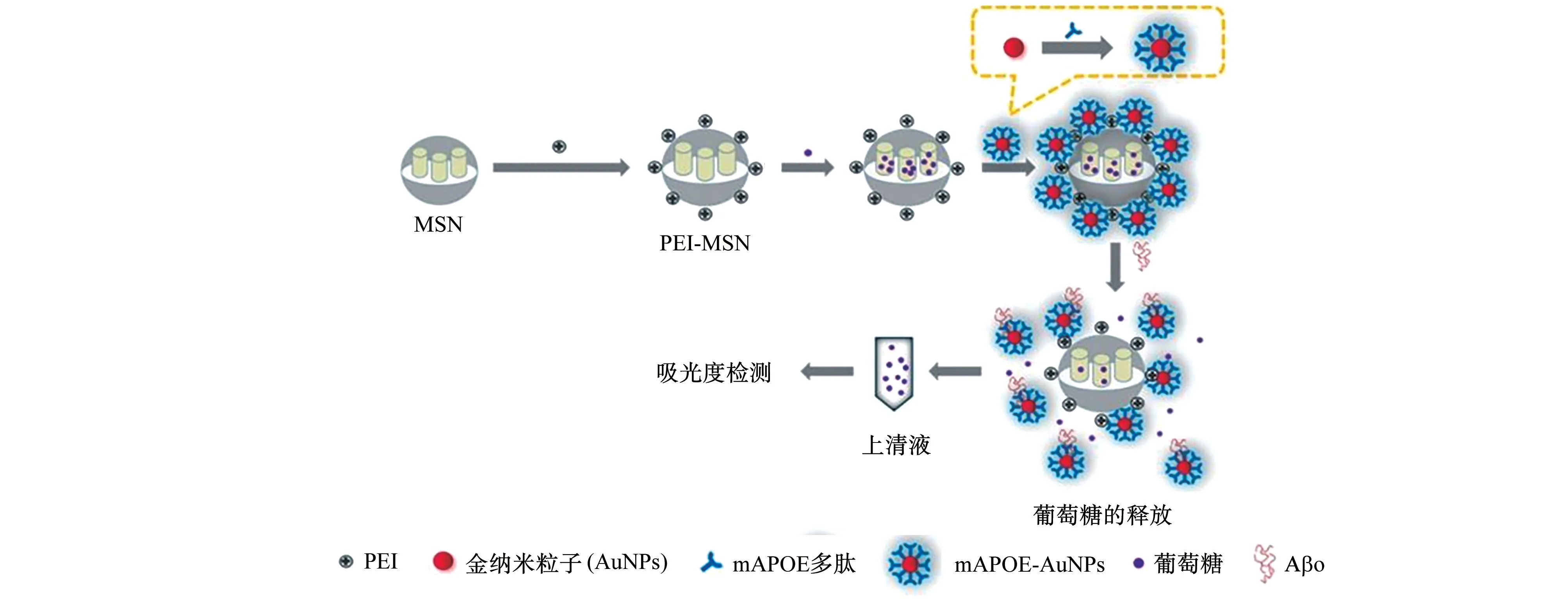
图1 PEI-MSN/m APOE-Au NPs比色探针的制备及其对Aβo的检测原理图Fig.1 Sche matic diagra m of preparation of PEI-MSN/mAPOE-Au NPs colori metric pr obe and its detection for Aβo
1 试验部分
1.1 仪器与试剂
UV-1800型紫外-可见分光光度计;JEM-2100F型透射电子显微镜(TEM);ZS3600型Zeta电位分析仪;VS-100C型恒温混匀仪;Infinite M200 pro型多功能酶标仪。
0.05mol·L-1乙酸盐缓冲溶液(p H 3.5):分别称取7.9 g乙酸钠和2.5 g冰乙酸,用水溶解后,稀释至1 000 mL即得。
Aβ、mAPOE多肽(RLLRKRLKRLGWC)的纯度均大于95%;葡萄糖氧化酶,规格100 U·mg-1;牛血清白蛋白(BSA)为分子生物学级;MoS2NSs分散液,1.0 g·L-1;硫黄素T的纯度为97%;3,3′,5,5′-四甲基联苯胺(T MB)的 纯 度 为98%;PEI的纯度为99%;四水合四氯金酸(HAu Cl4·4 H2O)的纯度大于99.9%;其他试剂均为分析纯;试验用水为超纯水。
1.2 试验方法
1.2.1 mAPOE-Au NPs的制备
在100 mL圆底烧瓶中加入50 mL 1 mmol·L-1的四氯金酸溶液,快速搅拌并加热至沸腾。随后迅速加入5 mL 38.8 mmol·L-1的柠檬酸钠溶液,持续搅拌10 min,移去热源后,再继续搅拌15 min。冷却至室温,即得Au NPs溶液,于4℃避光保存。
取10 mL Au NPs溶液,用0.1 mol·L-1的碳酸钠溶液调节p H至9.0,随后加入200μL 40 mg·L-1mAPOE多肽溶液,于37℃摇床孵育2 h,即可得到mAPOE-Au NPs。将上述溶液以转速12 000 r·min-1于4℃离心30 min,去除上清液,分散至500μL 1%(质量分数)BSA溶液中。
1.2.2 PEI-MSN的 制 备
根据文献[12],将0.25 g十六烷基三甲基溴化铵溶解于120 mL蒸馏水中,搅拌下,逐渐升温至80℃,随后迅速加入875μL 2 mol·L-1氢氧化钠溶液,继续反应20 min。用注射泵以250μL·min-1的速率向上述溶液中加入1.25 mL正硅酸乙酯,反应2 h。冷却至室温后,以转速10 000 r·min-1离心,得到白色沉淀,用水和甲醇交替清洗两次。为除去多余的表面活性剂,将收集到的白色产物分散至75 mL甲醇和1.5 mL盐酸的混合体系中,回流反应12 h。结束后离心、过滤,用甲醇和水洗涤产物后于60℃干燥过夜,即可制得MSN。将100 mg MSN超声分散至20 mL水中,加入150 mg PEI(重均分子量Mw=600),室温下搅拌过夜。洗涤烘干后,即可得到正电荷的PEI-MSN。
1.2.3 PEI-MSN/mAPOE-Au NPs比色探针的制备
称取10 mg PEI-MSN,超声分散至1 mL 0.5 mol·L-1葡萄糖溶液中。将该混合物在旋转混合仪上轻轻摇动过夜。由于扩散作用,葡萄糖会进入至PEI-MSN孔隙中,随后将该溶液与mAPOEAu NPs在4℃混合孵育6 h。将上述混合溶液用10 mmol·L-1磷酸盐缓冲溶液(PBS)在4℃多次离心洗涤,以除去多余的葡萄糖。将所得产物分散至500μL 10 mmol·L-1PBS中,即可得到PEIMSN/mAPOE-Au NPs比色探针。
1.2.4 Aβo标准溶液的制备
根据已有文献报道制备Aβo标准溶液[13]。将纯化后的Aβ首先溶解在1,1,1,3,3,3-六氟-2-丙醇中,质量浓度为1 g·L-1,然后在恒温混匀仪中于4℃反应2 h,以去除Aβ聚集体。随后用高纯氮气流蒸发去除1,1,1,3,3,3-六氟-2-丙醇,将附着在管壁的Aβ溶解在100μL二甲基亚砜中,得到Aβ单体母液。将Aβ单体母液稀释至所需浓度,然后在37℃水浴中孵育24 h,即可得到不同浓度的Aβo标准溶液。
1.2.5 PEI-MSN/mAPOE-Au NPs比 色 探 针 对Aβo的光学检测
取50μL PEI-MSN/mAPOE-Au NPs比色探针于一系列试管中,加入不同浓度的Aβo标准溶液,于37℃振荡30 min。离心后,取50μL上清液,加入5μL 10 g·L-1葡萄糖氧化酶溶液,于37℃摇床孵育30 min。反应结束后,在每个试管中分别加入0.05 mol·L-1乙酸盐缓冲溶液(p H 3.5)120μL、4.0 mmol·L-1T MB溶液50μL和1.0 g·L-1MoS2NSs分散液25μL,振荡孵育30 min,采用紫外-可见分光光度计测量655 nm处的吸光度。
1.2.6 数据处理
所有试验均平行测定3次,结果均以(平均值±标准偏差)表示,并用统计软件SPSS15.00进行分析。
2 结果与讨论
2.1 结构表征
试验利用TEM、氮气等温吸附-脱附测试(BET)、Zeta电位等对PEI-MSN和mAPOEAu NPs的结构和形态进行了表征。如图2所示,从TEM图中可以清楚地观察到MSN呈现平行排列的六边形介孔结构,粒径分布均匀,平均粒径约为130 nm。本试验基于竞争置换原理,利用葡萄糖在MSN中的包载和释放,完成对Aβo的定量检测。因此,葡萄糖能否顺利扩散到MSN孔道内,对试验至关重要。

图2 MSN的TEM图Fig.2 TEMi mages of MSN
利用BET绘制了MSN的氮气吸附-脱附等温线,如图3所示。
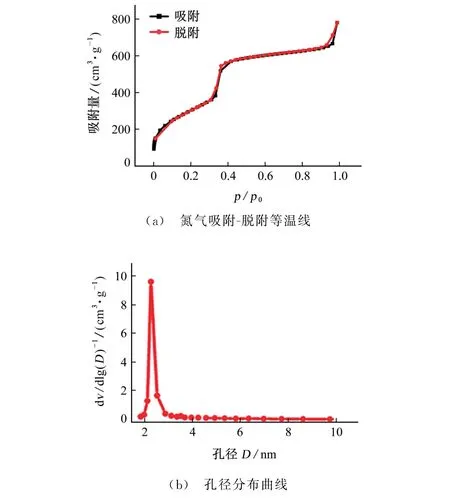
图3 MSN的氮气吸附-脱附等温线和孔径分布曲线Fig.3 Nitrogen adsorption-desor ption isother mal cur ve and pore size distribution cur ve of MSN
结果表明:当相对压力p/p0在0.3~0.4内时,颗粒的吸附能力显著上升,说明该等温线是典型的Ⅳ型等温线,表明制备的MSN具有典型的MCM-41介孔结构。利用BET模型计算得出,MSN的比表面积为1 130.38 m2·g-1。孔径分布曲线显示MSN的孔径分布范围很窄,孔径约为2.4 nm,远大于葡萄糖分子,保证了葡萄糖分子可以通过扩散作用顺利进入MSN。
通过测定Zeta电位,对PEI-MSN的修饰过程进行了表征。MSN由于表面大量羟基的存在而呈现负电荷,Zeta电位为(-20.07±0.15)mV。当PEI吸附到MSN表面后,Zeta电位变为(33.07±0.21)mV(正值),证实了PEI在MSN表面的成功修饰。由于Au NPs和mAPOE都为负电荷,mAPOE-Au NPs的Zeta电 位 为(-37.83±1.27)mV,也是负值。当mAPOE-Au NPs与PEIMSN共 同 孵 育 之 后,Zeta电 位 变 为(-9.47±0.42)mV(负值),这 是 因 为 负 电 荷 的mAPOEAu NPs静电吸附在正电荷PEI-MSN表面,且mAPOE-Au NPs所带电荷数的绝对值大于PEIMSN。紫外-可见吸收光谱(图4)表明:MSN和PEI-MSN在300~800 nm内均没有特征吸收;mAPOE-Au NPs在520 nm处有明显的Au NPs的特征吸收峰;当mAPOE-Au NPs与PEI-MSN孵育之后,在520 nm处也出现了明显的吸收峰。该结果与Zeta电位测定结果一致,证明了mAPOEAu NPs在PEI-MSN表面的成功组装。
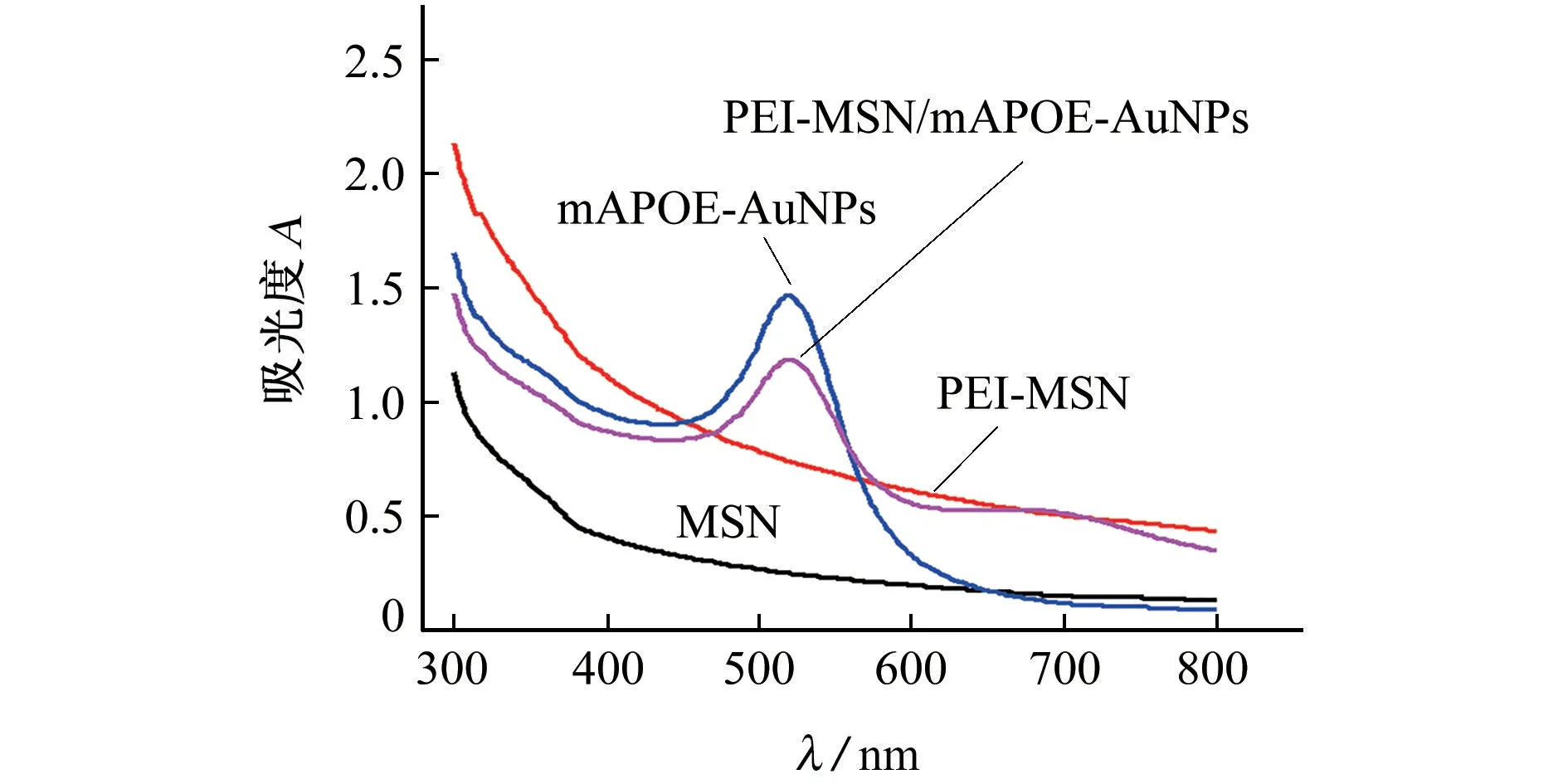
图4 紫外-可见吸收光谱图Fig.4 UV-vis absorption spectra
2.2 比色探针对Aβo的光学检测
试验考察了PEI-MSN/mAPOE-Au NPs比色探针在无Aβo和50 nmol·L-1Aβo标准溶液存在下的紫外-可见吸收光谱,如图5所示。
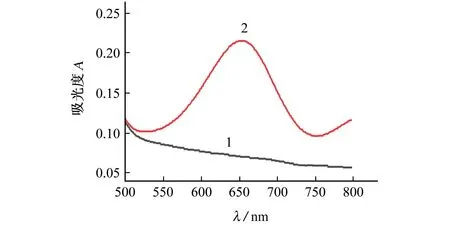
图5 PEI-MSN/mAPOE-Au NPs比色探针在无Aβo和50 nmol·L-1 Aβo标准溶液存在下的紫外-可见吸收光谱Fig.5 UV-vis absor ption spectra of PEI-MSN/mAPOEAu NPs colori metric pr obe in the absence of Aβo and presence of 50 nmol·L-1 Aβo standar d solution
结果表明:PEI-MSN/mAPOE-Au NPs比色探针在550~800 nm的可见光区并没有出现明显的吸收峰,说明该溶液中没有游离的葡萄糖(曲线1)。将比色探针与50 nmol·L-1Aβo标准溶液共同孵育30 min后,在655 nm处出现一个明显的吸收峰(曲线2),这是在MoS2NSs的催化下,T MB被过氧化氢氧化后产生的特征吸收峰。在含氧条件下,葡萄糖氧化酶催化葡萄糖生成过氧化氢,由于MoS2NSs具有过氧化物酶活性,无色的还原型T MB被过氧化氢氧化成蓝色的氧化型产物,在655 nm处产生特征吸收峰。
进一步利用TEM对上述试验进行了验证,如图6所示。

图6 PEI-MSN/mAPOE-Au NPs比色探针在无Aβo和50 nmol·L-1 Aβo标准溶液存在下的TEM图Fig.6 TEMi mages of PEI-MSN/mAPOE-Au NPs colori metric probe in the absence of Aβo and presence of 50 nmol·L-1 Aβo standard sol ution
结果表明:mAPOE-Au NPs均匀地吸附在PEI-MSN表面和周围。当在PEI-MSN/mAPOEAu NPs中加入50 nmol·L-1Aβo标准溶液孵育一段时间之后,部分Au NPs离开MSN表面,说明由于Aβo的 存 在,PEI-MSN与Aβo对mAPOEAu NPs发生了竞争置换反应,由于Aβo与mAPOE多肽之间的特异性作用力大于mAPOE-Au NPs与PEI-MSN之间的静电作用,导致mAPOE-Au NPs与PEI-MSN分离。上述试验结果均说明,葡萄糖能够在PEI-MSN中顺利地实现封装和竞争释放,也证明了所设计的PEI-MSN/mAPOE-Au NPs比色探针对Aβo的光学检测是可行的。
2.3 试验条件的优化
首先考察了不同浓度(0.05,0.1,0.3,0.5,1.0,1.5 mol·L-1)葡萄糖溶液对试验结果的影响。结果表明:随着葡萄糖溶液浓度由0.05 mol·L-1递增到0.5 mol·L-1,吸光度逐渐增加;继续增大葡萄糖浓度,吸光度几乎不增加,这可能是由于0.5 mol·L-1葡萄糖溶液在MSN内已实现吸附饱和。因此,试验确定0.5 mol·L-1为葡萄糖溶液的最佳包载浓度。
此外,还对PEI-MSN/mAPOE-Au NPs与Aβo的孵育时间(10,20,30,40,50,60,80 min)进行了优化。结果表明:在655 nm处的吸光度随着孵育时间的延长而逐渐增大,在30 min时基本达到平衡;继续延长孵育时间对吸光度没有明显的影响。因此,在整个试验过程中,30 min是Aβo从PEI-MSN表面竞争释放葡萄糖的最佳孵育时间。
2.4 PEI-MSN/mAPOE-Au NPs比色探针对Aβo的定量分析
在上述最佳条件下,考察了PEI-MSN/mAPOE-Au NPs比色探针对不同浓度Aβo标准溶液的响应。随着Aβo标准溶液浓度在0.001~2μmol·L-1内依次递增,655 nm处的吸光度逐渐增大。因此,以吸光度为纵坐标,以Aβo浓度的对数为横坐标进行线性拟合。结果表明,吸光度与Aβo浓度的对数在1.0~20 nmol·L-1内呈线性关系,线性回归方程为y=2.604x+0.196 0,相关系数为0.996 0。在信噪比不小于3的情况下,检出限为0.4 nmol·L-1。
选取了生物体内一系列潜在的干扰物,包括9种氨基酸(甲硫氨酸、缬氨酸、组氨酸、丝氨酸、甘氨酸、赖氨酸、苏氨酸、苯丙氨酸和半胱氨酸,浓度均为100μmol·L-1)、5种常见金属离子(Mg2+、Ca2+、Na+、Fe3+和Cu2+,浓度均 为100 μmol·L-1)以及Aβ聚集体的其他异构体(Aβ单体和纤维丝,浓度均为5μmol·L-1),来考察本方法对Aβo检测的特异性。结果表明,与Aβo相比,上述干扰物在与PEI-MSN/mAPOE-Au NPs比色探针孵育后,并没有出现吸光度的显著增强,与Aβo之间具有显著性差异(P<0.001),说明该比色探针对于Aβo的检测具有高度特异性,这主要得益于比色探针上连接的mAPOE能够选择性地识别Aβo。
2.5 精密度和回收试验
利用上述构建的PEI-MSN/mAPOE-Au NPs比色探针,进一步考察了该比色探针在实际样本分析中的潜在能力。选取APP/PS1转基因AD小鼠作为试验动物进行回收加标试验,对AD小鼠海马中的Aβo含量进行测定,并计算测定值的相对标准偏差(RSD)和回收率,结果见表1。
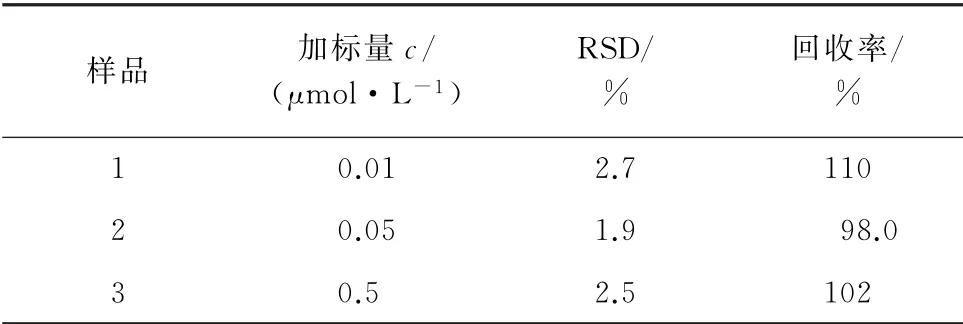
表1 精密度和回收试验结果(n=6)Tab.1 Results of tests for precision and recovery(n=6)
由表1可知,Aβo的回收率为98.0%~110%,测定值的RSD为1.9%~2.7%,符合生物样本分析的要求,说明本方法对脑组织中Aβo的检测具有较高的准确度。
本工作基于MoS2NSs的过氧化物酶活性,通过葡萄糖在竞争置换刺激下从MSN孔道内的释放,间接实现了对Aβo的光学测定。该比色分析方法原理简单、灵敏可靠,对Aβo的检测具有较高的特异性,能够满足AD小鼠中Aβo检测的要求,为开拓比色分析技术在AD检测中的应用提供了一种有效的策略。

