WSTF过表达的乳腺癌MCF-7细胞增殖、侵袭、迁移能力变化及其机制
张顺礼,王雅琪,胡继卫,马杰,谷峥,王宇,蒋楠
唐山市人民医院乳腺外科,河北唐山 063000
乳腺癌是女性最常见的癌症之一,在女性恶性肿瘤中的病死率位居第二[1]。随着医疗技术的发展,乳腺癌患者手术治疗后的5年生存率显著提高,但是术后肿瘤复发和转移是乳腺癌治疗中的一个重大难题[2]。手术、放疗和化疗是目前临床上乳腺癌的主要治疗方式,但是化疗药物的耐药性导致治疗效果大大降低[3]。因此,了解影响乳腺癌细胞恶性生物学行为的相关机制,对于抑制肿瘤细胞的转移和侵袭具有重要意义。威廉姆斯综合征转录因子(WSTF)是一种多面蛋白,属于WAL/BAZ/WAC蛋白家族,该家族包含一个与植物同源结构域(PHD结构域)相邻的C-末端溴代半乳糖基序,与RNA聚合酶Ⅰ和Ⅲ基因调控、维生素D代谢、染色质装配和DNA修复等多种细胞功能有关,并参与基因转录的调控[4-5]。近期研究发现,WSTF可能通过形成不同的染色质重塑复合物而发挥不同的作用[6]。此外,WSTF具有WAC结构域的固有酪氨酸激酶活性和额外的N-末端区域,其在DNA损伤反应中起关键作用,因此可能决定DNA损伤后的细胞命运[7]。近年来研究显示,包括WSTF在内的溴代多糖蛋白与肿瘤发生相关[8],但目前WSTF在乳腺癌发生发展中的作用及其机制尚未可知。为此,2021年6月—2022年6月我们进行了如下研究。
1 材料与方法
1.1 材料细胞:乳腺癌MCF-7细胞株购自成都匹拓生物科技有限公司。主要试剂:RPMI 1640培养液、胎牛血清、胰蛋白酶、RNA反转录试剂盒均购自南京建成生物有限公司;慢病毒表达载体pLVXPRDX4、慢病毒干扰载体pLVX-shPRDX4、空载体pLVX-NC均购自上海捷瑞生物公司;qCCK-8、PCR试剂盒均购自上海优宁维生物有限公司,凋亡检测试剂盒购自美国Sun-Shine公司,RNA提取试剂盒购自武汉三鹰有限公司;WSTF、白细胞介素6(IL-6)、信号传导子及转录激活子3(STAT3)、β-actin蛋白抗体及二抗均购自美国Abcam公司。主要仪器:倒置显微镜、流式细胞仪购自意大利赛默飞公司;Bio-Rad微孔板阅读器、LAS 4000成像系统均购自美国GE Healthcare公司。
1.2 细胞分组及转染从液氮罐中取出乳腺癌MCF-7细胞株进行复苏,将复苏后的细胞置于RP⁃MI 1640培养基中,采用细胞培养皿进行分装,置于37℃、5% CO2恒温细胞培养箱中培养24 h,细胞融合率达70%后更换培养基,加入胰蛋白酶消化。将MCF-7细胞分为对照组、空载组、WSTF低表达组和WSTF高表达组。将空载组、WSTF低表达组和WSTF高表达组细胞接种于小皿中,37℃、5%CO2恒温环境中培养24 h,分别转染空载体pLVX-NC、慢病毒干扰载体pLVX-shPRDX4、慢病毒表达载体pLVX-PRDX4 10 μL,48 h后加入含5 μg/mL嘌呤霉素的完全培养基继续培养,以筛选稳转细胞株;对照组常规培养,不进行处理。
1.3 细胞生物学行为观察
1.3.1 细胞增殖能力采用CCK-8法。取各组细胞,加入胰蛋白酶1 mL,轻微吹打2 min,使细胞完全悬浮。将悬浮的细胞转移到1.5 mL离心管中,2 000 r/min离心10 min,弃上清;加入RPMI 1640培养基1 mL,充分悬浮细胞。取一块新的96孔板,每孔加入细胞悬液100 μL,培养箱中培养24 h后弃去培养基,加入新的RPMI 1640培养基培养24 h,弃去培养基,加入培养液100 μL和CCK-8溶液10 μL,培养3 h。每组设置6个复孔。Bio-Rad微孔板阅读器读取450 nm处的吸光度(OD)值,计算细胞存活率。实验重复3次,取平均值。
1.3.2 细胞凋亡能力采用流式细胞术。将各组细胞用PBS吹洗两次,1×结合缓冲液悬浮细胞,调整密度为1×106/mL,加入Annexin V-FITC 5 μL,黑暗中室温孵育15 min;加入PI 10 μL,4℃避光孵育5 min,上流式细胞仪计算细胞凋亡率。实验重复6次,取平均值。
1.3.3 细胞侵袭能力采用改良Matrigel Boyden小室实验。在有基质胶的滤膜上接种各组细胞,制备密度为5×105/mL的细胞悬液,配置10%的FBS作为趋化剂,将趋化剂放在滤膜下仓室。将滤膜置于培养箱中培养24 h,对滤膜染色。在每个滤膜上随机选择5个视野,计数每个视野的细胞数即为侵袭细胞数。实验重复6次,取平均值。
1.3.4 细胞迁移能力采用划痕实验。将各组细胞制备5×105/mL的细胞悬液,接种于6孔板内,置于培养箱中培养48 h。划痕实验时将吸头垂直孔壁作一划痕,加入无血清培养基。划痕完成后培养48 h,使用EVOS M7000倒置显微镜观察,计算细胞划痕愈合率。
1.4 细胞中WSTF、IL-6和STAT3 mRNA检测采用qRT-PCR法。取各组细胞,应用RNA提取试剂盒提取细胞总RNA,反转录生成cDNA。按照PCR试剂盒说明书配置反应体系,进行PCR反应,各基因引物序列见表1。PCR反应体系:引物2.25 μL,cDNA 3.0 μL,SYBR Green qPCR SuperMix 17.25 μL,去酶水7.5 μL。PCR反应条件:94℃、12 min,96℃、12 s,62℃、25 s,72℃、40 s;共35个循环。采用2-ΔΔCt法计算mRNA相对表达量。

表1 WSTF、IL-6、STAT3及内参GAPDH引物序列
1.5 细胞中WSTF、IL-6和STAT3蛋白检测采用Western blotting法。取各组细胞,配置蛋白酶K溶液(PBS 1 mL加入蛋白酶K 100 μL),弃去培养皿中的培养液;加入蛋白酶K溶液1 mL,4℃条件下3 000 r/min离心20 min,用加样枪将上清转移至
1.5 mL EP管中。经SDS-PAGE电泳分离、转膜和封闭,加入WSTF、IL-6、STAT3和内参β-actin一抗(稀释比例均为1∶5 000),4℃条件下孵育12 h,孵育后的条带清洗3次;加入二抗(稀释比例均为1∶1 000),室温条件下孵育2 h。LAS 4000成像并观察结果,计算蛋白相对表达量。
1.6 统计学方法采用SPSS22.0统计软件。计量资料采用Shapiro-Wilk法正态性检验,呈正态分布以±s表示,多组间比较采用方差分析,两组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞存活率、细胞凋亡率、划痕愈合率及细胞侵袭数比较见表2及OSID码图1。

表2 各组细胞存活率、细胞凋亡率、划痕愈合率及细胞侵袭数比较(xˉ±s)
2.2 各组细胞WSTF、IL-6和STAT3 mRNA相对表达量比较见表3。

表3 各组细胞WSTF、IL-6和STAT3 mRNA相对表达量比较(xˉ±s)
2.3 各组细胞WSTF、IL-6和STAT3蛋白相对表达量比较与对照组和空载组比较,WSTF低表达组WSTF、IL-6和STAT3蛋白相对表达量均降低,WSTF高表达组均升高(P均<0.05)。见表4、OSID码图2。
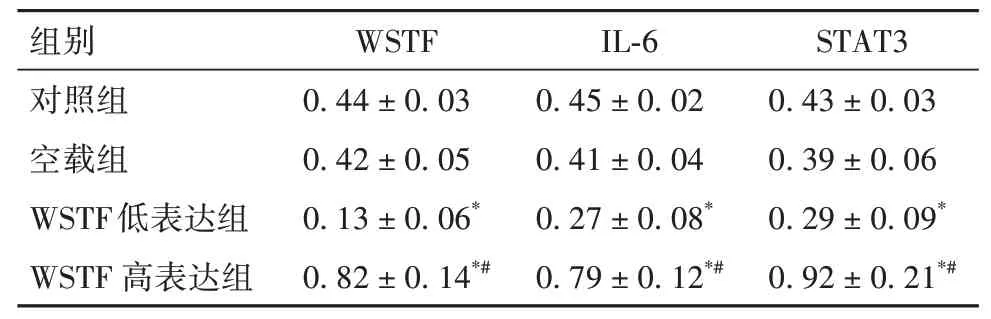
表4 各组细胞WSTF、IL-6和STAT3蛋白相对表达量比较(xˉ±s)
3 讨论
尽管手术治疗显著延长了乳腺癌患者的生存时间,但晚期患者的预后仍然不理想[9]。由于致癌/抑癌基因的多样性和组织类型特异性,许多致癌/抑癌蛋白在乳腺癌中的特定调节功能尚未完全阐明[10]。WSTF是一种由1 425个氨基酸组成的蛋白质,其功能目前尚不明了[11]。WSTF分子中包含一个PHD型锌指基序和一个溴代半乳糖,通常在转录调节器中发现,这表明WSTF可能作为转录因子而发挥作用[12]。此外,WSTF通过促进DNA损伤后的细胞凋亡来调节DNA损伤反应,因此在提高肿瘤细胞对放化疗的敏感性方面具有潜在作用[13]。
目前有研究利用公开的恶性肿瘤mRNA表达谱数据结合TCGA数据分析,确定了WSTF与肿瘤细胞的恶性生物学行为密切相关[14]。研究显示,在乳腺癌MCF-7细胞中WSTF表达显著高于正常细胞,提示WSTF可能是乳腺癌的一种致癌基因[15]。本研究结果显示,WSTF高表达组细胞存活率、划痕愈合率、侵袭细胞数均显著升高,细胞凋亡率显著降低,提示WSTF过表达可抑制乳腺癌MCF-7细胞凋亡,并促进其增殖、迁移和侵袭水平;这说明WSTF过表达加速了肿瘤细胞的生长和转移,表明WSTF作为一种癌蛋白,通过促进乳腺癌细胞的增殖和侵袭而发挥作用。同时本研究结果发现,WSTF低表达组细胞存活率、划痕愈合率、侵袭细胞数均显著降低,细胞凋亡率显著升高,提示沉默WSTF表达可促进乳腺癌MCF-7细胞凋亡,并抑制其增殖、迁移和侵袭,对于临床乳腺癌的分子靶向治疗具有一定的参考价值。
上皮—间质转化(EMT)是上皮细胞失去细胞极性,细胞与细胞之间黏附而成为间充质细胞的过程。间充质细胞具有迁移和侵袭特性,EMT对于乳腺癌进展中的转移启动至关重要[16]。目前研究显示,WSTF过表达可引起E-cadherin表达降低,而Ecadherin是EMT的标志,在转移性肿瘤中经常丢失[17]。研究显示,PI3K/AKT和IL-6/STAT3等致癌信号通路可激活EMT,在肿瘤的发生和侵袭过程具有重要作用[18]。IL-6/STAT3信号通路已经被证实参与不同因子诱导的EMT[19]。MENG等[14]在对肺癌细胞的研究中发现,WSTF能通过激活IL-6/STAT3信号通路而促进EMT,从而加速肺癌细胞的侵袭和增殖。本研究结果显示,WSTF低表达组IL-6、STAT3 mRNA及蛋白表达均显著降低,而WSTF高表达组均显著升高,提示WSTF可能通过调控IL-6/STAT3信号通路而影响乳腺癌细胞的EMT过程,参与对乳腺癌细胞恶性生物学行为的调控。
综上所述,WSTF过表达可抑制乳腺癌细胞凋亡,并促进其增殖、迁移和侵袭,其机制可能与激活IL-6/STAT3信号通路有关,而沉默WSTF表达则具有相反的作用,为乳腺癌的靶向治疗提供了新的参考依据。

