苦参碱对妊娠高血压大鼠内皮损伤和JAK2/STAT3/SOSC1 信号通路的影响
李 玲武建利李 珊曲广第
(新疆医科大学第一附属医院产科,乌鲁木齐 830054)
妊娠高血压(pregnancy-induced hypertension,PIH)是影响女性妊娠过程正常进行的重要疾病,其病发率高,临床上PIH 患者在妊娠20 周以后常出现血压异常升高、尿蛋白增高等症状,不仅会损伤孕妇的脑、心、肾等器官,还是导致胎儿和产妇死亡的重要原因[1]。 研究表明,妊娠早期胎盘相对灌注不足可能导致胎盘异常释放抗血管生成因子进入母体循环,致使孕妇和胎儿发生血管内皮损伤,进而引发高血压[2]。 而PIH 也会导致胎盘组织缺血缺氧,进而使孕妇体内的炎症应答机制被激活,造成血管内皮功能障碍[3]。 此外,过度的氧化应激也会导致血管内皮功能障碍,从而诱发炎症反应和氧化应激,加快PIH 进展[4]。 一些理论认为内皮功能障碍是PIH 的诱因,因为内皮功能受损会破坏胎盘的生理过程,导致抗血管生成因子释放进入母体循环,从而导致内皮细胞损伤[5-6]。 相关文献显示,酪氨酸蛋白激酶2(janus activated kinase 2,JAK2)/信号转导子和转录激活子3(signal transducer and activator of transcription 3,STAT3)信号通路在细胞生长分化和免疫方面起重要作用,细胞因子信号转录抑制因子1(suppressor of cytokine signaling-1,SOSC1)是一种细胞因子生物活性的内源性抑制剂,其通过JAK/STAT 信号通路传导[7]。 已有研究表明,JAK2/STAT3/SOSC1 通路的抑制与PIH 血管内皮细胞分泌功能有关[8]。 苦参碱是一种生物碱,主要提取自苦参等豆科植物中,药理作用广泛。 目前关于苦参碱在抗肿瘤方面的研究较多[9],近年来发现其在治疗血管损伤方面也有一定的效果[10]。 然而,到目前为止并未有研究报道苦参碱对PIH 的影响。 硫酸镁是临床上常用的缓解PIH 的药物,其能够减轻患者的痉挛症状,调节器官的血液灌注情况,故常用作PIH 研究的阳性药物[11]。 因此,本研究将制备PIH 大鼠模型,以硫酸镁为阳性对照,探讨苦参碱对PIH 大鼠内皮损伤的影响以及可能的分子机制。
1 材料和方法
1.1 实验动物
SPF 级SD 雄性大鼠30 只(7~8 周龄,280~320 g)和雌性大鼠60 只(7~8 周龄,220~270 g)均购自上海市公共卫生临床中心[SCXK(沪)2020-0002]。所有SD 大鼠均饲养在新疆医科大学第一附属医院动物房内[SYXK(新)2018-0003]。 本研究的动物实验均获得本院动物伦理委员会批准(K2007-05),且所有实验步骤均严格按照国际疼痛研究协会的动物保护原则进行,并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
亚硝基左旋精氨酸甲酯(L-NAME)购自美国Sigma 公司(批号:N5751);硫酸镁购自河北武罗药业有限公司(批号:国药准字H13022977);苦参碱,纯度≥98%,购自成都瑞芬思生物科技有限公司(批号:K-002);内皮素(ET)ELISA 检测试剂盒购自北京百奥莱博科技有限公司(批号:ARB13558);超氧化物歧化酶(SOD)、丙二醛(MDA)ELISA 试剂盒购自上海研谨生物科技有限公司(批号:YOYO、F12630);血栓素B2(TXB2)、6 酮前列腺素F1α(6-keto-PGF1α)、一氧化氮(NO)ELISA 检测试剂盒购自上海乔羽生物科技有限公司(批号:QY-SE2052、QY-SX1804、QY-WN1888);肿瘤坏死因子α(TNFα)、白细胞介素(IL)-6、IL-10 ELISA 检测试剂盒购自美国Abcam 公司(批号:ab236712、ab234570、ab214566);JAK2、p-JAK2、STAT3、p-STAT3、SOCS1
抗体购自美国CST 公司(批号:74987、66245、9139、4113、68631)。 大鼠无创血压计购自上海玉研科学仪器有限公司(型号:STARR MouseOx Small Animal Vit);多功能酶标仪购自华泰和合(北京)商贸有限公司(型号:4200 酶标仪);分光光度计购自上海光学仪器一厂(型号:722)。
1.3 实验方法
1.3.1 PIH 大鼠模型的构建与给药方法
SD 大鼠适应性饲养1 周后,将雌雄大鼠按照1 ∶2 的比例关在同一个笼子里进行交配。 次日,收集雌性大鼠的阴道分泌物,若在显微镜下观察到精子的存在,则视为大鼠的怀孕日。 将60 只孕鼠随机分成5 组,即正常对照组、模型对照组、低剂量苦参碱组、高剂量苦参碱组、硫酸镁组,每组12 只孕鼠。正常对照组除外,其余各组孕鼠在妊娠第12 天,通过连续1 周灌胃50 mg/kg L-NAME 构建PIH 大鼠模型[12],若孕鼠16 d 的血压比造模前的血压增加量≥20 mmHg,尿蛋白≥(+)时,则表示造模成功[13]。 在妊娠第16 天,低、高剂量苦参碱组分别灌胃50、100 mg/kg 苦参碱(依据朱新业等[14]的研究和前期预实验确定),硫酸镁组灌胃100 mg/kg 硫酸镁[15],正常对照组和模型对照组则灌胃等体积的生理盐水,每天1 次,连续6 d[16]。
1.3.2 各组孕鼠血压和24 h 尿蛋白含量的检测
从妊娠第12 天开始,每天检测使用大鼠无创血压计检测各组孕鼠的尾动脉血压并收集其24 h 内的尿液,采用考马斯亮蓝法检测其尿蛋白含量。 分别记录妊娠第12 天(造模前)、第16 天(给药前)、第17、21 天的血压和上述时间的24 h 尿蛋白含量。
1.3.3 ELISA 检测各组孕鼠血清中相关因子的水平将各组妊娠至21 d 的孕鼠麻醉后,经尾静脉取血,将其收集在抗凝管中,离心后取上清液,使用ELISA 试剂盒检测SOD、MDA、TNF-α、IL-6、IL-10、ET、TXB2、NO、6-keto-PGF1α 水平。
1.3.4 蛋白免疫印迹法检测胎盘组织内JAK2/STAT3/SOSC1 信号通路相关蛋白表达
各组孕鼠给药结束后,立即使用40 mg/kg 体积分数为1%戊巴比妥钠进行麻醉,并进行剖宫产,取出胎盘组织。 从胎盘组织中提取总蛋白,使用BCA 试剂盒检测其浓度,然后将等量的样品与加样缓冲液均匀混合,进行聚丙烯酰胺凝胶电泳,结束后转膜,1 h 后用牛血清白蛋白封膜;加入一抗JAK2、p-JAK2、STAT3、p-STAT3、SOCS1 或β-actin,均稀释1000 倍,次日,加入二抗,接着孵育1 h,再添加ECL 发光试剂,使用Image 软件对显影的条带灰度值进行分析。
1.4 统计学方法
2 结果
2.1 苦参碱对各组孕鼠不同时期血压的影响
2.4 苦参碱对各组孕鼠炎症反应的影响
与正常对照组比较,模型对照组大鼠妊娠第16、17、21 天的血压明显升高(P<0.05);与模型对照组比较,低、高剂量苦参碱组大鼠妊娠第17、21 天的血压依次降低(P<0.05),而高剂量苦参碱组大鼠妊娠第17、21 天的血压与硫酸镁组没有明显差异(P>0.05);在妊娠第16 天时(给药前),各组大鼠血压变化差异无统计学意义(P>0.05),见表1。
表1 苦参碱对各组孕鼠不同时期血压的影响(±s,n=12,mmHg)Table 1 Effect of matrine on blood pressure of pregnant rats in different periods

表1 苦参碱对各组孕鼠不同时期血压的影响(±s,n=12,mmHg)Table 1 Effect of matrine on blood pressure of pregnant rats in different periods
注:与正常对照组比较,aP<0.05;与模型对照组比较,bP<0.05;与低剂量苦参碱组比较,cP<0.05。 下表同。Note. Compared with normal control group,aP<0.05. Compared with model control group,bP<0.05. Compared with low dose matrine group,cP<0.05.The same in the following tables.
组别Groups 第12 天 D12 第16 天 D16 第17 天 D17 第21 天 D21正常对照组Normal control group 108.12±7.15 109.59±7.08 110.48±7.21 110.91±6.53模型对照组Model control group 109.42±8.51 136.94±6.89a 138.63±6.94a 152.34±7.75a低剂量苦参碱组Low dose matrine group 109.78±7.92 135.53±6.92a 124.61±7.12ab 121.46±7.42ab高剂量苦参碱组High dose matrine group 110.26±8.16 135.48±6.94a 112.74±7.34bc 106.57±7.48bc硫酸镁组Magnesium sulfate group 111.32±8.23 135.59±7.03a 112.52±7.65bc 104.61±7.23bc
2.2 苦参碱对各组孕鼠不同时期24 h 尿蛋白含量的影响
模型对照组与正常对照组相比,TNF-α、IL-6 水平提高,IL-10 水平降低(P<0.05)低、高剂量苦参碱组和硫酸镁组与模型对照组相比,TNF-α、IL-6 水平下降,IL-10 水平上升(P<0.05),不同剂量苦参碱组的指标差异显著(P<0.05),而高剂量苦参碱组与硫酸镁组中的TNF-α、IL-6、IL-10 含量无显著变化(P>0.05),见表4。
表4 苦参碱对各组孕鼠炎症反应的影响(±s,n=12)Table 4 Effects of matrine on inflammatory response of pregnant rats in each group

表4 苦参碱对各组孕鼠炎症反应的影响(±s,n=12)Table 4 Effects of matrine on inflammatory response of pregnant rats in each group
组别Groups TNF-α(pg/mL)IL-6(pg/mL)IL-10(pg/mL)正常对照组Normal control group 136.48±32.13 133.75±3.68 281.57±41.35模型对照组Model control group 265.69±28.42a 239.42±18.49a 154.63±31.46a低剂量苦参碱组Low dose matrine group 183.74±21.36ab 193.54±26.13ab 223.17±39.24ab高剂量苦参碱组High dose matrine group 138.25±24.45bc 137.57±17.51bc 276.62±40.15bc硫酸镁组Magnesium sulfate group 137.64±23.28bc 135.82±15.24bc 278.98±41.23bc
2.5 苦参碱对各组孕鼠血管内皮细胞中活性物质的影响
各组大鼠妊娠第12 天时(造模前)的24 h 尿蛋白含量差异不明显,不具有统计学意义(P>0.05);模型对照组大鼠妊娠第16、17、21 天的24 h 尿蛋白含量显著高于正常对照组(P<0.05);低、高剂量苦参碱组、硫酸镁组大鼠妊娠第17、21 天的24 h 尿蛋白含量显著低于模型对照组(P<0.05),且随着苦参碱剂量的增加,大鼠24 h 尿蛋白含量依次降低(P<0.05),见表2。
表2 苦参碱对各组孕鼠不同时期24 h 尿蛋白含量的影响(±s,n=12,mg)Table 2 Effects of matrine on 24 h urinary protein content in pregnant rats at different periods
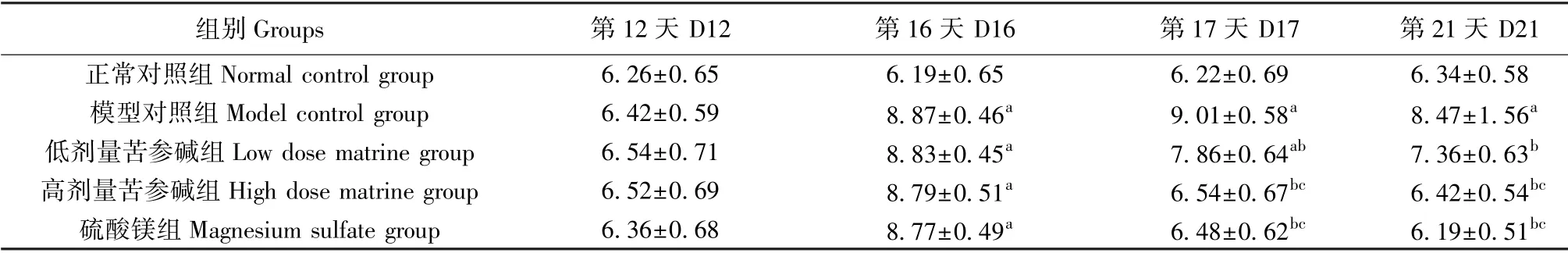
表2 苦参碱对各组孕鼠不同时期24 h 尿蛋白含量的影响(±s,n=12,mg)Table 2 Effects of matrine on 24 h urinary protein content in pregnant rats at different periods
组别Groups 第12 天 D12 第16 天 D16 第17 天 D17 第21 天 D21正常对照组Normal control group 6.26±0.65 6.19±0.65 6.22±0.69 6.34±0.58模型对照组Model control group 6.42±0.59 8.87±0.46a 9.01±0.58a 8.47±1.56a低剂量苦参碱组Low dose matrine group 6.54±0.71 8.83±0.45a 7.86±0.64ab 7.36±0.63b高剂量苦参碱组High dose matrine group 6.52±0.69 8.79±0.51a 6.54±0.67bc 6.42±0.54bc硫酸镁组Magnesium sulfate group 6.36±0.68 8.77±0.49a 6.48±0.62bc 6.19±0.51bc
2.3 苦参碱对各组孕鼠氧化应激的影响
模型对照组与正常对照组比较,SOD 含量显著下降,MDA 含量显著升高(P<0.05);与模型对照组比较,低、高剂量苦参碱组大鼠SOD 含量依次升高,MDA 含量依次降低(P<0.05),而SOD 与MDA 在高剂量苦参碱组与硫酸镁组中的含量差异不明显(P>0.05),见表3。
表3 苦参碱对各组孕鼠氧化应激的影响(±s,n=12)Table 3 Effects of matrine on oxidative stress of pregnant rats in each group
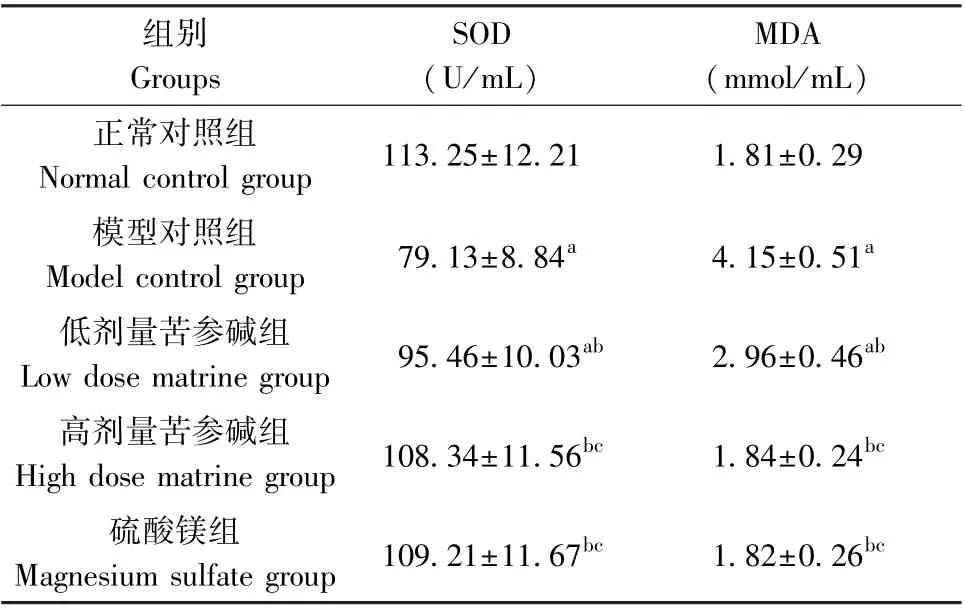
表3 苦参碱对各组孕鼠氧化应激的影响(±s,n=12)Table 3 Effects of matrine on oxidative stress of pregnant rats in each group
组别Groups SOD(U/mL)MDA(mmol/mL)正常对照组Normal control group 113.25±12.21 1.81±0.29模型对照组Model control group 79.13±8.84a 4.15±0.51a低剂量苦参碱组Low dose matrine group 95.46±10.03ab 2.96±0.46ab高剂量苦参碱组High dose matrine group 108.34±11.56bc 1.84±0.24bc硫酸镁组Magnesium sulfate group 109.21±11.67bc 1.82±0.26bc
与正常对照组相比,模型对照组孕鼠血清ET和TXB2 增加、NO 和6-keto-PGF1α 减少,且差异有统计学意义(P<0.05);与模型对照组相比,低、高剂量苦参碱组孕鼠血清ET 和TXB2 呈剂量依赖性降低、NO 和6-keto-PGF1α 呈剂量依赖性升高(P<0.05),而高剂量苦参碱组与硫酸镁组中的上述指标差异不大(P>0.05),见表5。
表5 苦参碱对各组孕鼠血管内皮细胞中活性物质的影响(±s,n=12)Table 5 Effects of matrine on active substances in vascular endothelial cells of pregnant rats in each group

表5 苦参碱对各组孕鼠血管内皮细胞中活性物质的影响(±s,n=12)Table 5 Effects of matrine on active substances in vascular endothelial cells of pregnant rats in each group
组别Groups ET(pg/mL) NO(pg/mL) TXB2(pg/mL) 6-keto-PGF1α(pg/mL)正常对照组Normal control group 2.65±0.41 28.34±3.53 405.61±33.48 584.74±45.12模型对照组Model control group 6.97±0.95a 14.65±2.89a 649.74±51.65a 371.35±39.48a低剂量苦参碱组Low dose matrine group 3.89±0.64ab 21.36±3.04ab 523.57±48.62ab 456.34±41.57ab高剂量苦参碱组High dose matrine group 2.73±0.52bc 27.95±3.12bc 436.41±43.15bc 569.45±43.96bc硫酸镁组Magnesium sulfate group 2.71±0.49bc 28.11±3.23bc 435.24±41.34bc 574.63±45.78bc
2.6 苦参碱对各组孕鼠胎盘组织中JAK2/STAT3/SOSC1 信号通路蛋白表达的影响
模型对照组p-JAK2/JAK2 与p-STAT3/STAT3值及SOSC1 蛋白水平明显高于正常对照组(P<0.05);与模型对照组相比,低、高剂量苦参碱组p-JAK2/JAK2 与p-STAT3/STAT3 值及SOSC1 蛋白水平依次下降,表现为剂量依赖性(P<0.05),而高剂量苦参碱组与硫酸镁组中蛋白表达水平均无显著差异(P>0.05),见图1 和表6。
表6 苦参碱对各组孕鼠胎盘组织中JAK2/STAT3/SOSC1信号通路蛋白表达的影响(±s,n=12)Table 6 Effects of matrine on protein expression of JAK2/STAT3/SOSC1 signaling pathway in placental tissues of pregnant rats in each group
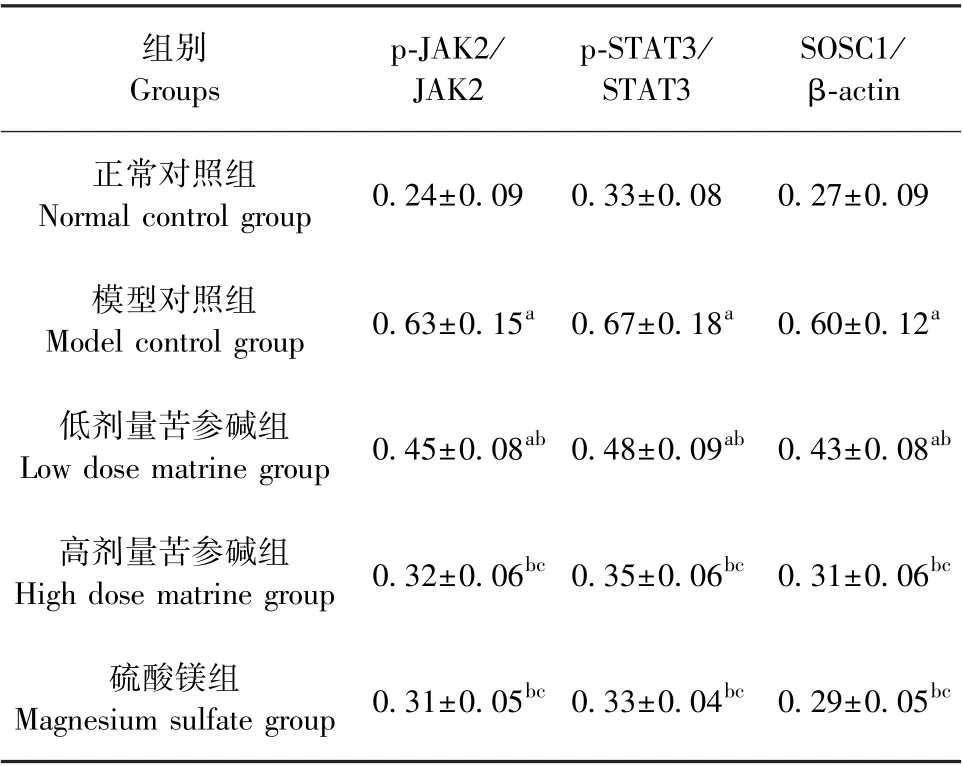
表6 苦参碱对各组孕鼠胎盘组织中JAK2/STAT3/SOSC1信号通路蛋白表达的影响(±s,n=12)Table 6 Effects of matrine on protein expression of JAK2/STAT3/SOSC1 signaling pathway in placental tissues of pregnant rats in each group
组别Groups p-JAK2/JAK2 p-STAT3/STAT3 SOSC1/β-actin正常对照组Normal control group 0.24±0.09 0.33±0.08 0.27±0.09模型对照组Model control group 0.63±0.15a 0.67±0.18a 0.60±0.12a低剂量苦参碱组Low dose matrine group 0.45±0.08ab 0.48±0.09ab 0.43±0.08ab高剂量苦参碱组High dose matrine group 0.32±0.06bc 0.35±0.06bc 0.31±0.06bc硫酸镁组Magnesium sulfate group 0.31±0.05bc 0.33±0.04bc 0.29±0.05bc
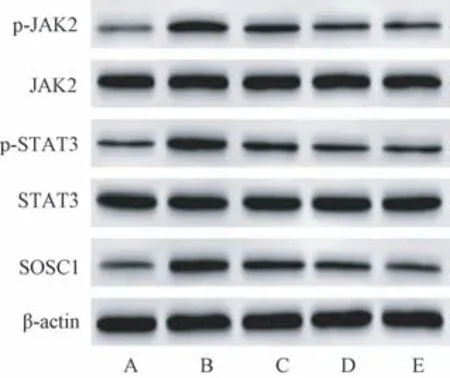
图1 各组孕鼠胎盘组织中JAK2/STAT3/SOSC1信号通路蛋白免疫印迹图Note. A, Normal control group. B, Model control group. C, Low dose matrine group. D, High dose matrine group. E, Magnesium sulfate group.Figure 1 Western blot of JAK2/STAT3/SOSC1 signaling pathway in placental tissues of pregnant rats in each group
3 讨论
PIH 的主要并发症是血管内皮损伤和功能障碍,对产妇和围产儿都有非常严重的影响[17]。 其临床表现主要是妊娠后期孕妇血压的持续升高和尿蛋白含量的增多。 硫酸镁是目前临床上用来缓解PIH 疾病的一种药物,既能有效的降低孕妇的血压,又不会对胎儿的血压和健康产生影响,故硫酸镁经常被用作PIH 大鼠实验的阳性对照[18]。 本研究发现,通过灌胃L-NAME 制备的PIH 模型大鼠妊娠第17、21 天的血压及24 h 尿蛋白含量均明显升高(P<0.05),这与通过皮下注射L-NAME 构建的PIH 模型大鼠的结果类似[19],提示PIH 大鼠造模成功,可进行深入研究。
苦参碱是四环素-喹诺列齐啶类生物碱,是提取自苦参的活性物质,有清热、利尿、抗病毒、抗肿瘤等作用[20]。 国内外研究显示,苦参碱不仅可以减轻缺血再灌注大鼠心肌损伤,还对缺氧/复氧诱导的大鼠心脏微血管内皮细胞凋亡有保护作用[21-22]。苦参碱可通过降低MDA 含量及TNF-α 等促炎因子水平、提高SOD 含量发挥其抗氧化和抗炎作用[23-24]。 ET、TXB2、NO 和6-keto-PGF1α 由血管内皮细胞分泌而来,是血管活性标志物,与血管平滑肌细胞增殖的调节和血管张力有关。 ET 是调节血压的一种收缩因子,其过量表达使得内皮通透性增加,致使胎盘受损[25]。 NO 参与调节妊娠期血管舒张和反应性,其含量的下降可引发高血压。 TXB2和6-keto-PGF1α 分别为 TXA2 和前列腺素2(PG12)的代谢稳定形式,正常情况下,二者是一种相互拮抗、相互作用的动态平衡关系,是保持机体血压正常的基础,但在原发性高血压患者中TXB2显著上调,6-keto-PGF1α 显著下调,二者的平衡关系被打破[26]。 本研究发现低、高剂量苦参碱及硫酸镁干预均可显著降低PIH 大鼠的血压和24 h 尿蛋白含量、减缓血管受损(ET、TXB2 含量降低,NO、6-keto-PGF1α 含量升高),提示苦参碱可以明显改善PIH 大鼠血压、尿蛋白,降低血管受损程度。
据报道PIH 与氧化应激,血管内皮损伤、胎盘营养不良等因素有关[27]。 孕妇早期身体上出现的炎症对孕妇不会造成影响,只是一种生理应激反应。 子痫是PIH 疾病的一种,在其孕妇胎盘或血清中的炎症因子水平比正常孕妇高出许多[28]。 在PIH 大鼠中,MDA 水平上升,SOD 活性下降,进而使大鼠体内的氧化应激损伤加重[13,29]。 机体过度的氧化应激诱发炎症因子的表达,TNF-α、IL-6 是促进炎症的细胞因子,IL-10 是抵抗炎症的细胞因子。 魏双燕等[30]发现在PIH 大鼠血清中TNF-α、IL-6 显著上调,IL-10 显著下调。 JAK2/STAT3/SOSC1 信号通路与炎症的发生有关[31]。 而近年的研究发现,JAK2/STAT3 通路在PIH 模型大鼠体内被激活,JAK2、STAT3 磷酸化水平的增高诱导SOSC1 蛋白表达,当使用JAK2 抑制剂A490 处理后,上述蛋白表达水平均被减弱,PIH 症状也得到缓解[8]。 本研究发现PIH 大鼠组织中JAK2、STAT3 磷酸化及SOSC1蛋白表达水平、血清炎症反应(TNF-α、IL-6 水平升高,IL-10 水平降低)及氧化应激水平(MDA 含量升高,SOD 含量降低)明显升高,提示PIH 的发生机制可能与炎症反应、氧化应激受损有关。 而低、高剂量苦参碱及硫酸镁干预均可降低炎症反应,提高抗氧化应激水平,抑制JAK2、STAT3 磷酸化及SOSC1蛋白表达水平,表明苦参碱可以减轻PIH 大鼠炎症反应,抑制JAK2、STAT3 磷酸化及SOSC1 的活化,提高抗氧化能力进而减缓内皮损伤。
综上所述,苦参碱可降低PIH 模型大鼠的血压及尿蛋白含量,抑制JAK2、STAT3 磷酸化及SOSC1的表达,改善其氧化应激及炎症反应导致的内皮损伤,为苦参碱在临床上治疗PIH 提供理论依据,但由于PIH 发病机制复杂,后续还需深入研究。

