PDTC对载脂蛋白E基因敲除小鼠血清SDF-1、IL-1β、TNF-α表达及主动脉粥样硬化病变的影响*
周明, 路艳林, 彭进, 万昌武, 戴佳琳, 王杰*, 夏冰*
(贵州医科大学 法医学院, 贵州 贵阳 550004)
近年来,冠心病(coronary heart disease,CHD)的发病年龄趋向于年轻化,动脉粥样硬化(atherosclerosis,AS)作为其基础病理变化的同时,越来越多的炎症因子在斑块内被检测到[1-3]。最近卡那单抗抗炎血栓结局研究(canakinumab antiinflammatory thrombosis outcome study, CANTOS)试验表明白细胞介素1β(interleukin-1β,IL-1β)抗体可以降低AS引起的心脏事件和死亡[4],此后,药物抗炎治疗作为一种经典的治疗途径逐渐被应用于AS的治疗。多项研究显示,吡咯烷二硫代氨基甲酸(pyrrolidine dithiocarbamate,PDTC)可以通过多种方式在不同的组织器官中减轻炎症反应[5-9],国内外研究针对PDTC对AS的研究多见于利用PDTC作为抑制剂探究其对核转录因κB(nuclear factor kappa B, NF-κB)的作用效果,但极少有直接关于阐述PDTC干预后血清学炎症因子的表达与AS斑块面积大小的文献报道,本研究通过建立小鼠AS模型、腹腔注射60 mg/kg PDTC进行干预[10],检测小鼠主动脉AS斑块面积及血清中基质细胞衍生因子-1(stromal cell-derived factor-1, SDF-1)、IL-1β及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达水平,探讨PDTC对小鼠血清SDF-1、IL-1β、TNF-α等蛋白表达及AS的影响。
1 材料与方法
1.1 实验材料
1.1.1动物来源 24只6周龄雄性载脂蛋白E基因敲除(apolipoprotein E-/-,ApoE-/-)小鼠[由北京维通利华实验动物技术有限公司提供[SCXK(京)2016-0006],体质量18~24 g,适应性饲养1周。
1.1.2主要试剂和仪器 小鼠TNF-α、IL-1β、SDF-1 ELISA试剂盒(中国艾方生物科技有限公司),PDTC(美国MERCK公司);麦克奥迪数字切片扫描与应用系统(中国麦克奥迪公司),光学显微镜(日本Olympus公司),高速离心机(美国Thermo Fisher公司),酶标仪(美国雷杜生命科学股份有限公司),988洗板机(北京天石天力医疗器械技术开发中心),电热恒温培养箱(武汉恒苏净科学仪器有限公司)。
1.2 研究方法
1.2.1造模、分组及取材 24只ApoE-/-小鼠按照随机数字表法均分为对照(control group,CON)组、高脂喂养组(high-fat diet group,HFD组及PDTC组,CON组ApoE-/-小鼠全程给予普通饲料喂养,HFD组及PDTC组ApoE-/-小鼠全程给予高脂饲料(配方为3%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、5%白糖、10%猪油及81.3%基础饲料)喂养;PDTC组ApoE-/-小鼠在高脂饲料喂养至第5周时腹腔注射60 mg/kg PDTC,HFD组ApoE-/-小鼠注射等量生理盐水,2次/周;3组ApoE-/-小鼠喂养16周,麻醉处死,非抗凝采血管取血,高速离心机3 500 r/min离心10 min,取上清液-80 ℃留存;取各组ApoE-/-小鼠主动脉,4%多聚甲醛固定。
1.2.2苏木精-伊红染色法(hematoxylin-eosin staining, HE)染色及小鼠主动脉根部血管AS面积大小的测量 取“1.2.1”项下各组ApoE-/-小鼠主动脉,常规石蜡包埋,血管横断面制作4 μm切片;石蜡切片经二甲苯、下行梯度酒精脱蜡至水,放入Harris苏木素染液,1%盐酸酒精分化,自来水冲洗,0.1%氨水返蓝,再放入伊红染液染色;切片依次放入上行梯度酒精脱水、二甲苯透明,稍晾干后中性树胶封片、镜检、图像采集分析;运用麦克奥迪数字切片扫描与应用系统观察ApoE-/-小鼠血管组织HE切片,并进行血管内AS面积大小的测量。
1.2.3ELISA检测血清SDF-1、IL-1β及TNF-α表达 取“1.2.1”项下各组ApoE-/-小鼠血清,采用SDF-1、IL-1β及TNF-α试剂盒进行检测;在酶标包被板上设置标准品孔各加不同浓度的标准品50 μL、空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔;在待测样品孔中先加样品稀释液40 μL,加待测样品10 μL(样品最终稀释度为5倍);每孔加酶标试剂100 μL,空白孔除外;封板膜封板,置37 ℃温育60 min;20倍浓缩洗涤液用蒸馏水20倍稀释后备用;重复洗板5次,拍干,加显色剂A 50 μL,再加显色剂B 50 μL,37 ℃避光显色15 min;加终止液50 μL/孔;以空白孔调零,450 nm 波长依序测量各孔的吸光度(optical density,OD )。
1.3 统计学分析

2 结果
2.1 AS斑块
HE切片显示,CON组ApoE-/-小鼠主动脉血管内膜光滑完整、弹性纤维排列整齐、管腔未见AS病灶,HFD组ApoE-/-小鼠主动脉内膜明显增生、管腔局部见巨大AS斑块向管腔内膨隆、病灶内见空泡样泡沫细胞堆积、纤维增生且排列紊乱,PDTC组小鼠主动脉血管内形成的AS斑块面积明显小于HFD组,差异有统计学意义(P<0.05,图1和表1)。
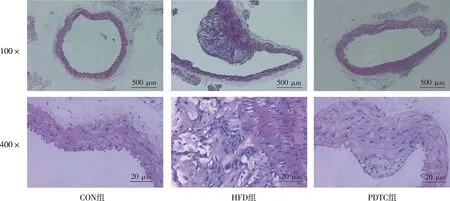
图1 各组ApoE-/-小鼠主动脉内膜组织学(HE)Fig.1 Aortic intimal histology of ApoE-/- mice in each group (HE)

表1 各组ApoE-/-小鼠主动脉内膜AS斑块面积Tab.1 Aortic intimal AS plaque area of ApoE-/- mice in each group
2.2 血清SDF-1、IL-1β及TNF-α水平
ELISA试剂盒检测各组ApoE-/-小鼠血清中SDF-1、IL-1β、TNF-α水平,结果显示,与CON组相比,HFD组ApoE-/-小鼠血清SDF-1、IL-1β及TNF-α增高(P<0.05);与HFD组比较,PDTC组ApoE-/-小鼠血清SDF-1、IL-1β及TNF-α水平降低(P<0.05,表2)。

表2 各组ApoE-/-小鼠血清中SDF-1、IL-1β及TNF-α的水平Tab.2 Levels of serum SDF-1, IL-1β, and TNF-α of ApoE-/- mice in each group
2.3 血清SDF-1、IL-1β、TNF-α水平与AS斑块面积大小的相关性
将所有ApoE-/-小鼠血清SDF-1、IL-1β、TNF-α水平与AS斑块面积大小Perason相关性分析,结果显示,血清中SDF-1、IL-1β、TNF-α水平与AS斑块面积呈正相关关系(P<0.05,表3)。
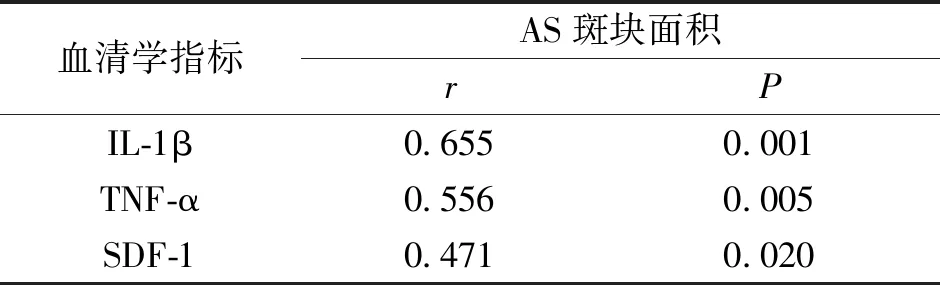
表3 ApoE-/-小鼠血清SDF-1、IL-1β、TNF-α水平与AS斑块面积大小的相关性Tab.3 Correlation analysis between serum levels of SDF-1, IL-1β, TNF-α, and atherosclerotic plaque area size in ApoE-/- mice
3 讨论
随着AS斑块内炎症因子不断被检测出,AS逐渐被认为是一种慢性进行性炎症疾病,是心肌梗死和中风的根本原因,亦是世界范围内的主要死亡原因[11]。以往研究表明,AS斑块是最重要的临床病理特征,以白细胞浸润和脂质积聚为特征[12]。本课题组前期研究表明,持续性的动脉炎症可引起AS斑块稳定性变化,造成斑块内发生出血、破裂,进而导致猝死的发生[13]。因此,对炎症反应进行早期干预、控制将有益于降低AS引起的CHD猝死等不良事件的发生。
目前研究认为,TNF-α及IL-1β作为NF-κB下游经典炎性因子在各种炎性疾病当中被广泛检测,其表达的变化反映炎性反应强度,而PDTC对NF-κB下游的炎症抑制作用已经被证实[14-17]。相比NF-κB下游炎性因子的研究,PDTC对SDF-1的作用研究相对较少,SDF-1来自于CXC趋化因子家族,又称趋化因子12 (chemokine receptor12, CXCL12) ,由人类第10号染色体上的基因编码以及由68个氨基酸构成的细胞因子,具有强大的细胞趋化作用,CXCL12通过与CXCR4或CXCR7结合来调节细胞活性,这两种受体蛋白位于细胞膜上,导致多种细胞内信号通路的激活[18-19]。最近,生物信息学技术对AS芯片数据进行差异分析的筛选鉴定结果也发现了SDF-1参与AS发展进程,SDF-1的来源可能是通过泡沫细胞、内皮细胞的分泌[20-22];促进AS的机制可能是依赖于动脉内皮细胞产生SDF-1,从而募集单核巨噬细胞沉积在内皮下,进而单核巨噬细胞吞噬脂质等物质形成泡沫细胞[23-24]。Gao等[25]研究发现,SDF-1通过下调ATP结合盒转运体A1(ATP binding cassette transporter A1,ABCA1)的表达,进而减少巨噬细胞的胆固醇外流来加速AS;杨颖博等[26]研究发表明,急性冠脉综合征血清中SDF-1水平明显下降,且随着病情加重,其水平亦呈下降趋势;刘卫清等[27]结果提示急性心梗患者外周血SDF-1浓度上升。本研究结果显示,HFD组中ApoE-/-小鼠主动脉SDF-1、TNF-α及IL-1β水平较CON组升高、且相应的AS斑块面积也增大,但给予PDTC后,SDF-1、TNF-α及IL-1β水平及AS斑块面积均有降低,同时相关性分析结果也表明,血清中SDF-1、TNF-α及IL-1β的水平与ApoE-/-小鼠AS斑块面积存在正相关关系。这一结果可能是PDTC降低了ApoE-/-小鼠血清中SDF-1、TNF-α及IL-1β等炎性蛋白,降低AS斑块面积的大小,从而减轻了AS的病变程度。
综上所述,PDTC可以通过降低ApoE-/-小鼠血清中SDF-1、IL-1β及TNF-α的表达,从而减轻AS病变。

