聚乳酸纳米纤维基载药敷料的制备与表征
李 亮, 裴斐斐, 刘淑萍, 田苏杰, 许梦媛, 刘让同, 海 军
(1.中原工学院 纺织学院, 河南 郑州 451191; 2.郑州大学 第一附属医院, 河南 郑州 450052; 3.中原工学院 服装学院, 河南 郑州 451191; 4.江南大学 纺织科学与工程学院, 江苏 无锡 214122)
敷料是医疗卫生应用中重要的辅助材料,主要有棉纱类[1]、壳聚糖类[2]、海藻酸盐类[3]、胶原蛋白类[4]、含炭类[5]、聚氨酯(PU)泡沫类[6]、水凝胶类[7]、银离子类[8]、功能复合类[9]等,具有覆盖、隔离、吸-放液等功能,可应用于受损皮肤界面。受损皮肤修复一般会经历炎症期、修复期及成熟期3个阶段[10]。对处于炎症期的伤口,敷料应具有减小炎症或抗炎功能;伤口处于修复期时,敷料应能维持创伤界面湿润清洁,以促进肉芽组织形成,减少愈合时间,使伤口无痂皮愈合。早期医用敷料主要以伤口隔离、吸液为目的,使伤口在干燥无菌条件下愈合。1962年,WINTER博士证实了伤口在无菌、低氧、湿润条件下,有利于细胞增殖和愈合[11];较多学者基于“湿性愈合理论”提出了丰富的医用敷料构筑策略[12]。
纳米纤维所构筑的纤维集合体,具有较好的多孔性及孔隙连通性,高比表面积和优异的阻隔性能,该特性利于药物的封装与有效的释放。常见的医用纳米纤维敷料可分为天然聚合物和合成聚合物两类,天然聚合物具有促进伤口愈合功效如:壳聚糖、纤维素、胶原蛋白[13]、明胶、丝素[14]等。合成聚合物用于医用敷料如:聚乳酸、聚氯乙烯和聚乙烯醇,较天然聚合物具有优异的力学性能和易加工性。MALEKI[15]、HONGYAN[16]等研究表明,聚乳酸纳米纤维对皮肤胶原和血管的生产具有积极作用,加速伤口愈合速度。因此,聚乳酸纳米纤维集合体因其优异的力学性能、可生物降解性适宜医用敷料。然而理想的敷料须具有优异的抑菌性能,抗菌载药处理是有效解决方案,ALEXA-MARIA[9]、吴焕岭[17]、唐志敏等[18]以抗菌药物分别在聚己内酯、细菌纤维素以及聚乙烯醇/海藻酸钠共混纳米纤维集合体进行载药,制备了具有抗菌功效的伤口敷料。
阿莫西林属于半合成的广谱β-内酰胺类抗生素,具有杀菌强、吸收快、毒性低等优点,目前临床广泛应用,然而高剂量使用过程中药物突释现象对人体易造成严重副作用[19]。聚乳酸纳米纤维具有优异的药物释放特性,将其作为载体,采用阿莫西林与聚乳酸纺丝原液掺杂的方式,使阿莫西林分布于纳米纤维内外,有望解决其药物突释现象,进而控制药物释放速度,规避其高剂量突释诱发的毒副作用。本文以聚乳酸为原料,掺杂不同质量分数阿莫西林,通过静电纺丝技术制备具有孔隙率高、比表面积大、贴附能力强、柔软、抗炎等特征的纳米纤维膜,并探索其用于医用敷料时的润湿性、体外降解、药物缓释、抗菌性。
1 实验部分
1.1 实验材料
聚乳酸(相对分子质量为85 000,武汉海山科技有限公司)、金黄色葡萄球菌菌株(纽辉生物有限公司)、大豆琼脂(北京缘生化科技有限公司);氯仿(分析纯,河南华文化工有限公司)、阿莫西林(纯度≥98%,哈药集团制药总厂);磷酸盐缓冲液(PBS),自制。
1.2 聚乳酸纳米纤维基载药敷料制备
纺丝液:将聚乳酸溶解于氯仿溶剂中配成质量分数为9%的纺丝液,添加相对于纺丝液中聚乳酸质量分别为1%、2%、3%的阿莫西林,60 ℃恒温搅拌6 h至完全溶解。
聚乳酸纳米纤维基载药敷料:将上述纺丝液注入计量泵在静电纺丝机上进行纺丝,相关参数为:纺丝电压15 kV、推进速度3 mL/h、接收距离20 cm、接收辊转速100 r/min,室温进行纺丝。并将制备的载药纳米纤维敷料置于真空干燥箱中干燥48 h,去除纤维中残留溶剂。
1.3 测试与表征
纺丝液性质测试:分别采用数显电导率仪和AR-1500ex型流变仪,对不同载药量聚乳酸纺丝液的电导率和黏度进行测试。
形貌特征:采用TM3000型扫描电子显微镜(SEM) 观察聚乳酸纳米纤维基载药敷料的形貌特征,喷金100 s,加速电压为20 kV。
化学结构:采用Tensor37型红外光谱仪和Ultima IV型X射线衍射(XRD)仪对聚乳酸基纳米纤维载药敷料进行化学结构分析,扫描范围为4 000~400 cm-1,2θ为5°~90°。
润湿性:采用德国OCA2型接触角测试仪,借助悬浮液滴法测量接触角,注入液态水量为3 μL,当水滴达到平衡时角度即为接触角。
体外降解:将聚乳酸纳米纤维基载药敷料(0.05 g)浸入PBS缓冲液(10 mL),置于恒温柜中,温度37.5 ℃,分别于12、24、48、72、96、120、144、168、192 h后取出样品,清水洗净、烘干称量,计算质量累计降解率。
药物缓释:将聚乳酸纳米纤维基载药敷料(0.05 g)分别浸入pH值为5.5与pH值为7.5 的PBS缓冲液(10 mL),置于温度37.5 ℃恒温柜中进行药物释放,在0.5、1、1.5、2、4、8、16、32、48、72、84、90、100、120、140、160、180 h时间点分别取出释放液1 mL,同时补入温度37.5 ℃的缓冲液1 mL。采用UV-1100紫外分光光度计测定释放介质在273 nm下的吸光度,计算药物累计释放量。
抗菌性:选取金黄色葡萄球菌,将聚乳酸纳米纤维基载药敷料进行紫外光照射杀菌30 min,浸于300 μL菌液中,放入培养箱中培养24 h。用紫外分光光度计测定液体600 nm的吸光度,按下式[2]计算抑菌率:
式中:R为抑菌率,%;Ac为培养细菌悬浮液的吸光度(不含敷料);As表示培养细菌悬浮液的吸光度(含敷料)。
选取金黄色葡萄球菌,在大豆琼脂培养基平板表面均匀涂抹,将1 cm×1 cm的方形聚乳酸纳米纤维基载药敷料固定在琼脂表面,置于恒温37 ℃培养箱中培养24 h,记录抑菌效果。
2 结果与讨论
2.1 形貌特征
多孔结构的纳米纤维膜可为细胞增殖提供空间、为营养物质的供应提供路径,同时具有高氧气渗透率,有利于渗出液的排出,保护伤口免受感染和脱水[12]。通过静电纺丝技术制备聚乳酸纳米纤维敷料,其扫描电镜照片如图1所示。观察可知,敷料中纤维直径与载药量密切相关,聚乳酸纳米纤维敷料其纤维平均直径为1 230 nm,而载药敷料纤维平均直径分别为807 nm(载药量为1%)、756 nm(载药量为2%)、684 nm(载药量为3%),如图2所示。随载药量的增加单纤维直径降低,是因为聚乳酸纺丝液加入阿莫西林后,纺丝液的电导率有一定程度的提高,增大了静电场对纺丝细流牵引力,其中,不同载药量聚乳酸纺丝液的黏度和电导率参数见表1。

图1 聚乳酸纳米纤维基载药敷料扫描电镜照片(×20 000)Fig.1 SEM images of polylactic acid nanofiber drug loaded dressing(×20 000). (a) Polylactic acid nanofiber; (b) Doped with 1% amoxicillin; (c) Doped with 2% amoxicillin;(d) Doped with 3% amoxicillin

图2 聚乳酸纳米纤维基载药敷料纤维直径分布直方图Fig.2 Fiber diameter distribution histogram of polylactic acid nanofiber drug loaded dressing. (a) Polylactic acid nanofiber; (b) Doped with 1% amoxicillin; (c) Doped with 2% amoxicillin; (d) Doped with 3% amoxicillin

表1 不同载药量聚乳酸纺丝液的性质Tab.1 Solution property of PLA with different drug loadings
聚乳酸纤维间存在丰富的孔隙,具有多孔材料结构特征,首先是敷料中纤维直径细化有利于多孔结构的形成,增加了敷料的孔隙率、比表面积、柔软及通透性;其次是掺杂不同质量分数阿莫西林,使聚乳酸纳米纤维形成粗糙界面,从图1中也可观察到附着于纤维表面的颗粒,随载药量增加,附着颗粒现象愈明显,表明阿莫西林负载于聚乳酸纳米纤维敷料中。由于阿莫西林在聚乳酸纺丝液制备过程以掺杂方式添加,阿莫西林存在于纤维表面和内部,正是由于纤维内部阿莫西林的存在,使载药敷料具有平缓的药物释放能力。
实验组完全缓解30例,部分缓解13例,没有缓解2例,总有效率为95.56%,参照组完全缓解20例,部分缓解17例,没有缓解8例,总有效率为82.22%,组间数据对比,χ2=4.050 0,P=0.044 1,差异有统计学意义。
2.2 化学结构
借助红外光谱分析聚乳酸纳米纤维基载药敷料化学结构,结果如图3所示。可知,聚乳酸敷料吸收峰值主要由3 506、3 000、2 924、1 760、1 456、1 086 cm-1组成,其中3 506 cm-1处吸收峰由羟基伸缩振动产生,3 000与2 924 cm-1处吸收峰源于碳氢伸缩振动峰、1 760 cm-1处吸收峰主要由于羰基伸缩振动产生,1 456 cm-1处吸收峰由CH3不对称弯曲振动产生,1 086 cm-1处吸收峰归属于酯基不对称振动产生[9]。载药后敷料主要吸收峰值未发生明显变化,说明阿莫西林与聚乳酸并没有发生化学反应,阿莫西林未被改性,但在3 506 cm-1处吸收峰值随敷料中阿莫西林载药量的增加而逐渐增强,归结于阿莫西林中的羟基与聚乳酸中羟基协同伸缩振动所致,这也说明阿莫西林被成功负载。
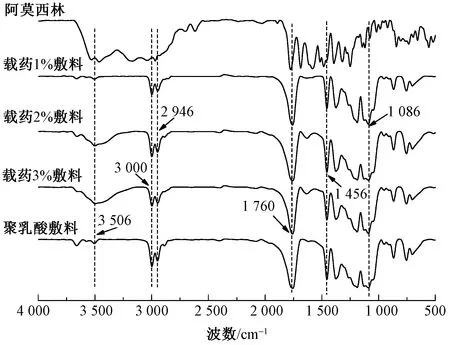
图3 聚乳酸纳米纤维载药敷料红外光谱图Fig.3 Infrared spectra of polylactic acid nanofiber drug loaded dressing
借助X射线衍射分析聚乳酸纳米纤维基载药敷料的聚集态结构,结果如图4所示。不难发现,聚乳酸敷料衍射峰峰形平缓,在2θ为15.1°附近存在衍射峰,载药后敷料在2θ为15.1°、22.05°附近均出现衍射峰。聚乳酸晶体生长过程,晶体生长速率与纺丝液黏度相关[20],纺丝液黏度低,聚乳酸分子链活动能力增加,晶体生长速率提高,结晶速度增加,结晶度提高。由表1不难发现,掺杂阿莫西林后,聚乳酸纺丝液黏度随其掺杂阿莫西林质量分数的增加而下降,提高了聚乳酸的结晶速度,使其结晶度增加,进而出现图4中载药敷料衍射峰峰形较未载药敷料的衍射峰峰形更加突出。

图4 聚乳酸纳米纤维载药敷料X射线衍射图Fig.4 X-ray diffraction pattern of polylactic acid nanofiber drug loaded dressing
2.3 润湿性
通过接触角测试反映敷料的润湿性,接触角愈大,敷料疏水性强。图5给出了载药前后聚乳酸纳米纤维敷料的接触角。可以发现,聚乳酸纳米纤维敷料液态水接触角为135°,表现为疏水性;当加入阿莫西林后,接触角有所下降,当载药量为1%、2%、3%时,敷料的接触角分别对应为129°、122°和110°,说明载药量的增加,敷料疏水性有所下降。其主要原因在于载药量增加使敷料中纤维直径下降,比表面积增加,进而提高敷料界面吸附能力,另外分布于纤维表面的阿莫西林本身具有亲水的羟基,有利于改善敷料的润湿性。伤口愈合要求敷料具有液体吸收和留存能力,润湿性适当改善是对这种需求的满足,因此,载药聚乳酸纳米纤维敷料有益于伤口愈合。

图5 聚乳酸纳米纤维载药敷料接触角Fig.5 Contact angle of polylactic acid nanofiber drug loaded dressing
2.4 自降解性
聚乳酸纳米纤维具有良好生物相容性、对药物不产生负面改性的优点,同时在人体内可自降解,降解机制如图6所示。聚乳酸纤维属于脂肪族聚酯类材料,大分子主链含有大量的酯基,空间位阻较小,在酸或碱的水溶液中,酯基遇到水分子易发生水解反应[21]。聚乳酸在降解的过程中会产生乳酸,使反应界面pH值下降,酸性条件下,H+含量增加,促进水解反应。聚乳酸敷料降解后,纤维机械性质下降,敷料去除过程中纤维易断裂,纤维与皮肤分离过程不易造成创伤面的二次损伤,镶嵌于皮肤内的纳米纤维可在人体内自降解,利于伤口小痂皮愈合。

图6 聚乳酸纳米纤维降解机制Fig.6 Degradation mechanism of polylactic acid nanofibers
图7(a)示出聚乳酸纳米纤维载药敷料降解曲线。在pH值为7.5时,48 h内累计降解率平缓,分别为3.3%(聚乳酸纳米纤维)、5.6%(载药1%)、5.7%(载药2%)、6.7%(载药3%),120 h内累计降解率分别为13.1%(聚乳酸纳米纤维)、14.7%(载药1%)、16.1%(载药2%)、17.2%(载药3%)。不难发现,敷料中载药量对降解率有明显影响,载药量越高,降解速度越快,这主要由于载药量增加,敷料纤维直径下降,比表面积增加,敷料吸收体液能力增强,增大纤维与体液的接触面积,阿莫西林易溶于体液,纤维释放阿莫西林后界面出现刻蚀,提高了体液在纤维界面的传输,使敷料降解速度加快。

图7 聚乳酸纳米纤维载药敷料降解曲线Fig.7 Degradation curve of polylactic acid nanofiber drug loaded dressing
聚乳酸降解过程中产生乳酸,易使敷料局部降解反应界面处于弱酸性环境,进而进一步考察了酸性条件下敷料的降解性能,由图7(b) 可知,敷料在pH值为 5.5时,48 h内累计降解率平缓,分别为3.67%(聚乳酸纳米纤维)、6.12%(载药1%)、6.35%(载药2%)、7.65%(载药3%),120 h内累计降解率13.98%(聚乳酸纳米纤维)、15.87%(载药1%)、17.23%(载药2%)、18.79%(载药3%)。在pH值为5.5的弱酸性环境下,敷料降解速度较pH值为7.5高,敷料的降解率均随时间增加而增加,在48 h内降解速率较慢,48~100 h降解速率有所提高,100~200 h间部分样品降解速率有所减缓。这主要归结于聚乳酸在酸性环境下,酯水解加快所致,同时也暗示了敷料在pH值为5.5与pH值为7.5环境下,敷料降解机制均为酯水解。
2.5 药物缓释
图8示出载药聚乳酸纳米纤维敷料阿莫西林体外模拟累计释放曲线。可以发现,在4 h内敷料药物释放速度较快,分别为8.8%(载药1%)、12.9%(载药2%)、15.5%(载药3%),当体液与敷料接触时,存在于纤维表面的阿莫西林会快速释放,且随载药量的增加而愈明显,图1扫描电镜图可进一步证明。4~100 h后药物释放速度下降,100 h后药物释放速度趋于平缓,敷料累计释放率分别为75%(载药1%)、78%(载药2%)、81%(载药3%),说明敷料具有较好的药物缓释能力。因此,敷料在180 h内,药物缓释趋势可分3个阶段。第1阶段在4 h内,敷料药物释放速度较快,主要由于纤维界面附着药物,以扩散作用分散于PBS缓冲液,另外,脱落后药物为纤维内部的药物快速释放提供有利通道,降低内部药物向外扩散阻力。第2阶段4~100 h内,敷料药物处于缓慢释放周期,由于PBS缓冲液向纤维内部渗透,敷料纤维内部的药物由外至内逐渐释放,进而使药物释放周期增加,扩散速度降低。PBS缓冲液中由于药物释放后使PBS缓冲液中药物浓度的不断增加,纤维内部药物浓度与PBS缓冲液药物浓度差缩小,进一步降低敷料药物释放速度。第3阶段100 h后,敷料药物释放速度趋于平缓,主要由于敷料中纤维界面与内部药物释放基本完成,药物进入纤维内部的概率与扩散出去的概率处于平衡状态。若使敷料药物完全释放,需要进一步提高释放时间,同时降低PBS缓冲液的药物浓度。载药量不同缓释速度存在差异,主要是由于敷料纳米纤维直径不同所致,纤维直径越小,敷料吸收体液能力越强,纤维界面附着的阿莫西林与PBS缓冲液接触概率增加,进而提高药物释放率,这也暗示了调控敷料纤维直径可控制载药敷料药物释放速率。因此,基于敷料在180 h内,药物缓释趋势可以看出,载药聚乳酸纳米纤维敷料具有药物缓释能力,释放速度较为平稳,有益于伤口愈合。

图8 聚乳酸纳米纤维载药敷料体外模拟累计释放曲线Fig.8 Simulated cumulative release curve of polylactic acid nanofiber drug loaded dressing in vitro
2.6 抗菌性
阿莫西林属于半合成的广谱β-内酰胺类抗生素,结构式如图9所示,其抗菌机制主要是抑制细菌细胞壁粘肽交联,造成细胞壁缺损,使菌体渗透压改变,导致菌体膨胀死亡,因此药物浓度对杀菌作用具有较大影响。图10示出了聚乳酸纳米纤维敷料载药量对金黄色葡萄球菌抗菌活性的影响。

图9 阿莫西林结构式Fig.9 Amoxicillin structural formula

图10 聚乳酸纳米纤维载药敷料抑菌率Fig.10 Antibacterial rate of polylactic acid nanofiber drug loaded dressing
由图10可知,聚乳酸纳米纤维敷料抑菌率为6%,这意味着聚乳酸纳米纤维敷料抗菌性效果较差。载药1%聚乳酸纳米纤维敷料抑菌率为76%,载药2%、3%聚乳酸纳米纤维敷料抑菌率分别为85%和91%,不难发现,随着载药量增加抗菌效果不断增加,培养皿中抗菌实物图也可进一步佐证该现象,这主要归因于阿莫西林优异的抗菌能力。另外,敷料中纤维直径随载药量增加而降低,这样可增加敷料的孔隙率与比表面积,提高了药物的释放速率,进而增加了阿莫西林与细菌的接触概率,改善了敷料的抗菌性能。因此,聚乳酸纳米纤维掺杂阿莫西林可以有效提高对金黄色葡萄球菌的抗菌性能,其抗菌性能随载药量增加而增加。
3 结 论
1)本文通过静电纺丝技术制备聚乳酸基纳米纤维载药敷料,并对其微观形貌、化学结构、润湿性能、体外降解、药物缓释和抗菌性能进行研究,该敷料能提供一个具有优良的通透性、良好的抗菌性,能隔菌湿润自降解,利于细胞繁殖与生长促创面愈合的医用敷料解决方案。
2)聚乳酸纳米纤维敷料具有多孔结构,敷料纤维直径随载药量增加而降低,载药量增加,敷料纤维界面附着颗粒现象愈明显。红外光谱与X射线衍射结果表明,聚乳酸基纳米纤维敷料载入阿莫西林,阿莫西林与聚乳酸并没有发生化学反应,阿莫西林未出现负面改性,确保药效。
3)聚乳酸纳米纤维基载药敷料亲水性与抗菌性随载药量增加而增加,载药3%敷料对金黄色葡萄球菌的抑菌率可达91%。聚乳酸纳米纤维载药敷料具有较好的自降解性能和平缓的药物缓释能力。

