基于TCGA数据库胶质母细胞瘤患者预后铁死亡基因相关lncRNA预测模型构建
裴珍珍,王革生,宋光荣,蔡旭,杜勇,东潇博
北京中医药大学东方医院神经外科,北京 100078
胶质瘤是颅内高发的恶性肿瘤,发病率约占所有恶性脑肿瘤的81%。而胶质母细胞瘤(GBM)是最常见的胶质瘤组织学类型,约占所有胶质瘤的45%,其恶性程度和病死率极高,临床治疗效果差,5年存活率仅为5%[1]。铁死亡是由DIXON等[2]提出的一种非凋亡、铁依赖性、氧化性细胞死亡机制,与传统的细胞凋亡和坏死不同,是铁依赖性脂质过氧化物积累的结果。铁死亡在调节诸如淋巴细胞瘤、胰腺导管细胞癌、肾细胞癌和肝细胞癌等某些类型肿瘤细胞的生长和增殖方面起着重要作用。研究表明,铁死亡可以杀死肿瘤细胞,抑制肿瘤生长[3]。长链非编码RNA(lncRNA)是一种被定义为超过200个核苷酸、缺乏蛋白质编码功能的转录本。lncRNA具有细胞和组织特异性表达的特点,在癌症中差异表达,并显示出与临床结果的明显相关性。近年来,随着对铁死亡与肿瘤新疗法的不断研究,新的lncRNA功能不断被揭示。然而,铁死亡相关的lncRNA在GBM中的作用和预后评估中的价值仍不清楚。TCGA是美国国立卫生研究院(NIH)启动的一项公共资助项目,旨在利用创新的基因组测序分析技术加速对癌症遗传学的全面了解,帮助产生新的癌症诊断、治疗方法和预防策略[4-5]。而GBM是肿瘤基因组图谱(TCGA)预实验研究的第一种癌症,诸多铁死亡相关的lncRNA在GBM的作用和预后评估中的价值未知。2021年7月-8月,我们以TCGA数据库中GBM的高通量测序数据为基础,借助R语言对基因组数据进行综合分析,探索GBM中铁死亡基因与lncRNA的共表达关系,筛选与GBM预后相关的铁死亡相关lncRNA,为改善GBM患者预后、寻找新的治疗方法提供参考。
1 资料与方法
1.1 数据来源选取TCGA数据库(https://portal.gdc.cancer.gov/)中具备完整随访资料的GBM样本,并下载GBM肿瘤组织和癌旁组织的高通量测序数据及临床资料。利用Perl对下载的转录组数据和临床资料分别进行转换和信息提取,以用于后续分析。数据下载截至2021年8月16日。通过文献检索和Ferrdb数据库(http://www.zhounan.org/ferrdb)两种方式获取与铁死亡相关的全部基因集。
1.2 GBM中铁死亡差异表达基因的筛选通过R语言的“limma”包对TCGA队列中的肿瘤组织和癌旁组织做基因的差异表达分析,以|logFC|>1和FDR<0.05为标准进行过滤,筛选出与铁死亡显著相关的差异基因。
1.3 GBM中铁死亡lncRNA的获得及其与铁死亡基因的共表达分析运行“limma”包计算铁死亡基因和lncRNA之间表达的相关性,确定铁死亡相关的lncRNA。P<0.001,两者之间存在共表达关系;cor(相关系数)>0,两者为正调控关系,cor<0,两者为负调控关系。借助Cytoscape软件(version:3.8.2)构建铁死亡基因与铁死亡lncRNA共表达关系的网络图。
1.4 富集分析利用R语言的“clusterprofiler”包对筛选出的差异有统计学意义的铁死亡基因进行基因本体论(GO)和京都基因百科全书(KEGG)分析;在线作图软件ImageGP绘制气泡图。GSEA软件(Version:4.1.0)进行基因集(GSEA)富集分析,研究高危组和低危组之间生物学功能的差异,定义富集分数(ES)>0的通路或功能在高风险组是活跃的,ES<0的通路在低风险组是活跃的。其中,错误发现率(FDR)<0.05被认为是显著富集的功能或通路。
1.5 GBM预后模型的建立使用“survival”包对594例GBM患者铁死亡相关lncRNA表达矩阵进行单因素Cox回归分析,评估每个lncRNA的预后价值,筛选出与GBM生存期相关的铁死亡lncRNA(P<0.01),为避免过度拟合带来的干扰,采用LASSO Cox回归降维方式过滤部分线性相关的特征,确定与GBM预后显著相关的铁死亡lncRNA,建立多基因预后风险模型。根据lncRNA表达量和相应系数计算每个GBM患者的风险评分。以风险评分的中位数为截断值,将患者分为高风险组和低风险组。运用R语言的“survminer”包和Kaplan-Meier生存分析对高、低风险组进行评价并绘制Kaplan-Meier生存曲线,评估高、低风险组样本总体生存率的差异情况。P<0.05为差异有统计学意义。
1.6 统计学方法基于R(Version:4.0.2)进行数据统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 GBM中铁死亡相关基因表达差异分析通过文献检索和Ferrdb数据库下载共获得铁死亡基因382个,其中246个铁死亡基因在GBM表达。对该部分基因进行差异分析,筛选出差异有统计学意义的铁死亡基因102个,其中,67个基因在肿瘤组上调,35个下调;对其进行GO和KEGG富集分析,筛选差异表达基因的生物学功能。差异基因显著富集在细胞对化学应激、氧化应激的反应、对营养水平、细胞外刺激等生物学过程;细胞组成部分包括黏着斑、细胞-基底连接、丝氨酸/苏氨酸蛋白激酶复合物等是差异基因富集最显著的,分子功能富集结果主要集中在泛素蛋白连接酶结合、泛素样蛋白连接酶结合、铁离子结合等。KEGG通路分析主要集中在癌症中微小RNAs、自噬、铁死亡、内分泌抵抗等。GSEA富集分析显示,高危组富集较显著的通路包括细胞因子受体相互作用通路、溶酶体、谷胱甘肽代谢通路、半乳糖代谢通路、糖胺聚糖降解通路、氨基糖和核苷酸糖代谢通路等,低风险组未发现具有统计学意义的功能或通路。
2.2 GBM预后相关的铁死亡lncRNA及其与铁死亡差异基因的共表达分析GBM中与铁死亡相关的lncRNA 2 624个,通过单因素Cox分析共筛选出111个影响GBM预后的铁死亡lncRNA,风险比(HR)>1代表该lncRNA是影响预后的高危因素,反之为保护因素;69个差异有统计学意义的铁死亡基因与73个GBM预后相关的铁死亡lncRNA之间存在共表达关系,这73个lncRNA包含高、低风险,69个差异铁死亡基因中,22个在GBM中下调,47个上调,表明在GBM中,铁死亡基因与lncRNA之间具有复杂的调控关系,铁死亡基因与铁死亡lncRNA的共表达关系如图1所示,中度值较高的铁死亡基因与lncRNA见表1~2。

表1 共表达关系中度值≥8的铁死亡基因
2.3 临床预后模型的建立与验证以风险得分的中位数为截断值,GBM患者分为高风险组79例和低风险组80例。Kaplan-Meier曲线分析显示,高风险lncRNA特征的表达与较差的存活率相对应(P<0.001),低风险组生存时间大于高危组。
3 讨论
GBM是世界卫生组织Ⅳ级胶质瘤,其高度浸润性、遗传异质性以及血脑屏障(BBB)的保护为GBM的治疗带来了挑战。GBM标准治疗方法是手术切除,然后进行放化疗。然而,GBM细胞强大的DNA修复和自我更新能力,使GBM表现出对现有治疗方法的不敏感性。在过去20年里,GBM患者生存期仅提高了10个月左右,肿瘤术后复发率更接近100%[6-7]。美国的5年生存率仅达到7.2%[8]。改善GBM患者的生存预后、提高其生命质量成为人类孜孜探索但迄今尚未攻克的难题。癌细胞的高铁水平及其对铁死亡诱导的敏感性增加,使得铁死亡成为肿瘤研究的热点[9]。同时,高通量基因组学数据的发展为GBM患者带来新希望,对GBM耐药机制和肿瘤异质性的认识,对基因突变特征和规律的探索,对有效治疗靶点的筛选和药物研发,将是开发有效治疗方法的关键,未来可能使GBM的总体治疗效果获得里程碑式突破。
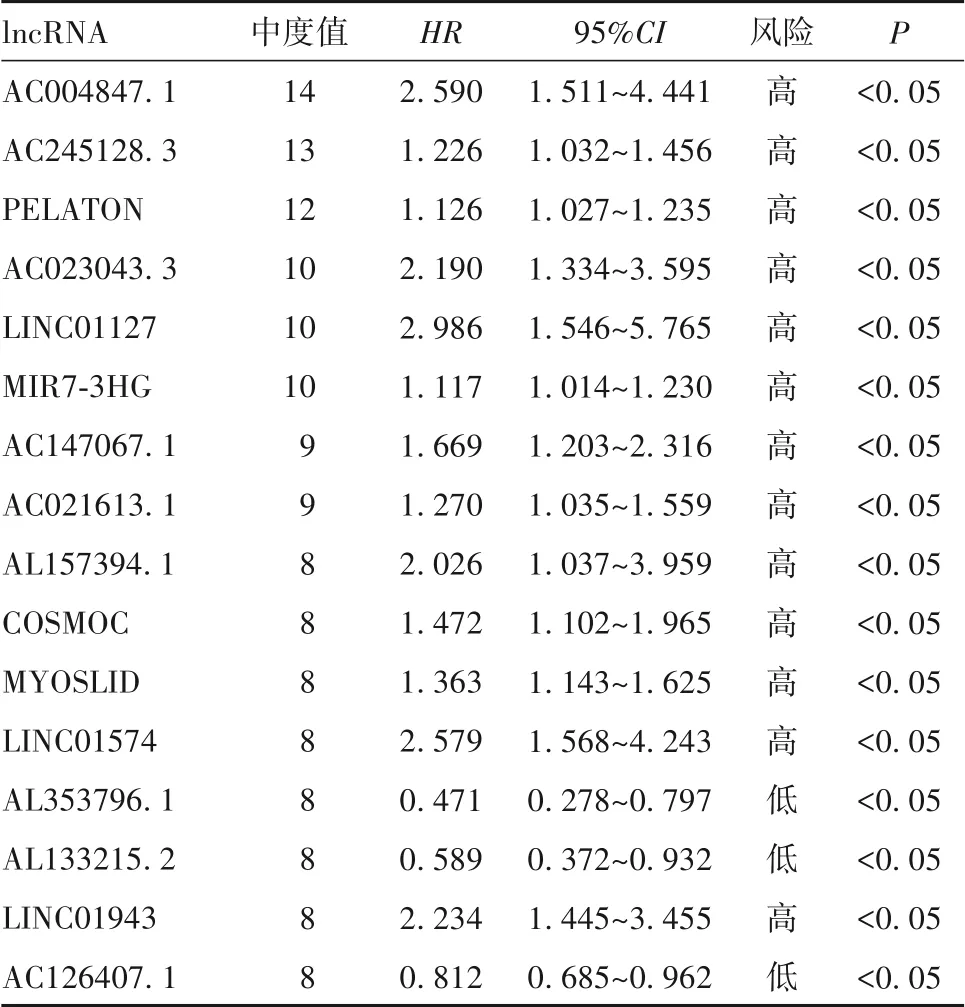
表2 共表达关系中度值≥8的lncRNA
因此,本研究从GBM转录组数据着手,以铁死亡基因为载体,探索GBM中铁死亡基因与lncRNA的关系,获取影响GBM预后的关键铁死亡lncRNA。最终获得了104个铁死亡基因和2 624个铁死亡相关的lncRNA,通过Cox分析确定了111个影响GBM预后的铁死亡lncRNA,69个具有统计学差异的铁死亡基因与73个GBM预后相关的lncRNA之间相互存在共表达关系;其中,AC004847.1、AC023043.3、LINC01127、LINC01574、LINC01943等是影响GBM预后的风险较高的lncRNA,铁死亡基因SAT1、WIPI1、TNFAIP3、NCF2、ALOX5、FTL、NGB、ACSL4、GOT1、MAPK8、SLC2A12等与这些lncRNA在共表达关系中度值最高,调控关系较为复杂。
SAT1是本研究中与lncRNA共表达关系最复杂的铁死亡基因之一,在GBM中表达上调。一项针对677个GBM患者肿瘤中SAT1评估,发现与低级别胶质瘤相比,SAT1在高级别GBM中显著过表达[10]。在针对GBM治疗的研究中,Brett-Morris A证明抑制SAT1,可增加多形性GBM对放射的敏感性[11]。此后,该团队通过过表达SAT1,再此印证了该结论[12]。这一发现与本研究结论相同:表达上调的SAT1与GBM的发生相关,提示SAT1可能是治疗GBM的敏感靶点,启示科研人员可借助基因治疗甚至是药物治疗等方法去改变SAT1水平,增强GBM辐射反应。
ACSL4、GOT1、MAPK8、SLC2A12等基因在GBM中表达下调。长链酯酰辅酶A合成酶4(ACSL4)可参与磷脂酰乙醇胺或磷脂酰肌醇等易氧化膜磷脂的合成,促进多不饱和脂肪酸发生脂质过氧化,从而参与铁死亡发生[13]。在宫颈癌、肺腺癌、三阴性乳腺癌等肿瘤中,高表达ACSL4均表现出对肿瘤细胞的增殖抑制[14-16]。本研究中,ACSL4在GBM中低表达,提示或许可通过高表达铁死亡基因ACSL4,达到抑制GBM发展的效果,这可能是GBM治疗的一个有意义的着手点。而同属GBM中低表达基因GOT1,在肝癌、胰腺癌等消化系统肿瘤的研究中显示相反的效果:沉默GOT1可抑制肝癌细胞的存活,减小裸鼠移植瘤的体积[17]。抑制GOT1表达可通过铁死亡促进胰腺癌细胞死亡[18]。这一铁死亡基因应引起研究人员的关注,是否GOT1表达可在不同肿瘤中产生不同的结果,有待进一步研究。
lncRNA是重要的表观遗传调控因子,在癌症发生和恶性进展中发挥关键作用。在GBM中,lncRNA的异常表达可能会改变基本的细胞生物学过程,并导致GBM的恶性表型[19-20]。此外,特定lncRNA的差异表达也可能与GBM干细胞(GSC)的致瘤特性相关[21]。本 研 究 发 现,LINC01127、AC004847.1、LINC01574、LINC01943、AC023043.3、AL353796.1、AL133215.2、AC126407.1等lncRNA是影响GBM预后关键lncRNA,且与铁死亡基因之间存在密切调控关系。其中,LINC01127、AC004847.1、LINC01574、LINC01943、AC023043.3等lncRNA是影响GBM的高危基因,而AL353796.1、AL133215.2、AC126407.1是GBM的保护基因。而诸如AC004847.1、LINC01574、AC023043.3、AL353796.1、AL133215.2等诸多lncRNA尚未被研究;在GBM中,相关研究更少,甚至从未被研究,提示这些铁死亡基因与lncRNA可能成为GBM研究的着手点,亟需更多关注。
本研究借助TCGA的高通量测序数据,鉴定了111个与铁死亡相关的lncRNA。这是第一项针对GBM构建的铁死亡相关的lncRNA预后的研究,为临床医生和科研人员开发了一种有效、实用的方法,可用于预测GBM患者的生存期并制定个性化治疗方案。然而,本研究仍存在局限性,文中所涉及的高通量测序数据仅来自TCGA数据库,且对预后模型有效性的验证方法相对单一;检测已鉴定的铁死亡相关lncRNA在细胞系和临床样本中表达水平的相关基础实验很少,部分铁死亡lncRNA是之前未研究过的,其功能和机制有待进一步体外和体内研究,以期提供其作为治疗GBM新候选靶点的潜力。

