不同需冷量砂梨品种芽内休眠进程中的生理变化
韩国秀,郑小艳
(1 浙江农林大学省部共建亚热带森林培育国家重点实验室,杭州,311300;2 丽水学院生态学院,浙江丽水,323000)
梨为蔷薇科(Rosaceae)梨属(Pyrus)多年生落叶果树,冬季其芽进入内休眠(endodormancy),满足需冷量后才能解除休眠恢复生长[1]。梨栽培种的需冷量差异较大,其中,砂梨(P.pyrifoliaNakai)的需冷量是较低的[2]。砂梨品种间的需冷量也存在差异,如“圆黄”的需冷量显著高于“翠冠”“翠玉”。此外,叶芽的需冷量通常比花芽高[2-3]。杏[4]和桃[5]等果树的杂交试验研究表明,需冷量是一个数量遗传性状,但具体的遗传机制不明,梨的相关研究很少。最近基于梨基因组比较和定量表达的研究表明,休眠相关转录因子DAM基因的表达模式可能和梨品种需冷量的高低相关[6]。
果树芽内休眠生理方面的研究取得了较多进展。以往的研究认为激素在调控芽休眠中起重要作用,ABA(脱落酸)是调节休眠的关键激素[7],对芽内休眠的诱导、维持有重要作用,而GA3(赤霉素)和IAA(吲哚-3-乙酸)对内休眠的解除起促进作用[8-10]。对梨的研究表明,ABA通过对DAM基因的精密控制,维持芽休眠的状态[11]。此外,内休眠生理相关研究较多的其他指标,如:脯氨酸含量、过氧化物酶(POD)活性、H2O2含量等在芽内休眠期间均呈现上升趋势,而可溶性蛋白含量呈下降趋势[12-18]。H2O2在休眠解除期含量急剧下降,被认为是促进打破休眠的信号物质[16,19,20]。
果树需冷量高低与上述相关生理指标的关系研究较少。枣[21]、樱桃[20]、甜樱桃[10]和蓝莓[22]等多种落叶果树的相关研究表明,芽内休眠期间的脯氨酸含量、H2O2含量、POD活性和激素含量等指标的变化及高低与品种的需冷量高低相关。梨的相关研究很少[18]。
本研究选择3个需冷量有差异且在浙江栽培较广泛的砂梨品种(“翠冠”“翠玉”“圆黄”),比较芽内休眠进程中不同代谢途径的多个相关生理指标的变化规律和差异,以探究这些生理指标与芽休眠状态(萌芽率)及需冷量之间的关系,为开发快速判断梨品种芽需冷量高低和休眠所处阶段的方法提供参考。
1 材料与方法
1.1 样本采集
2020年10月至2021年2月采集芽样本。供试砂梨品种为“翠冠”“圆黄”“翠玉”,试验树位于浙江省丽水市莲都区敏河村的露地生产果园,嫁接繁殖,砧木为豆梨(P.calleryanaDcne.)。至2020年,“翠冠”“圆黄”已定植15年,“翠玉”已定植10年。样本组织共4种,即3个品种的花芽及“翠冠”的叶芽。
温度记录仪放置在果园内梨树体中部,每0.5 h记录一次温度,用于需冷量和低温积累量的计算。2020年10月(休眠前)取一次样,进入休眠后按照犹他模型计算低温积累量,间隔200 CU左右取一次样,直至待测品种的组织均已解除休眠,实际取样6次,用于生理指标测定。每次取样,供试品种和芽组织进行3个单株的生物重复。每次取样统一剪取树体外围生长势中庸的1年生中、长枝40枝左右,用水插枝保湿并迅速带回实验室,进一步筛选无病虫害及发育良好的饱满花芽(包括顶花芽及侧花芽)或叶芽,立即用液氮速冻后置于-80 ℃超低温冰箱保存,另留10枝左右进行人工催芽用于萌芽率及休眠状态的测定。为了能够较精确地计算需冷量,在预计即将解除休眠的期间增加两次采样,用于萌芽率测定。
1.2 休眠状态的测定和需冷量的计算
将上述1年生枝条基部剪口剪齐,放入玻璃瓶,加水至没过基部2 cm的位置,放置于光照培养箱培养。培养条件:光照强度320 μmol · m-2·s-1,昼/夜温度为(25±1.0) ℃/(18±1.0) ℃,空气相对湿度为75%左右。21 d后统计花芽和叶芽的萌芽率。培养期间每2 d换一次水,并对枝条基部进行修剪。需冷量计算,同时采用犹他模型、7.2 ℃模型和0~7.2 ℃模型。休眠阶段的划分:以第1芽萌发时间超过10 d为枝条进入内休眠时期;萌芽率10%~20%为轻度休眠;萌芽率低于10%为深休眠;萌芽率再次高于10%为开始解除休眠;萌芽率高于50%为完全解除休眠[3,23-25]。
1.3 生理指标的测定
可溶性蛋白含量测定采用考马斯亮蓝G-250染色法[26];H2O2含量测定采用分光光度计法[27];POD活性和脯氨酸含量测定分别采用南京建成生物公司研究所试剂盒A084-3-1和A107-1-1;ABA、IAA和GA3含量测定采用酶联免疫法试剂盒(中国农业大学)。
1.4 数据分析
采用SPSS 26进行数据分析。
2 结果与分析
2.1 内休眠进程和需冷量
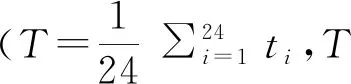
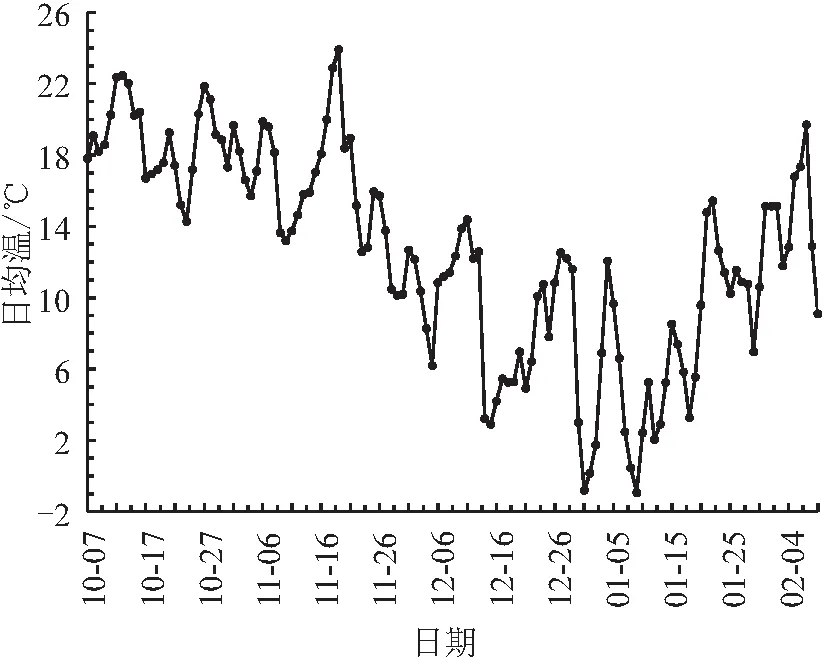
图1 2020年10月至2021年2月浙江省丽水市莲都区露地梨园田间日均温变化
第1次取样日(10月11日)当日“翠玉”仅有少量落叶,“翠冠”有较多落叶,“圆黄”已经大部分落叶,此时,尚未到低温积累量起点(犹他模型),各样本第1芽萌芽时间小于10 d,还未进入内休眠,除“翠玉”花芽萌芽率(52.1%)高于50%,其余样本萌芽率在25%左右。11月29日,低温积累起始3 d后,各样本第1芽萌芽时间超过10 d,均进入内休眠,且3种花芽的萌芽率均下降至10%以下,已经进入深休眠;但“翠冠”叶芽萌芽率(18.9%)较高,为浅休眠阶段。12月16日采集的“翠玉”花芽萌芽率升至50.65%,可以认为已经解除内休眠,但12月30日时萌芽率又有所下降;针对该样本,增加了1个采样日即1月3日,此时低温积累量410 CU(308CH、246CH),经培养后萌芽率为(62.62±2.56)%(数据未在表中列出),确定完全解除内休眠;1月9日时萌芽率升至82.0%。“圆黄”花芽的萌芽率从12月30日开始逐步升高;1月18日升至45.6%,接近解除休眠;1月25日达70.23%,完全解除休眠。“翠冠”花芽的萌芽率在11月29日至1月9日变化不大,在8%~17%之间,处于休眠中;1月18日陡升至70.54%,完全解除休眠。“翠冠”叶芽的萌发率呈缓慢上升,至最后一次采样日期(2月7日)刚解除休眠,萌芽率为50.3%。“翠冠”花芽解除休眠早于叶芽。不同采样期各样本的萌芽率见表1。综上所述,4种芽样本均在11月29日之前已经进入了内休眠;“翠玉”花芽在11月29日左右为深休眠阶段,且维持时间很短,12月16日初次解除内休眠,之后疑似进入类似“二次休眠”的浅休眠阶段,1月3日之后再次完全解除内休眠;“翠冠”花芽于11月29日至12月16日处于深休眠阶段,12月30日开始解除休眠,1月18日已完全解除休眠;“圆黄”花芽11月29日至12月16为深休眠阶段,12月30日开始解除休眠,至1月25日完全解除休眠;“翠冠”叶芽11月29日才进入浅休眠,12月16日进入深休眠,12月30日逐步解除内休眠,2月7日完全解除内休眠。
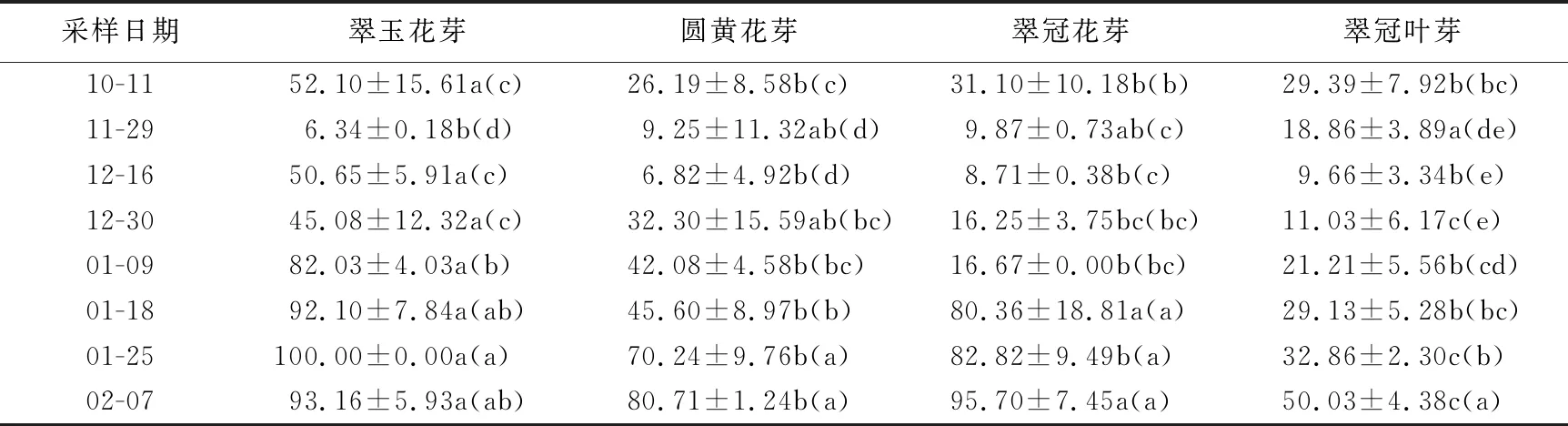
表1 2020年10月至2021年2月浙江省丽水市莲都区露地梨园不同采样期4种芽人工催芽后的萌芽率 %
不同计算模型下的8个采样日期的低温积累情况如表2所示。各样本不同模型下需冷量如表3所示。在犹他模型下:“翠玉”花芽需冷量按照12月16日解除休眠计算为191.5 CU,按照12月30日和1月3日的平均值计算为397.3 CU;“圆黄”花芽需冷量按1月18日解除休眠计算为556 CU;休眠即将解除期间,“翠冠”花芽的萌芽率上升很快,从1月9日的16.67%骤然升高至1月18日的80.36%,按照王力荣等[24]的计算方法应以1月9日作为休眠结束日期计算需冷量,所得结果为488 CU,但实际需冷量应该略高于488 CU;“翠冠”叶芽需冷量最高,为620 CU。
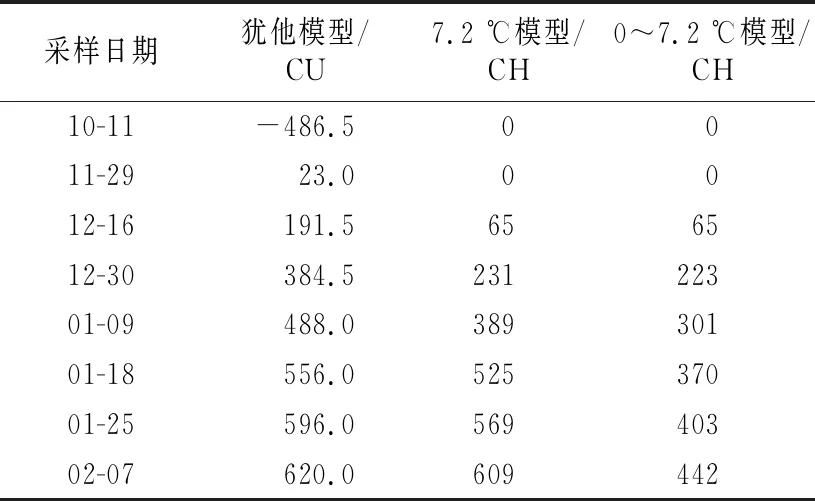
表2 2020年10月至2021年2月浙江省丽水市莲都区露地梨园不同采样期的低温积累量
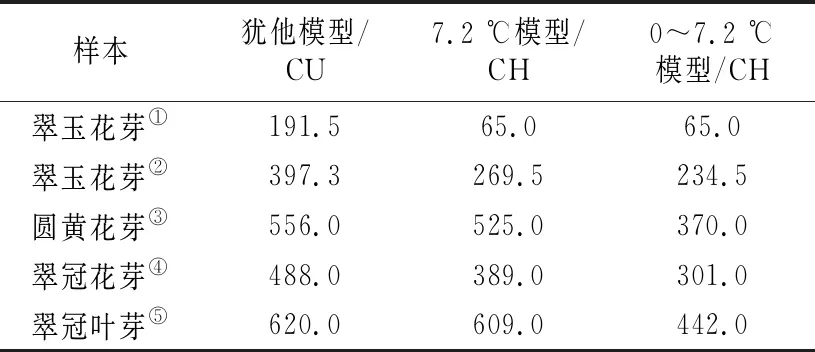
表3 浙江省丽水市莲都区露地梨园“翠玉”“圆黄”“翠冠”花芽及“翠冠”叶芽的需冷量
总的来说,4种芽样本维持深休眠的时间都很短,需冷量较低的样本进入内休眠和解除休眠的速度较快。
2.2 可溶性蛋白含量变化
试验结果显示,4种芽的可溶性蛋白含量随时间的变化趋势总体一致,即在11月29日进入内休眠后迅速下降,并一直保持较低的水平,至2月7日所有样本均已解除休眠时显著上升,变化趋势主要与温度相关,与休眠的进程关系不明显。如:“翠玉”花芽12月16已初次解除休眠,但其可溶性蛋白含量一直较低,没有显著变化。10月11日未进入内休眠时,“翠玉”花芽的可溶性蛋白含量最低,“翠冠”花芽的含量最高;11月29日进入内休眠后“圆黄”花芽的可溶性蛋白含量显著高于其他芽;内休眠解除后的2月7日,“圆黄”花芽的可溶性蛋白含量显著低于其他芽(见图2)。
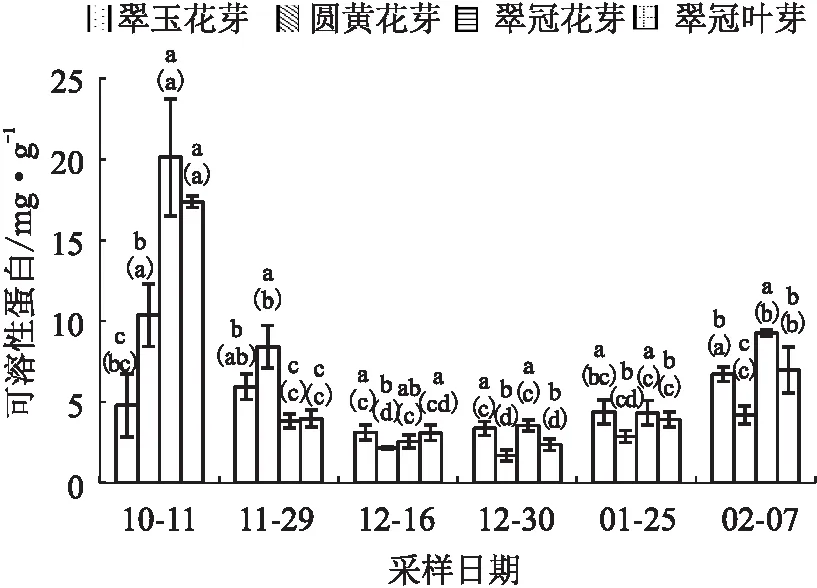
注:数柱上不同小写字母表示同一时期不同芽之间差异显著(p<0.05),数柱上括号内不同小写字母表示同一种芽不同时期之间差异显著(p<0.05),图3至图10同。
2.3 脯氨酸含量变化
试验结果显示,“圆黄”花芽和“翠冠”花芽在深休眠期间(11月29日至12月16日)脯氨酸含量逐渐升高,到12月16日达到一个峰值,之后随着温度短期上升和萌芽率提高而下降,休眠解除后脯氨酸含量上升。
“翠玉”花芽在进入休眠到初次解除休眠的12月16日,其脯氨酸含量显著下降;到12月30日萌芽率短暂下降时,脯氨酸含量显著上升;此后1月25日继续解除休眠,萌芽率大幅度提高,脯氨酸含量轻微下降;最后一次采样2月7日时萌芽率下降,脯氨酸含量则显著上升。
“翠冠”叶芽在所测时期的前期变化趋势与其花芽相似,但其在2月7日解除休眠时却显著下降了。
总体而言,脯氨酸含量变化与低温变化关系不紧密,与内休眠进程关系更密切。花芽样本中,需冷量较高的脯氨酸含量也较高(见图3)。
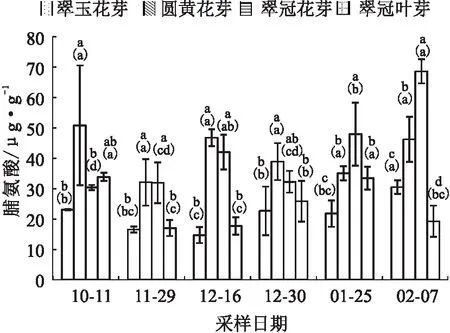
图3 2020年10月至2021年2月浙江省丽水市莲都区露地梨园不同采样期4种芽的脯氨酸含量
2.4 过氧化氢含量变化
试验结果显示,除“翠玉”花芽外,其他样本的H2O2含量在测定期间变化趋势总体是一致的,在进入内休眠前下降,进入内休眠后逐步上升,之后随着内休眠解除而逐渐下降。“翠玉”花芽在12月16日时初次解除休眠,萌芽率提高,H2O2含量在此阶段是下降的;12月30日萌芽率下降,H2O2含量升高;之后,H2O2含量下降。“翠冠”叶芽H2O2含量在多数时期显著高于其花芽。“圆黄”花芽H2O2含量在休眠解除前是最高的,显著高于其他花芽。对花芽样本而言,总体上需冷量较高的其H2O2含量也较高(见图4)。
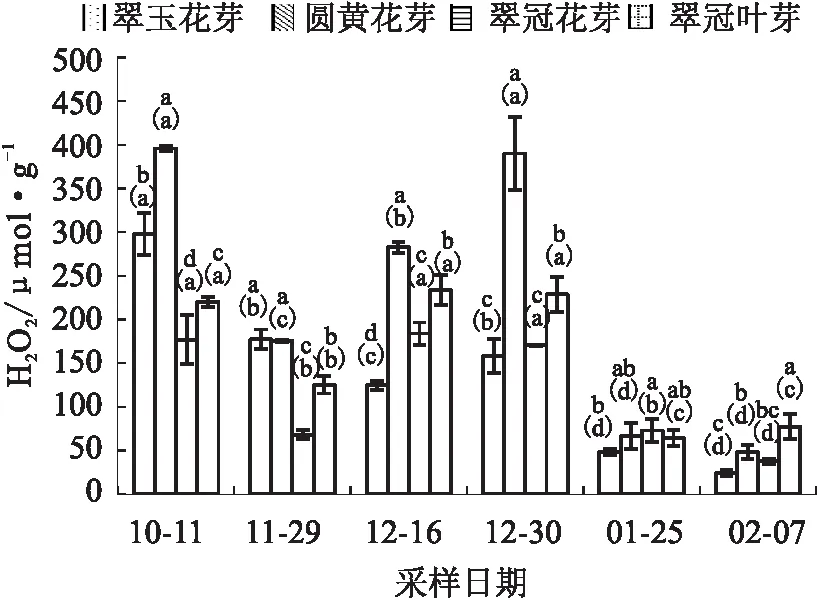
图4 2020年10月至2021年2月浙江省丽水市莲都区露地梨园不同采样期4种芽的H2O2含量
2.5 POD活性变化
试验结果显示,总体上,4种芽的POD活性呈现先下降后上升的变化规律,且变化比较平缓;同一时期,不同样本的POD活性存在显著性差异(见图5)。

图5 2020年10月至2021年2月浙江省丽水市莲都区露地梨园不同采样期4种芽的POD活性
2.6 激素变化
从试验结果看出,除“翠玉”花芽外,其他3种芽的ABA变化趋势总体相似,即随着休眠的加深而上升,在休眠解除期开始下降。“圆黄”花芽和“翠冠”花芽的ABA含量分别于12月16日和12月30日达到峰值,其ABA含量变化节奏与萌芽率正好相反。需冷量最低的“翠玉”花芽,其ABA含量在不同休眠阶段也没有很大差异,且在大多数时期都低于另两种花芽。“翠冠”叶芽的ABA含量总体较低,变化也较为平缓(见图6)。
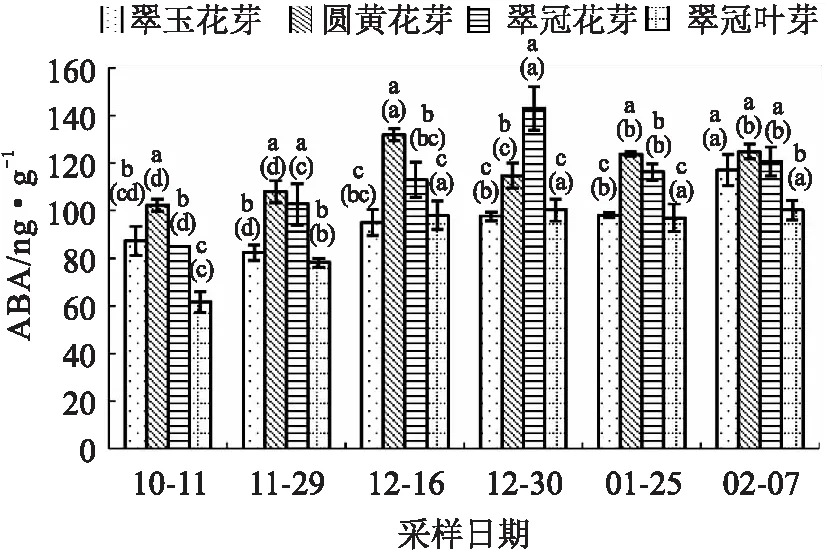
图6 2020年10月至2021年2月浙江省丽水市莲都区露地梨园不同采样期4种芽的ABA含量
4种芽的GA3变化趋势总体一致,即进入内休眠后下降,12月16日降为最低,之后随着需冷量的积累开始上升。12月30日,“翠冠”花芽和叶芽的GA3显著升高,但此时的萌芽率开始上升。“圆黄”花芽在12月16日后,萌芽率不断上升,同时GA3含量不断上升。1月25日,“翠冠”花芽、叶芽的含量下降,而“翠玉”花芽和“圆黄’花芽的GA3含量上升。在休眠解除之前,各样本的GA3含量的变化与其萌芽率的变化规律是相似的。“翠玉”花芽在10月11日时的GA3含量显著高于其他样本,这和该品种树体当时落叶少有关(见图7)。
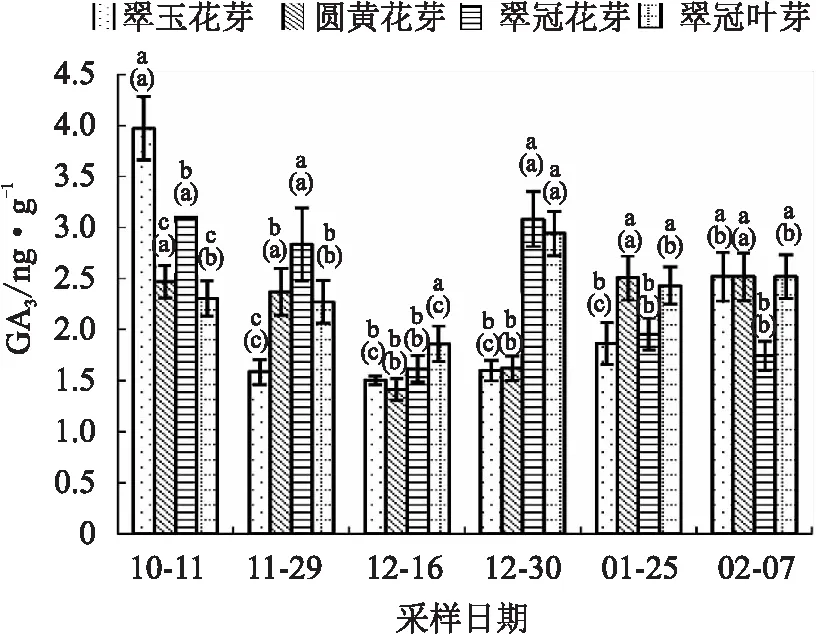
图7 2020年10月至2021年2月浙江省丽水市莲都区露地梨园不同采样期4种芽的GA3含量
4种芽的IAA含量变化趋势总体一致,即进入内休眠后逐步下降,随者休眠的解除而升高;但“翠玉”花芽较早解除休眠,其IAA没有随休眠解除而明显升高(见图8)。
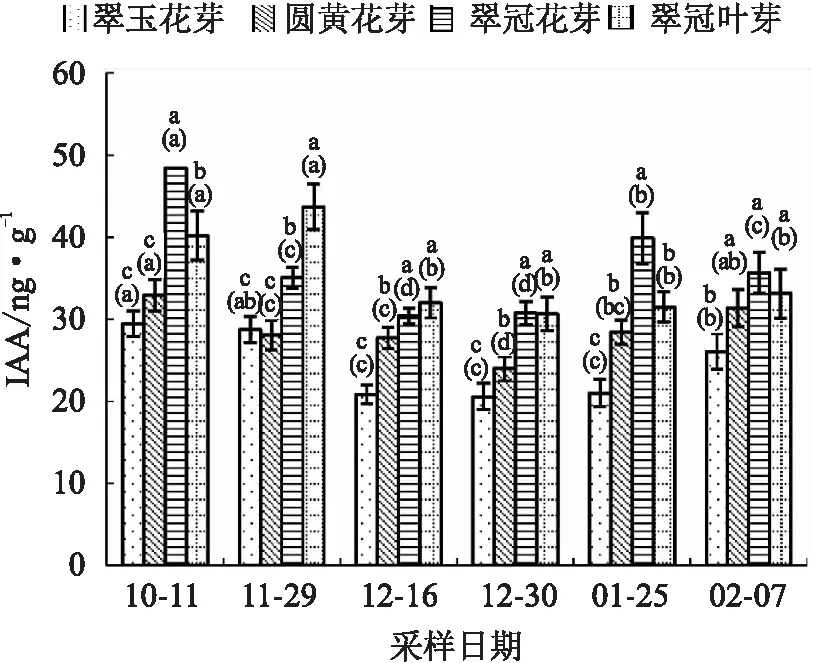
图8 2020年10月至2021年2月浙江省丽水市莲都区露地梨园不同采样期4种芽的IAA含量
总体上,在内休眠期,需冷量最低的“翠玉”花芽的3种激素含量都是最低的。在休眠解除前需冷量较低的“翠冠”花芽的ABA低于“圆黄”花芽,在整个休眠期GA3、IAA高于“圆黄”花芽。
随着进入内休眠(11月29日),4种芽的ABA/GA3逐渐上升,12月16日之后开始下降,但“翠冠”叶芽在1月25日开始再次升高。比较“圆黄”花芽和“翠冠”花芽,内休眠期间需冷量较高的“圆黄”花芽的ABA/GA3较高。在进入内休眠到完全解除休眠“翠冠”花芽中的ABA/GA3高于其叶芽(见图9)。

图9 2020年10月至2021年2月浙江省丽水市莲都区露地梨园不同采样期4种芽的ABA/GA3比值
ABA/IAA的比值随休眠的加深不断上升,之后随休眠的解除比值降低。“翠玉”花芽因为10月11日的IAA值较低,刚进入内休眠时ABA/IAA没有明显的变化(见图10)。由于GA3的含量较低,ABA/(GA3+IAA)比值(图11)变化与ABA/IAA变化相似。
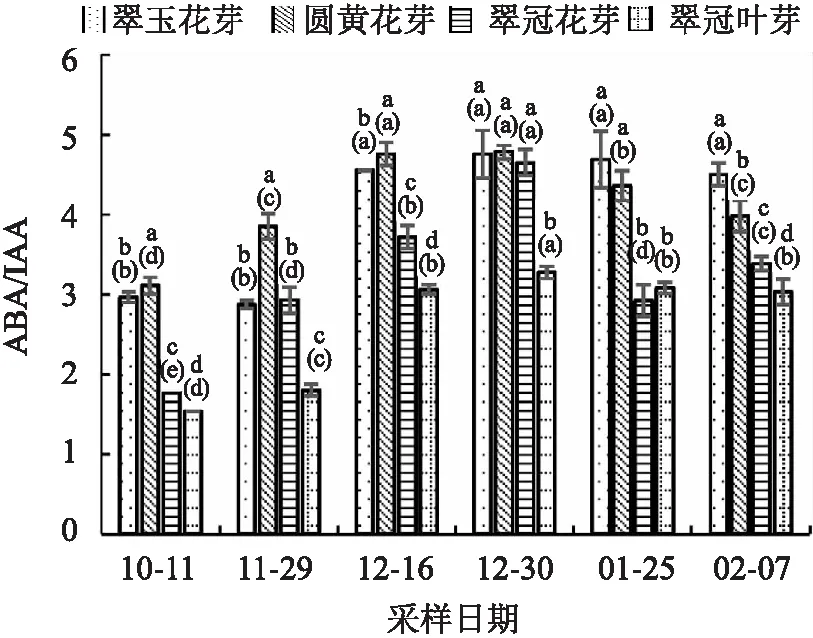
图10 2020年10月至2021年2月浙江省丽水市莲都区露地梨园不同采样期4种芽的ABA/IAA比值
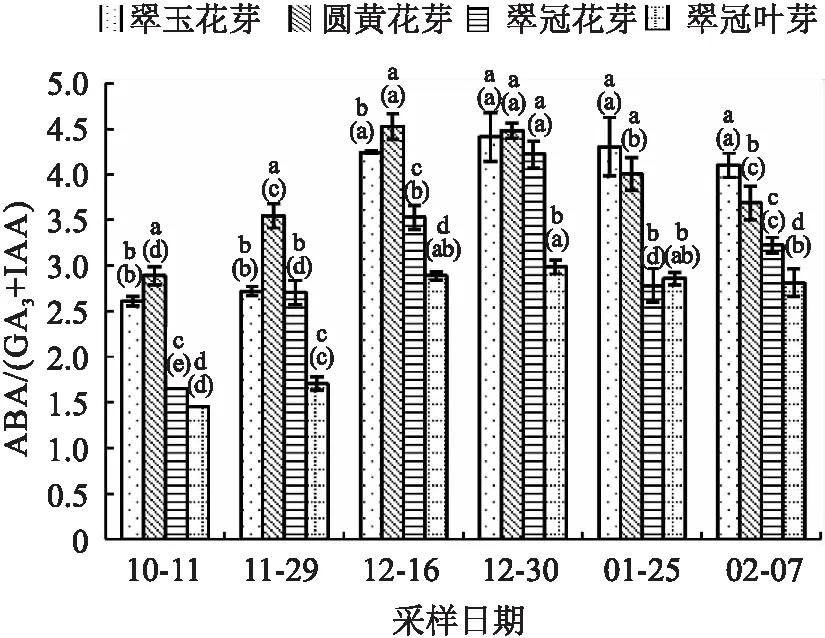
图11 2020年10月至2021年2月浙江省丽水市莲都区露地梨园不同采样期4种芽ABA/(GA3+IAA)含量
2.7 萌芽率与生理指标相关性
对各样本在所有测定日(图1~11的6个时期)的萌芽率与各生理指标进行相关性分析。结果表明,各样本的H2O2含量与萌芽率都呈极显著负相关。“翠玉”花芽和“翠冠”花芽的脯氨酸含量与萌芽率分别呈显著和极显著正相关。“翠冠”花芽和叶芽的POD活性与萌芽率分别呈显著和极显著正相关。对于ABA,仅“翠玉”花芽萌芽率与其呈极显著正相关。“圆黄”花芽萌芽率与GA3呈显著正相关,但“翠冠”花芽萌芽率与GA3呈显著负相关。对于IAA、ABA/GA3、ABA/IAA和ABA/(GA3+IAA),仅“翠玉”花芽萌芽率与ABA/IAA、ABA/(GA3+IAA)呈极显著正相关、显著正相关(见表4)。

表4 测定期间梨品种“翠玉”“圆黄”“翠冠”花芽及“翠冠”叶芽生理指标与萌芽率的相关系数
3 讨论
3.1 需冷量与内休眠进程
“翠冠”作为砂梨的主栽品种之一推广范围较大,在浙江、福建、河南等多个地区测定过需冷量,花芽需冷量为229~565 CU,叶芽需冷量高于花芽,为555~1 097 CU[3]。本研究在浙江丽水测定结果,除“翠冠”花芽需冷量大于浙江富阳外,“翠冠”叶芽需冷量、“圆黄”花芽需冷量、“翠冠”花芽与“圆黄”花芽需冷量差值及“翠冠”叶芽和花芽需冷量差值都小于浙江富阳[3]。测定当年整个冬季浙江富阳的低温积累量为1 343 CU,而浙江丽水只有620 CU。分析认为,诸多果树需冷量的测定结果因年份或者栽培地区不同差异明显[3,28-29],较寒冷地区的测定值一般较高[3]。此外,本研究2020年秋季“圆黄”落叶较早,这可能也是其需冷量测定值较低的原因之一。
本研究中,“翠玉”花芽存在类似二次休眠的现象。这在醋栗(RibesnigrumL.)[30]和砀山酥梨[31]中也有类似报道。浙江富阳栽培的“翠玉”也有类似现象[3]。“翠玉”是“翠冠”(父本)和“西子绿”(母本)的杂交后代。本研究结果显示,“翠玉”花芽需冷量明显低于其亲本“翠冠”花芽。其他砂梨品种[32]及桃[5]的相关研究结果也显示,杂交子代需冷量有低于亲本的表现,或倾向于较低需冷量亲本。“翠玉”属于较新的早熟砂梨品种,其需冷量和休眠进程的报道很少,需进行多地多年份研究。
3.2 生理指标变化与休眠进程的关系
以往研究认为激素对休眠有重要调控作用。在酥梨[11]、幸水梨[33]中,ABA含量在内休眠加深过程中升高,在休眠解除过程中降低,ABA变化与冬季温度的变化趋势并不一致,说明梨芽中的ABA并不是对低温的简单响应[11]。豆梨休眠中GA3先降低,在休眠解除前含量上升[34]。本研究中,“圆黄”花芽、“翠冠”花芽和“翠冠”叶芽的ABA、GA3与上述梨研究结果一致。在类休眠期,枝条基部浸泡使用ABA会显著降低萌芽率[11],在休眠后期外部涂抹GA3可使芽提前萌发[35],说明ABA和GA3分别对休眠维持及解除起着重要作用。值得注意的是,“翠玉”进入休眠后的ABA、GA3和IAA变化都比较平缓,含量也较其他样本低。各样本中,仅“翠玉”花芽萌芽率与ABA呈正相关,这可能与其休眠解除后再次进入休眠有关。
脯氨酸和可溶性蛋白是植物的渗透调节物质,与植物抗寒相关。本研究结果显示,可溶性蛋白随休眠的加深而下降,随休眠的解除而上升,与威宁大黄梨[14]和鸭梨[36]上的结果相似,但与样本的萌芽率都没有显著相关性。这可能是因为可溶性蛋白来自多个代谢途径,无法直接反映树体的休眠状态。脯氨酸的变化规律与可溶性蛋白有所不同,本研究与豆梨芽的研究结果一致[34],在“翠冠”花芽和“翠玉”花芽脯氨酸含量与萌芽率分别呈极显著和显著正相关。说明在较低需冷量品种中脯氨酸含量可能间接反映休眠状态,但需要更多的品种研究验证。
芽休眠期间活性氧含量上升,并随着休眠解除降低,抗氧化系统能清除活性氧,与休眠解除存在一定的关系[16]。POD可以清除H2O2。除“翠玉”花芽外,其他3种供试样本的H2O2随休眠的解除急剧下降,POD则相反。这与在砀山酥梨[19]上研究结果一致。在本研究中,H2O2含量与4种芽萌发率均呈现极显著负相关,与在威宁大黄梨上的研究结果相似[14]。由此认为,H2O2可作为认别梨芽休眠状态的一个标志物,休眠期梨芽H2O2含量迅速降低表明休眠解除。
3.3 生理指标与需冷量的关系
供试样本中“翠玉”花芽有类似二次休眠的情况,其萌芽率高低变化较为复杂,因此,仅比较“圆黄”和“翠冠”,在萌芽率低于10%的深休眠期间(11月29日至12月6日)需冷量较高的“圆黄”花芽的H2O2含量及ABA/GA3较高,而GA3、POD、IAA含量较低。深休眠期间,需冷量较高的“圆黄”花芽H2O2含量高于“翠冠”花芽,与核果类果树中的研究结果一致[20]。“圆黄”花芽POD低于“翠冠”花芽,说明“圆黄”对活性氧的清除能力低于“翠冠”,这可能是“圆黄”需冷量较高、萌芽较晚的原因。高需冷量甜樱桃品种在内休眠期间有较高的ABA含量,较低的GA3含量,高需冷量蓝莓品种内休眠期有较高的ABA和较低的IAA[22]。
浙江丽水冬季较温暖。在供试花芽样本中,冬季低温积累期(11月29日至次年2月7日)“翠玉”的ABA、IAA和GA3含量总体低于另外两种品种,且ABA/GA3变化趋势较为缓和。这可能与“翠玉”较早就解除休眠且发生了类似“二次休眠”现象有关。据作者往年调查,丽水采样地的“翠玉”盛花期晚于“翠冠”3 d及以上。“翠玉”二次休眠的原因及其是否会导致花期推迟值得深入研究。
“翠冠”叶芽需冷量高于其花芽,内休眠期H2O2含量高于花芽,而ABA含量低于花芽。叶芽相比花芽需冷量较高的机理有待进一步研究。

