miR-155介导PI3K/Akt通路对大鼠发育性髋关节发育不良的作用机制研究*
侯平选, 鲜文峰, 邢雅昶, 左汴京
1南阳市第二人民医院骨科二病区(河南南阳 473000); 2郑州儿童医院、河南省儿童医院、郑州大学附属儿童医院超声科(河南郑州 450046)
发育性髋关节发育不良(developmental dysplasia of the hip,DDH)是一种发育障碍性疾病,其特点为股骨头相对于髋臼松弛或位置异常,包括从扁平或髋臼发育不良到关节外的股骨头完全脱位[1]。尽管在出生时和婴儿期可常规筛查DDH,但许多病例直到成年才被诊断出来,由于髋臼形态的变异性,DDH表现为一系列解剖异常,常见髋臼前部或前外侧缺损[2],轻度DDH可导致成人骨关节炎(osteoarthritis,OA)的高发病率,这与DDH早期关节软骨退行性改变有关[3],但关于DDH早期软骨退化的具体机制仍尚待探究。微小RNA(microRNA,miR)是控制增殖、分化、炎症和广泛的其他生物过程的基因表达的关键转录后调节因子,研究发现,miR-155参与调节OA的炎症反应、软骨退化及关节损伤[4],且可负向调控磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)通路诱导软骨细胞凋亡并发挥分解代谢活性[5],为探究miR-155是否可靶向调控PI3K/Akt通路参与大鼠DDH,本研究于2020年1月至2021年10月通过诱导构建新生大鼠DDH模型,体内下调miR-155表达,观察大鼠髋关节病理并检测相关指标因子表达,以期为DDH病理具体机制提供一定的参考资料。
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄无特定病原体级可育雌性Wistar大鼠10只,雄性5只,体重为(240±20)g,购自济南朋悦实验动物繁育有限公司,许可证号为SCXK(鲁)2019-0003。恒温(24±2)℃、恒湿(相对湿度50%~60%)环境下普通饲养,给予充足水和普通饲料,12 h光照-12 h黑暗交替,适应性培养1周后以雌雄比例2∶1合笼过夜受孕。孕鼠分娩后取新生大鼠60只用于实验。本研究符合一般动物实验伦理学原则(伦理审批号:KY2019-892551)。
1.1.2 主要试剂和仪器 miR-155-RNAi-LV、miR-155-NC-LV购自上海吉凯基因化学技术有限公司;改良番红O-固绿软骨染色液(BP-DL421)购自南京森贝伽生物科技有限公司;基质金属蛋白酶(matrix metalloproteinase,MMP)-13(ab286191)、X型胶原蛋白(Collagen X)(ab182563)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycinm,mTOR)(ab2833)、核糖体S6蛋白激酶1(ribosomal S6 protein kinase 1,S6k1)(ab32529)及p-S6k1(ab59208)购自美国Abcam公司;Akt(AA326)抗体购自上海碧云天生物科技有限公司;p-mTOR(bs-3494R)、PI3K(bs-10657R)、p-PI3K(bs-6417R)、p-Akt(bs-2720R)抗体购自北京博奥森生物技术有限公司;ABI 7300型实时荧光定量PCR系统购自美国ABI公司;MultiskanTMFC多功能酶标仪购自美国赛默飞世尔科技有限公司;Gel Doc XR+凝胶成像分析系统购自美国BIO-RAD公司。
1.2 方法
1.2.1 miR-155在DDH大鼠关节软骨组织中的表达 20只Wistar新生大鼠随机分为空白组和DDH组,每组各10只,其中DDH模型通过改变襁褓姿势,固定Wistar新生大鼠后肢伸展和内收进行直腿诱导[6],期间每天松绑10 min后再固定以防血流不通,空白组大鼠不作干预,固定期间经母鼠哺乳。10 d后,空白组和DDH组幼鼠施行安乐死,收集髋关节软骨组织并保存于液氮中,通过RT-qPCR技术检测miR-155在DDH大鼠中的表达水平:Invitrogen Trizol试剂提取软骨组织总RNA,SuperScriptTMVILOTMcDNA 合成试剂盒合成cDNA,SYBR荧光染料法检测,反应条件为94℃ 5 min;94℃ 30 s、55℃ 20 s、72℃ 20 s 35个循环;72℃ 8 min。U6为内参,2-ΔΔCT法计算目的基因的相对表达量。引物序列:miR-155:F:5′-UUAAUGCAAUCGUCAUAGGCGU-3′,R:5′-CCGUAUCACGAUUUGCAUUACAUU-3′;U6:F:5′-CTCGCTTCGGCAGCACA-3′;R:5′-AACGCTTCACGAATTTGCGT-3′。
1.2.2 分组、造模及干预 经检测,miR-155表达在DDH大鼠髋关节中上调,故将40只Wistar新生大鼠随机分为空白组、DDH组、DDH+miR-155 NC组及DDH+miR-155下调组,每组各10只,除空白组外,剩余组大鼠均参考1.2.1诱导DDH模型,10 d后各组幼鼠均自由活动同时进行干预:DH+miR-155 NC组及DDH+miR-155下调组大鼠分别于尾静脉注射miR-155-NC-LV、miR-155-RNAi-LV各100 μL,空白组及模型组大鼠仅注射等量生理盐水,1次/周,共8周。
1.2.3 样品采集与处理 8周后,戊巴比妥钠40 mg/kg腹腔注射诱导麻醉,颈椎脱位处死各组大鼠,取左侧髋关节测量股骨头长径和横径以及髋臼长径、横径,后经PBS冲洗,于4%多聚甲醛中固定2 d,随后将样品在10%乙二胺四乙酸中脱钙15 d,脱水后常规制备石蜡切片以用于组织学染色;右侧髋关节软骨组织于液氮中保存以用于RT-qPCR及Western blot检测。
1.2.4 番红O-固绿染色观察软骨组织蛋白聚糖分泌情况 石蜡切片于二甲苯和分级乙醇中脱蜡,Weigert苏木素染液染色3 min,盐酸乙醇分化15 s,水洗;固绿染色液浸染5 min,水洗;番红O染色液内浸染2 min后蒸馏水、乙酸溶液分别洗涤1 min,脱水透明封片。镜下软骨基质中蛋白聚糖呈红色。
1.2.5 RT-qPCR技术检测miR-155及软骨退变指标因子基因表达 miR-155相对表达量检测同1.2.1;Invitrogen Trizol试剂提取髋关节组织总RNA后利用TaqMan Reverse Transcription Kit将RNA反转录成cDNA,SYBR荧光染料法检测。反应条件为95℃ 5 min;95℃ 10 s,55℃ 30 s,72℃ 30 s 40个循环;以GAPDH为内参基因,2-ΔΔCT法量化mRNA表达水平。引物序列如下:MMP-13:F:5′-TACGAGCATCCATCCCGAGACC-3′,R:5′-AACCGCAGCACTGAGCCTTTTC-3′;Collagen X:F:5′-GATCATGGAGCTCACGGAAAA-3′,R:5′-CCGTTCGATTCCGCATTG-3′;β-actin:F:5′-GGAGATTACTGCCCTGGCTCCT A-3′,R:5′-GACTCATCGTACTCCTGCTTGCTG-3′。
1.2.6 Western blot法检测软骨中软骨退变指标因子及PI3K/Akt通路蛋白表达 软骨组织于RIPA裂解液中裂解,4℃ 12 000 r/min离心15 min,收集上清液保存于-80℃。BCA法测定蛋白浓度,20 μg等量蛋白样品于10% SDS-PAGE凝胶中分离,后转移至PVDF膜上,于室温5%牛血清白蛋白中封闭2 h,4℃一抗中(均1∶1 000稀释)孵育过夜,洗膜,辣根过氧化物酶标记的二抗(1∶10 000稀释)室温孵育2 h,洗膜,增强化学发光试剂盒试剂对膜进行可视化,Image J软件量化蛋白,以目的蛋白与内参β-actin灰度值比值表示蛋白的相对表达量,以磷酸化蛋白灰度值/全蛋白灰度值比值作为蛋白活性水平。
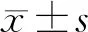
2 结果
2.1 miR-155在DDH大鼠髋关节软骨组织中的表达 RT-qPCR结果显示,与空白组(1.01±0.01)比较,miR-155在DDH组(3.65±0.43)大鼠髋关节软骨组织中的相对表达量升高(P<0.05)。
2.2 各组大鼠股骨头及髋臼大小 测量结果显示,与空白组比较,DDH组、DDH+miR-155 NC组及DDH+miR-155下调组大鼠股骨头长径、横径和髋臼长径、横径及髋臼深度值均减小;与DDH组比较,DDH+miR-155 NC组大鼠与之差异无统计学意义(P>0.05),DDH+miR-155下调组大鼠上述测量指标值均增加(P<0.05);与DDH+miR-155 NC组比较,DDH+miR-155下调组大鼠上述测量指标值均增加(P<0.05)。见表1。
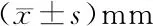
表1 大鼠股骨头及髋臼大小比较(n=10)
2.3 各组大鼠软骨组织蛋白聚糖分泌情况 番红O-固绿染色结果显示,空白组大鼠关节软骨切片软骨边缘完整,软骨基质中蛋白聚糖呈红色深染;与空白组比较,DDH组、DDH+miR-155 NC组及DDH+miR-155下调组大鼠软骨组织切片见基质中红染变淡,另DDH组及DDH+miR-155 NC组大鼠软骨表层细胞缺损;相对与DDH组、DDH+miR-155 NC组,DDH+miR-155下调组大鼠软骨基质中红染程度加深。见图1。
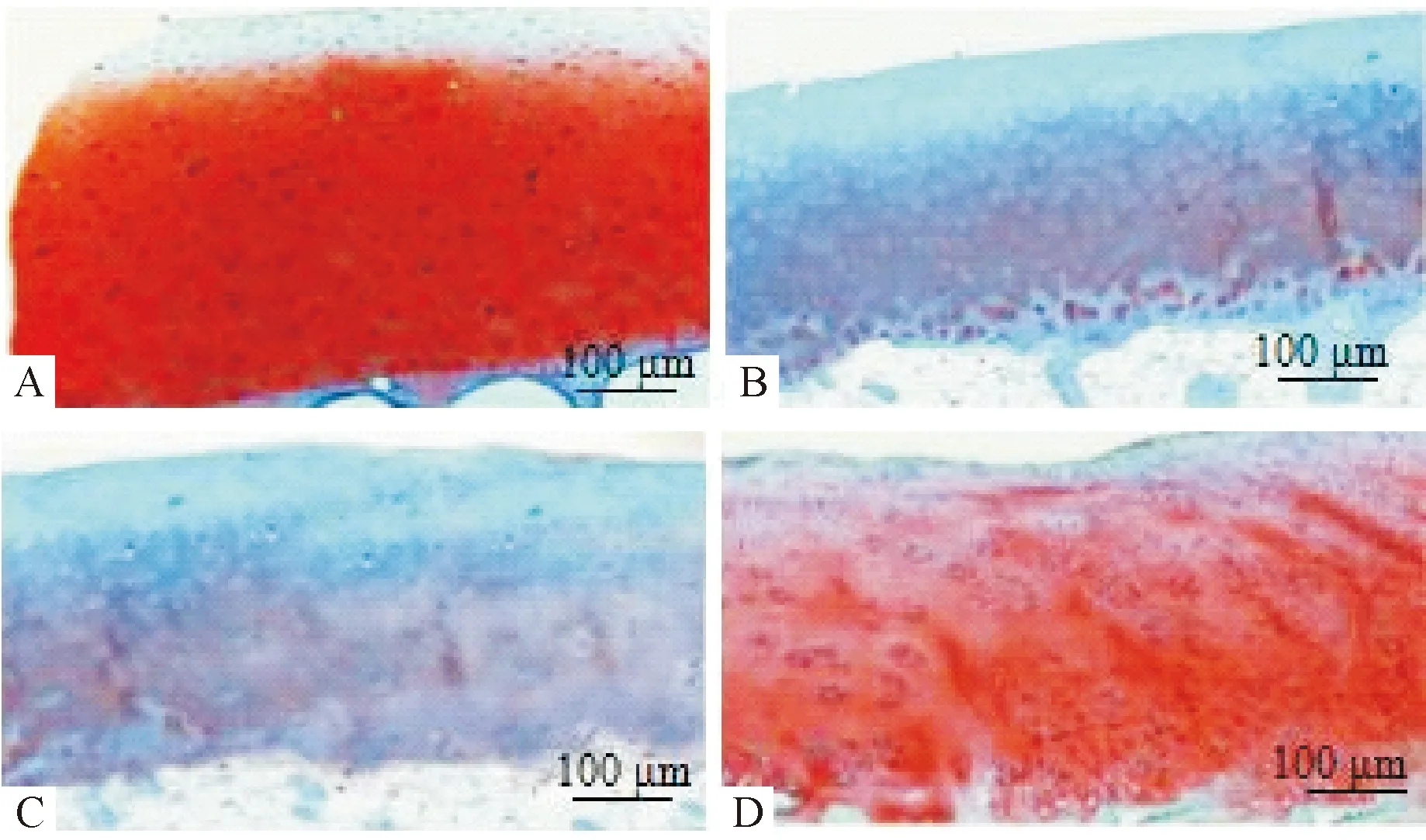
注:A:空白组;B:DDH组;C:DDH+miR-155 NC组;D:DDH+miR-155下调组
2.4 各组大鼠软骨组织中miR-155表达情况 RT-qPCR结果显示,与空白组(1.01±0.01)比较,DDH组(3.59±0.15)、DDH+miR-155 NC组(3.63±0.18)及DDH+miR-155下调组(1.88±0.21)大鼠软骨组织中miR-155相对表达量升高(P<0.05);与DDH组比较,DDH+miR-155 NC组大鼠与之差异无统计学意义(P>0.05),DDH+miR-155下调组大鼠软骨组织中miR-155相对表达量降低(P<0.05);与DDH+miR-155 NC组比较,DDH+miR-155下调组大鼠软骨组织中miR-155相对表达量降低(P<0.05)。
2.5 各组大鼠软骨组织中MMP-13、Collagen X mRNA及蛋白表达情况 RT-qPCR及Western blot结果显示,与空白组比较,DDH组、DDH+miR-155 NC组及DDH+miR-155下调组大鼠软骨组织中MMP-13和Collagen X mRNA及蛋白相对表达量均升高(P<0.05);与DDH组比较,DDH+miR-155 NC组大鼠与之差异无统计学意义(P>0.05),DDH+miR-155下调组大鼠软骨组织中MMP-13和Collagen X mRNA及蛋白相对表达量降低(P<0.05);与DDH+miR-155 NC组比较,DDH+miR-155下调组大鼠软骨组织中MMP-13和Collagen X mRNA及蛋白相对表达量降低(P<0.05)。见图2、表2。
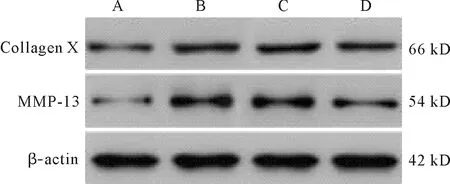
注:A:空白组;B:DDH组;C:DDH+miR-155 NC组;D:DDH+miR-155下调组

表2 MMP-13、Collagen X mRNA及蛋白相对表达量比较(n=10)
2.6 各组大鼠软骨组织中PI3K/Akt通路蛋白表达情况 Western blot结果显示,与空白组比较,DDH组、DDH+miR-155 NC组及DDH+miR-155下调组大鼠软骨组织中PI3K、Akt、mTOR及S6k1蛋白活性水平均降低(P<0.05);与DDH组比较,DDH+miR-155 NC组大鼠与之差异无统计学意义(P>0.05),DDH+miR-155下调组大鼠软骨组织中PI3K、Akt、mTOR及S6k1蛋白活性水平均升高(P<0.05);与DDH+miR-155 NC组比较,DDH+miR-155下调组大鼠软骨组织中PI3K、Akt、mTOR及S6k1蛋白活性水平均升高(P<0.05)。见图3、表3。

表3 各组大鼠软骨组织中PI3K、Akt、mTOR及S6k1蛋白活性比较(n=10)

注:A:空白组;B:DDH组;C:DDH+miR-155 NC组;D:DDH+miR-155下调组
3 讨论
DDH发病机制复杂,据报道,其可能源于异常的围产期机械因素,如臀位、羊水过少和女性初产[7],新生大鼠DDH模型表明,襁褓姿势是一种机械危险因素,该原理设计的模型被认为是人类DDH软骨的准确模型,可能适合进一步研究[8],本研究通过模拟直腿襁褓体位成功制备了DDH新生大鼠模型。研究发现,DDH早期见软骨退化,并在大多数情况下将导致OA发生[9],miRNA是长度为21~24个核苷酸的高度保守的非编码RNA分子,可通过与目标mRNA分子的3′-非编码区碱基配对来抑制翻译并驱动mRNA降解,其异常表达与软骨细胞发育和软骨稳态密切相关,在OA发病机制中起重要作用[10],但miRNA与DDH病理分子机制之间的关系尚待探究。
研究发现,miR-155在脂多糖诱导的炎症性关节软骨细胞中上调[4],通过下调miR-155水平可减轻胶原酶建立的实验性小鼠OA模型的滑膜炎症并延缓OA发展[11],故推测miR-155在DDH大鼠中可能高水平表达。经RT-qPCR检测,本实验结果显示,miR-155在DDH大鼠髋关节软骨组织中的表达上调,另见模型大鼠提示股骨头长径、横径和髋臼长径、横径及髋臼深度值均减小,提示miR-155可能在髋关节早期软骨退化及后期发展为OA过程中发挥一定的促进作用。通过体内下调miR-155水平后发现,大鼠股骨头及髋臼大小异常均有所改善,提示DDH软骨早期退变是可逆的,后期干预手段的实施对其具有积极意义。关节软骨在其整个厚度中具有不均匀的结构,从而在生理压缩载荷下驱动组织内生物力学应变分布的相关变化[12],但髋骨畸形导致了关节软骨的异常应力,受压后关节软骨表面对Ⅱ型胶原抗体有免疫屏障的隐形层被破坏,胶原纤维暴露在滑膜中,引起软骨细胞损伤,功能障碍,蛋白多糖分泌异常[13],软骨基质中硫酸化糖胺聚糖的损失可导致软骨变薄,被认为是早期软骨退化特征[14]。MMP-13是在软骨中表达的MMP家族的主要成员,在正常成人中不表达,OA患者中MMP-13水平表明软骨退化的程度,可促进软骨基质和Collagen Ⅱ降解,诱导软骨细胞凋亡,导致软骨损伤[15]。Collagen X是一种软骨特异性胶原蛋白,正常情况下,仅在肥大软骨和关节软骨的钙化区中发现,但在关节炎中随着软骨细胞肥大,可观察到其表达增加[16]。本研究中,DDH组大鼠软骨组织基质中蛋白聚糖染色程度显著减弱,且MMP-13和Collagen X mRNA及蛋白相对表达水平均增加,提示早期软骨退化发生;而下调miR-155后,蛋白聚糖染色加深,MMP-13和Collagen X表达下调,提示miR-155可能通过作用软骨细胞,促进其凋亡和抑制其功能而导致软骨发育受损,进而促进DDH大鼠软骨退化发生。
PI3K/AKT通路与软骨细胞凋亡和退化过程密切相关。Zhou等[17]研究发现,激活PI3K/Akt通路可减少软骨细胞胞外基质的降解,降低软骨细胞炎症和凋亡水平,从而在OA治疗中发挥作用;另有研究结果显示,在软骨早期退化阶段,OA软骨细胞中的自噬增加以保护软骨细胞免受对各种环境变化的适应性反应,但随着软骨逐渐退化,自噬减少[18],PI3K/Akt信号通路激活后可诱导细胞自噬进而保护大鼠OA软骨退变损伤[19]。据报道,miR-155对PI3K/Akt通路具有靶向调控作用。Fan等[5]研究表明,miR-155可靶向抑制PIK3R1进而抑制PI3K/Akt通路的激活,在体外可增强 IL-1β 诱导的软骨细胞凋亡和分解代谢活性;另有研究发现,miR-155可靶向抑制PI3KA表达进而抑制自噬依赖的经典PI3K/AKT/mTOR信号传导通路[20]。本研究中,见DDH组大鼠软骨组织中PI3K/Akt通路相关蛋白PI3K、Akt、mTOR及S6k1蛋白活性均降低,提示该通路被抑制;而下调miR-155表达后,PI3K、Akt、mTOR及S6k1蛋白活性均升高,提示miR-155可能通过抑制PI3K/Akt通路激活而促进DDH发展。
综上所述,通过下调miR-155可激活PI3K/Akt通路抑制DDH大鼠软骨退化程度,尽管未能阐述miR-155的具体作用靶点,但本实验为DDH分子机制及干预措施制定提供了一定依据,另关于miR155靶向PI3K/Akt通路具体是通过什么途径发挥抗软骨退化作用还需进一步探究。
利益相关声明:本文所有作者均声明不存在相关利益冲突。
作者贡献说明:侯平选负责实验总体设计、实验部分操作、数据收集及论文拟稿;鲜文峰负责试验部分操作及数据整理、分析;邢雅昶负责实验方法设计及论文内容润色、修改;左汴京协助实验准备及进行。

