电芬顿技术处理染料废水研究进展
刘家满,葛红花,于华强,李骥,张嘉琳,周振
(上海电力大学 上海热交换系统节能工程技术研究中心 上海市电力材料防护与新材料重点实验室,上海 200090)
水一直是人类赖以生存和发展的重要环境资源之一。随着人类进入工业社会,人类活动所造成的水污染已经成为严重的环境问题,纺织、印染、制革等行业排放的大量染料废水进入生态系统更是直接对人类和其它生物的健康造成威胁[1]。
污水处理厂已采用了多种方法(絮凝、膜分离、好氧或厌氧、混凝和吸附)来去除废水中的染料。而染料的强稳定性和生物降解抗性使得其在上述常规工艺下无法很好降解[2]。电芬顿(EF)作为一种新型水处理工艺已被证明能有效地对水中偶氮染料进行褪色和降解,它的主要特征是能够原位生成过氧化氢(H2O2)进而产生氧化性仅次于氟的羟基自由基·OH,将污染物降解成水和二氧化碳[3]。本文将结合相关案列研究对EF工艺的原理和发展进行简单介绍。
1 EF工艺的基本原理和特点
1894年,化学家Fenton H.J发现H2O2与Fe2+的混合溶液能够高效地将有机物(如羧酸、醇、酯类)氧化成无机物,因此这种具有强氧化性的混合液被命名为Fenton试剂。20世纪70年代人们应用该试剂治理环境污染并取得了不错的效果,随后以该试剂为核心的Fenton工艺作为一种高级氧化处理工艺在水处理领域得到了极大的关注。在Fenton工艺中,起作用的强氧化剂·OH通过外加H2O2与Fe2+进行反应生成[公式(1)]。H2O2的化学性质不稳定、受热容易分解的特性导致其在运输和保存过程中具有一定的危险和困难,同时反应生成大量需要清理的铁泥,这在一定程度上影响了Fenton工艺在废水处理中的广泛应用[4]。为了解决这些问题,学者们把目光转向了电催化工艺,将其与Fenton结合成为EF工艺。相较于Fenton工艺,EF工艺通过在酸性条件(pH 3~5)下O2在阴极表面发生两电子还原原位生成H2O2[公式(2)]减少了需要连续添加H2O2的成本与风险。产生的H2O2与Fe2+发生Fenton反应产生·OH和Fe3+[公式(1)],同时Fe3+会在阴极表面连续不断地还原成Fe2+[公式(3)]从而保证了充足的Fe2+与H2O2反应并避免了大量铁泥的生成[5]。由此可见,Fe2+在EF工艺中担任催化剂的角色。
Fe2++H2O2→ Fe3++·OH+OH-
(1)
O2+2H++2e-→ H2O2
(2)
Fe3++e-→ Fe2+
(3)
氧还原反应(ORR)是一个涉及了多个基本步骤和中间体多电子反应,除了公式(2)的两电子还原成H2O2后再进行两电子还原成H2O[公式(4)],还可以通过四电子没有中间体地直接还原成H2O[公式(5)]。也就是说,优秀的EF阴极材料应该容易发生二电子还原反应而避免能源的损耗,因此大量研究EF工艺的学者努力地开发具有高选择性即易将O2还原成H2O2的电极材料上。
H2O2+2e-+2H+→ 2H2O
(4)
O2+4e-+4H+→ 2H2O
(5)
除了直接影响H2O2产率的阴极材料,将H2O2反应成·OH的Fe2+等金属催化剂也是影响EF工艺降解效率和适用范围的重要因素,获得一款能高效进行氧化还原转换而且适用范围广的催化剂成为了学者们探索的另一个目标。
2 阴极材料
原位生成H2O2的性能和稳定性是判断新型阴极材料是否有价值的标准。如何通过对阴极材料的表面改性来提高过氧化氢产率、降低能耗、提高稳定性等已成为利用EF工艺处理染料废水的热点之一。贵金属((Pt、Pd、Ru等)及其合金材料氧还原过电位较小,同时拥有较高的产H2O2反应选择性(高达98%)[6],但这些金属基电极材料的高成本、资源稀缺和易产生毒副产物等缺点极大地限制了其大规模工业应用;而非贵金属(如不锈钢)因为较低廉的价格、不错的导电性和相对可接受的化学稳定性已被实际用作EF阴极材料,但EF工艺通常在酸性环境下进行的特点使得非贵金属制成的阴极极易受损和日常维护成本的大幅提升,所以非贵金属阴极材料的研究更注重提高耐腐蚀性和比表面积,现阶段的研究更偏向将网状非贵金属作为导电基底来固定碳材料制成电极。相较于金属阴极材料,碳材料具有资源丰富、形状样貌可塑性强、电化学性能稳定、无毒害、污染小等优点[7],显示出在EF工艺中的巨大应用前景,因此本文将重点讲述碳基材料作为电芬顿阴极的优缺点和发展方向。
2.1 碳材料分类
碳材料的形状样貌可塑性强,可将现有的阴极碳基材料分为二维和三维两大类。二维碳基材料应用最广的是石墨;三维常见的有石墨毡(GF)、活性碳纤维(ACF)、网状玻璃碳(RCV)等。
石墨作为最常见的碳材料电极,由于其优异的导电性和化学稳定性、价格低廉且易于大规模生产而在电催化高级氧化技术中被广泛应用,也是较早应用于EF工艺阴极的碳基材料,并取得了相对不错的性能。然而,石墨的比表面积较小、缺乏孔隙结构等因素导致石墨电极的传质效率较低,电化学产生H2O2效率低,因而学者们把目光投向了具有更大比表面积和更丰富孔隙结构的三维碳基材料。Petrucci等[8]在同等条件下比较了由石墨、GF、RCV三种不同材料制成的EF阴极的H2O2产率和亚铁离子的再生能力,结果表明GF和RCV两种三维材料制成的阴极在H2O2产率和亚铁离子再生性能方面均明显优于石墨制成的阴极材料。
相较于同类型的碳基材料,GF具有相对良好的机械强度和电催化活性,易于制造以及价格便宜等优点,是典型的三维碳基材料,但GF的疏水性带来的无法与溶解氧和污染物充分接触则一定程度上限制了其作为EF工艺阴极产H2O2和降解污染物的性能,所以GF一般作为原材料,通过各种改性手段来制成性能更好的EF工艺阴极材料[9-10]。
考虑到在染料废水处理上经常运用到的吸附手段具有不错的效果,学者们尝试并开发了具有吸附性、导电性和催化特性的潜在三维碳基材料ACF,在EF工艺中,将ACF的电吸附作用与阴极电芬顿作用相结合,通过吸附和电催化氧化作用对废水中各种有机污染物进行更有效地降解和去除[11]。
RVC独特的泡沫状结构使其具有更立体的三维结构和较大的孔径,在低流速的流通式反应器中较其它碳阴极有更好的应用效果,通过比较在相同条件下石墨、CF和RVC阴极的H2O2电生成和三价铁离子还原的性能,Petrucci等[8]认为RVC相较其它两种材料能更好地促进O2在电极表面的扩散,并受温度和pH影响小。但泡沫状结构也赋予了RVC脆弱的机械强度,这极大地限制了RVC普及度和应用范围[12]。
以上不同碳基材料都有其各自的优点和缺陷,因此对于不同的污染物和处理量可以灵活地选择适合的材料并进行目的明确的改性来使EF工艺的处理效率最大化。除了上述几种常见的的碳基材料,学者们还设计出各有特色的碳基材料(比如碳海绵[13]、碳泡沫[14])作为EF工艺的阴极来提高降解染料及其他污染物的效率。
对于三维多孔电极,气体扩散电极(GDE)作为多孔电极之一在增强气体向电化学界面传输有着广泛的应用。常见的EF工艺中,由于阴极是直接浸没在电解液中的,只有电解液中的溶解氧才能够与阴极接触并被还原成H2O2,由此可见电解液中O2的溶解度直接影响了阴极产H2O2的效率。然而在20 ℃,1 atm的条件下,氧气在水中的溶解度仅为 9.10 mg/L,不能满足ORR的氧气需求量;若为了保证溶解氧的饱和就需要不间断地进行曝气,这就增加了额外的能耗和资源浪费[15]。为了应对这个问题,学者们改进了在燃料电池、CO2电催化、N2电催化等方向上应用广泛的GDE[7]。EF工艺中的GDE的厚度相对较薄(3 mm及以下),通常由导电材料(如金属网)作为支撑基底,利用炭黑、石墨、碳纳米管、石墨烯等碳材料与黏结剂在基底材料两侧分别制成多孔的气体扩散层和催化层。气体扩散层具有高疏水性,在利于气体通过同时阻止溶液通过,使得电解液(液相)与空气(气相)通过电极(固相)分隔开;催化层上具有大量的活性位点便于到达催化层表面的O2发生二电子还原反应生成H2O2。但GDE机械稳定性不高、长期使用疏水性降低、成本昂贵等影响其商业化的问题需要通过更深入的研究来解决[16]。
2.2 改性方法
尽管已经商业化的碳基材料作为EF工艺阴极具有不错的性能,但为了进一步提高电极H2O2产率和稳定性,学者们尝试了大量方法去改良碳基材料,主要包括:掺杂其他碳材料、掺杂杂原子、沉积金属氧化物。
2.2.1 掺杂其他碳材料 引入不同的碳材料(粉末或者薄膜状)来辅助提升阴极EF性能是从促进O2的二电子还原反应发生的角度切入的。通常使用上述几种碳基材料作为载体,负载辅助碳材料包括炭黑、石墨烯、碳纳米管和活性炭等。炭黑作为一种已经工业化生产的催化剂,通常由含碳物质经不完全燃烧或热解形成,是一种增加比表面积和降低电阻的改性物材料的理想材料。Pan等[17]制备的多壁碳纳米管和炭黑共改性石墨毡电极(MWCNTs-CB/GF)显著提高了H2O2的产率和对污染物的降解速率。线性扫描伏安法结果表明,炭黑的存在增加了对O2还原的催化活性,并提高了电极的导电性。石墨烯是一种以sp2杂化连接的碳原子紧密堆积成单层二维蜂窝状晶格结构的新材料,由于其卓越的电、光学、物理、热、高比表面积和机械性能而受到广泛关注,Liu等[18]通过电聚合的方法将3,4-乙烯二氧噻吩和石墨烯的聚合物负载到GF上进行电极材料改性使得电极具有更高的导电性和稳定性,实现了更高H2O2的产率且在重复使用10次后仍保持84.2%的产H2O2性能。碳纳米管因优秀的导电性和巨大的比表面积同样受到较多关注,Tao等[19]利用碳纳米管改性ACF使得改性后的阴极材料产H2O2性能提高了20多倍。活性炭也可以用来掺杂,但其性能不如上述其他材料。
2.2.2 掺杂杂原子 碳骨架的高度可调是碳材料被广泛运用的原因之一。通过在碳骨架中掺杂各种杂原子(O、N、F、B和P等)来改变碳晶格的局部电子结构[7],并产生部分带正电或负电的基团,可以在不明显影响材料导电性的前提下增加活性位点和促进二电子氧还原反应的发生[20]。

除了氧,其它杂原子掺杂更常被用在四电子氧还原反应生成水的能源转换领域。氮掺杂主要通过热处理和水热等方法引入吡啶氮、吡咯氮、石墨氮和吡啶氮氧化物这4种基团[10]。在用于二电子氧还原生成H2O2的探索中,Sun等[23]研究了多种氮掺杂碳材料从而证明了氮掺杂可以有效地提高阴极产H2O2速率并且在酸性、中性和碱性溶液中都有不错的性能。氟的掺杂可以破坏并改变碳晶格的电子结构,从而改善电极和电解质间的电子转移速率。 Zhao等[24]开发出的F掺杂多孔碳有效证明了氟原子的掺杂量影响了H2O2的产率和Fe2+与Fe3+之间的循环。
其他杂原子的单独掺杂在EF领域研究相对较少,学者们更专注于两个或多个杂原子的共掺杂来改善电极材料的性能[9]。
2.2.3 沉积金属氧化物 负载非贵金属(Fe、Mn、Co等)催化剂包括金属氧化物、掺杂金属的导电聚合物、利用非贵金属修饰的碳材料和其他一些合理的材料是改性阴极材料的另一个策略。研究表明,非贵金属催化剂的使用可以扩大阴极比表面积、增加ORR活性位点、促进二电子氧还原反应,为阴极EF反应提供有利条件[5]。当然,由于金属在EF工艺中一般具有催化剂的功能,而且沉积到阴极表面的金属大都是以固态附着物的形式存在,所以通常将非贵金属负载到阴极表面的EF系统按催化剂的存在形式分作非均相EF。
3 催化剂
如何快速有效地将产生的H2O2转化为强氧化剂·OH与催化剂离子间价态循环息息相关。按照催化剂是以液态还是固态加入,将EF工艺分为均相EF和非均相EF。
3.1 均相
与传统Fenton工艺相同,EF工艺的催化剂来源也是可溶性铁盐(FeSO4)。随着工艺体系中的催化剂达到一定浓度,EF工艺中的·OH含量也会达到一个平台期,而过量的Fe2+会降低EF工艺的降解效率,则是因为多余的Fe2+与·OH进一步反应[公式(6)][25]。
在实际应用方面的优点是催化剂的用量少而且价格便宜,缺点是适用范围窄,只有在酸性(pH 2.8~3.5)条件下有很好的处理废水的效果。当pH<2.8时,阴极产生的H2O2会携带过氧化氢离子(H3O2+),无法有效地与Fe2+发生反应;同时,阴极的析氢电位会随着酸度的变强而降低,使得阴极更容易产生H2而不是H2O2。当pH>4.5时,Fe3+容易变成Fe(OH)3析出,降低了铁离子的溶解度,同时阴极产生的H2O2会分解成水和氧气而不是·OH[公式(7)][26]。所以,如何保证均相EF工艺在更宽的pH范围内的稳定运行,是阴极材料改性研究的一个目标[27]。
Fe2++·OH→ Fe3++OH-
(6)
2H2O2→ O2+2H2O
(7)
3.2 非均相
为了拓宽Fenton工艺在染料等工业废水处理的应用范围和克服催化剂难以从污水中分离回收的问题,许多学者把研究集中到了非均相体系中。含不溶性铁的固体(天然铁矿物、纳米零价铁[28]、多金属化合物[29])被证明具有良好的催化剂效果,而理想的非均相Fenton催化剂应具有较高的选择性,将H2O2作为唯一试剂在催化剂表面的活性位点进行反应;同时良好的稳定性使其能在较宽的pH范围具有Fenton活性,避免氢氧化物的浸出和沉淀,可以重复使用。含不溶性铁的固体往往因具有过高的表面能而发生团聚导致活性位点下降,稳定性不高。因此,将催化剂负载在固体材料(碳材料、黏土、树脂等)上成为提高催化剂性能和稳定性的发展方向[30]。
固体载体通常具有高导电性、多孔和高比表面积等优点,与催化剂结合会产生协同效果,可以保证催化剂均匀分布并聚集污染物使其有效地降解。
零价铁和磁铁矿是常见的两种催化剂,其中基于零价铁的催化剂因成本效益高、与废水中多种有机和无机污染物接触后可以产生较高的活性、无二次污染等优点受到了广泛关注[31];而作为铁矿物中的代表磁铁矿则是具有磁性和特殊的尖晶石结构导致的高电子迁移率使其成为最常用的铁矿物[32]。
4 EF工艺处理染料废水的应用
在大多数方法中,改性后的电极或者催化剂都可以明显提高染料等废水的降解效率。表1中归纳一些最新的对于模拟染料废水的降解。为了便于比较,涵盖了不同的阴极材料和催化剂。
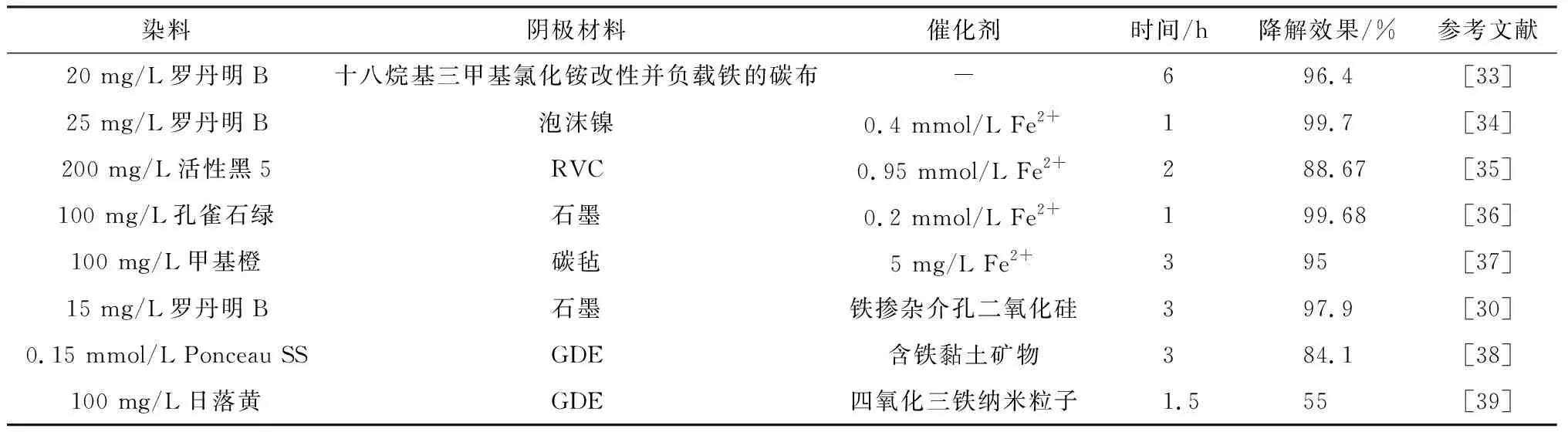
表1 文献中染料的降解效率Table 1 Degradation efficiency of dyes in literature
5 结论和展望
染料废水是工业水处理的重要目标,现阶段的实验室规模的EF工艺对于降解染料废水具有不错的成效,然而就实际应用角度,还有许多细节需要进一步探索。
(1)阴极材料的稳定性,许多改性方法都是在基底材料上附着改性物质来提高性能,进行降解时水流的冲击、偏酸偏碱的环境可能会加快改性物的脱落。如何通过有效的改性工艺使得电极材料的稳定性更长久需要进一步探索。
(2)GDE所形成的三相界面具有更高效的降解效率,值得被推广运用。目前的成本造价对于大规模实际运用有点昂贵,一款高效实惠的材料需要更多的研究开发。
(3)尽管发现非均相催化剂可以拓宽废水的pH范围,但还需要更深的研究来探索非均相EF工艺降解过程中催化剂转化机理,从而大幅提高催化剂的重复利用率。

