溴氰虫酰胺对小菜蛾肠道微生物群落及其代谢功能的影响
向立刚,李文红,郑 苹,李凤良,汪汉成,余知和
(1. 长江大学 农学院,湖北 荆州 434025;2. 贵州省农业科学院 植物保护研究所,贵州 贵阳 550006;3. 贵州省烟草科学研究院,贵州 贵阳 550081;4. 长江大学 生命科学学院,湖北 荆州 434025)
小菜蛾[Plutella xylostella(Linnaeus)]是一种以十字花科植物为主要寄主的世界性迁飞害虫[1],其幼虫取食会降低作物的品质与产量,严重制约着十字花科作物的生产。全球每年因小菜蛾造成的经济损失高达数十亿美元[2]。目前,对于小菜蛾的防治仍以化学防治为主,但由于杀虫剂的连续、大量使用加速了小菜蛾抗药性的发展。研究表明,小菜蛾在我国不同地区对氰戊菊酯[3]、氯虫苯甲酰胺[4]、阿维菌素[5]和高效氯氰菊酯[6]等药剂已产生了不同程度的抗性。因此,将高效、低毒杀虫剂与常用药剂交替使用有利于降低小菜蛾对各类杀虫剂产生抗药性的速度和程度,对保证作物生产安全具有重要的现实意义。
杀虫剂在发挥其作用的同时必定会影响昆虫肠道微生物的组成和生理代谢活动[7-9]。研究表明,拟除虫菊酯类杀虫剂可降低棉铃虫肠道中有益菌相对丰度,增加致病菌相对丰度,并影响肠道菌群代谢能力[10]。在长期氯虫苯甲酰胺和氟苯虫酰胺选择压力下,小菜蛾抗性品系较敏感品系肠道中的变形菌门丰度增加,厚壁菌门丰度降低[11]。LI 等[12]研究表明,溴氰菊酯的长期作用增加了麦芽香肉杆菌(Carnobacterium maltaromaticum)在小菜蛾肠道中的相对丰度。化学药剂可影响宿主昆虫肠道微生物群落结构及代谢功能,肠道菌群也可促进宿主降解有害物质[13]、产生抗药性[14]以及抵御病原微生物入侵[15]。如斯氏按蚊(Anopheles stephensi)肠道细菌可参与有机磷杀虫剂的降解[16],橘小实蝇(Bactrocera dorsalis)肠道中柠檬酸杆菌(Citrobacter)在敌百虫的降解中起着关键作用[17]。
溴氰虫酰胺为双酰胺类杀虫剂,自2012年上市以来便被广泛应用于小菜蛾的防治,且防治效果良好[18],但目前也有部分地区的小菜蛾对其产生了抗药性[19-20]。前人研究表明,肠道微生物在昆虫抗药性方面发挥着重要作用,但目前鲜有关于小菜蛾肠道微生物群落的研究报道,而溴氰虫酰胺作用下小菜蛾肠道微生物群落的研究更少。为此,采用分离培养技术、高通量测序技术以及Biolog-ECO 碳源代谢表型技术,探究溴氰虫酰胺处理对小菜蛾肠道微生物群落结构以及代谢功能的影响,旨在为延缓小菜蛾对溴氰虫酰胺的抗药性提供参考。
1 材料和方法
1.1 材料
供试小菜蛾为贵州省植物保护研究所昆虫研究室室内长期不接触任何药剂饲养的单一敏感品系。
97%溴氰虫酰胺(Cyantraniliprole)原药由美国杜邦公司提供。其余仪器、耗材信息如下:Biolog GEN ⅢOmnilog 全自动微生物鉴定系统(BIOLOG公司)、Biolog-ECO 碳源代谢板(BIOLOG 公司,#1506)、超微量分光光度计(Thermo Fisher Scientifc公司,NanoDrop 2000)、营养琼脂(Solarbio 公司,N8290)、PCR 仪(Applied Biosystems 公 司,Veriti 9902)、TGrinder 第3 代 变 速 组 织 研 磨 器 套 装(TIANGEN 公司,OSE-Y50)、基因组DNA 提取试剂盒(Omega Bio-Tek公司,D5625-01)。
1.2 方法
1.2.1 溴氰虫酰胺对小菜蛾的毒力测定 采用浸叶法测定小菜蛾对溴氰虫酰胺的敏感性。先用97 mL 含9.7 mL 10% TritonX-100 的丙酮将0.01 g 97%的溴氰虫酰胺配制成100 mg/L 的母液,再用无菌水将待测药剂分别稀释成1、0.5、0.25、0.125、0.062 5、0.031 25 mg/L 待用;用剪刀将甘蓝叶剪成直径9 cm 的圆片状,分别于不同质量浓度药液中浸泡30 s,取出于阴凉处晾至表面无水痕,放入培养皿,每个培养皿一片甘蓝叶,以浸泡含0.9%丙酮和0.1%TritonX-100无菌水的叶片为对照(CK)。挑取生长状况一致的三龄小菜蛾幼虫,放于培养皿中的叶片上,每皿10 头,每个质量浓度重复4 次。接虫后,将培养皿置于(25±1)℃、光周期L∶D=16∶8 的恒温培养箱中培养,48 h 后检查并记录小菜蛾的死亡数。采用DPS 软件对数据进行处理,计算溴氰虫酰胺对小菜蛾的毒力回归方程及半致死质量浓度(LC50)。
1.2.2 溴氰虫酰胺对小菜蛾肠道可培养细菌的影响测定 根据1.2.1 中敏感性测定结果,选取1 mg/L溴氰虫酰胺对小菜蛾进行处理。将新鲜甘蓝叶片在溴氰虫酰胺药液中浸泡30 s,取出晾干至表面无水痕,放入小菜蛾饲养盒中,并接入生长一致的三龄小菜蛾幼虫,以浸泡含0.9%丙酮和0.1% Triton-100 无菌水的新鲜甘蓝叶片饲喂小菜蛾幼虫作为对照。12 h 后,分别从溴氰虫酰胺处理和对照中选取健康且生长一致的个体进行后续肠道样品采集。在对照和溴氰虫酰胺处理中分别随机挑选健康且大小一致的小菜蛾幼虫100 头,称取其质量用于每克小菜蛾细菌群落数的计算。幼虫饥饿2 h 后置于75%乙醇中体表消毒90 s,再用0.8%的生理盐水冲洗3 次,最后在超净工作台上解剖挑取肠道。将对照与1 mg/L 溴氰虫酰胺处理的幼虫肠道置于2 mL无菌离心管中,加入1 mL 0.8%的生理盐水,立即用组织研磨器进行匀浆处理。然后用生理盐水将组织匀浆按照10-4、10-5、10-6进行稀释涂板,将上述平板置于30 ℃恒温培养箱中培养,72 h后根据菌落大小、颜色和形态等分离纯化单菌落。
使用基因组DNA 提取试剂盒提取纯化菌株基因 组DNA,以 提 取 的 总DNA 为 模 板,27F(5′-AGAGTTTGATCMTGGCTCAG-3′ )和1492R(5′-GGTTACCTTGTTACGACTT-3′)为 引 物 扩 增16S rRNA 基因片段,PCR 反应条件及体系参考夏晓峰等[21]的方法。将扩增产物送至生工生物工程(上海)股份有限公司测序,测序结果在GenBank 数据库中进行BLASTn比对分析。
1.2.3 溴氰虫酰胺对小菜蛾肠道细菌群落结构的影响测定 按1.2.2中的方法处理小菜蛾,对照和溴氰虫酰胺处理分别随机挑选小菜蛾幼虫200 头,收集肠道组织。采用基因组DNA 提取试剂盒提取小菜蛾幼虫肠道细菌群落DNA,每样品取50 头幼虫肠道,每组重复4 次(对照:CK1、CK2、CK3、CK4;溴氰虫酰胺处理:CY12-1、CY12-2、CY12-3、CY12-4)。随后采用超微量分光光度计检测其质量与浓度。以检测合格的DNA 为模板,27F 和1492R 通用引物进行PCR 扩增,其扩增体系与程序参考YUAN等[22]的方法。扩增产物经纯化后送至上海派森诺生物科技有限公司,采用PacBio Sequel 平台进行三代扩增子测序,测序后的生物信息学分析均在派森诺基因云平台(https://www.genescloud.cn/home)进行。
首先,通过QIIME2(2019.4)软件qiime cutadapt trim-paired 程序切除序列的引物片段,弃去未匹配引物的序列;利用DADA2 进行质控、去噪、拼接、去嵌合体;采用Classify-sklearn 算法[23]将过滤后的序列与Silva 数据库进行物种分类学注释;使用qiime feature-table rarefy 功能对样品中的序列进行抽平,用于后续Alpha、Beta 多样性分析等;运用R 语言和ggplot2 包计算样品微生物群落香农(Shannon)[24-25]、辛普森(Simpson)[26]、Chao1[27]、物种丰富度(Observed species)、皮 诺(Pielou)[28]和 覆 盖 度(Good’s coverage)[29]等Alpha 多样性指数;通过R 语言和ape包等基于Bray-Curtis 距离[30]进行Beta 多样性的主坐标分析(PCoA);最后通过Python LEfSe 包、R 语言和ggtree 包将非参数的Kruskal-Wallis 以及Wilcoxon 秩和检验与线性判别分析(Linear discriminant analysis,LDA)效应量相结合在LDA 阈值为3的情况下进行LEfSe物种差异分析[31]。
1.2.4 溴氰虫酰胺对小菜蛾肠道微生物代谢功能的影响测定 按1.2.2中的方法处理小菜蛾,对照和溴氰虫酰胺处理分别随机挑选小菜蛾幼虫100 头,收集肠道组织,加入1 mL 0.8%的生理盐水,立即用组织研磨器进行匀浆处理,再用0.8%的生理盐水定容至12 mL。最后,在无菌条件下将悬浮液加入到Biolog-ECO 碳源代谢板中,每孔100 mL,将接种好的ECO 碳源代谢板置于OmniLog 系统中28 ℃孵育并自动读数。另取500 头小菜蛾幼虫,挑取肠道于15 mL 无菌离心管中,加入少量生理盐水进行组织匀浆,定容至60 mL。分别取11.8 mL 组织悬浮液分装至5 个无菌离心管中,并分别与0.2 mL 6 000、600、60、6、0 mg/L 溴氰虫酰胺溶液混合,配制成最终测试质量浓度为100、10、1、0.1、0 mg/L 的溴氰虫酰胺肠道组织悬浮液。涡旋混匀后将其分别加入到5 块Biolog-ECO 碳源代谢板中,于OmniLog 系统中28 ℃孵育并自动读数,直至读数恒定(96 h),读数的大小反映微生物群落代谢能力的强弱。基于OmnilLog 读数采用HemI 1.0 构建肠道微生物代谢功能热图。
1.3 数据统计分析
溴氰虫酰胺处理与对照间小菜蛾肠道可培养细菌总数目、门和属水平细菌相对丰度、Alpha 多样性指数以及肠道微生物群落碳源代谢能力的差异性检验均采用Duncan’s 新复极差法进行;利用Wilcoxon 秩和检验进行LEfSe 物种差异分析的显著性检验。
2 结果与分析
2.1 溴氰虫酰胺对小菜蛾的毒力
本试验所用小菜蛾为溴氰虫酰胺敏感性品系,其毒力回归方程为y=2.133 1x+6.801 9,LC50为0.143 mg/L。根据毒力测定结果及实际生产中往往扩大使用倍数的现实,后续将对小菜蛾进行处理的溴氰虫酰胺质量浓度设为1 mg/L。
2.2 小菜蛾肠道可培养细菌的数目与种类
肠道可培养细菌分离试验结果表明,1 g对照小菜蛾的肠道细菌群落总数约为4.5×106cfu,1 g 1 mg/L 溴氰虫酰胺处理小菜蛾的肠道细菌群落数约为2.4×106cfu,说明溴氰虫酰胺处理显著降低了小菜蛾肠道可培养细菌群落数(P<0.05)。根据菌落形态,分别从溴氰虫酰胺处理和对照中选取36株代表性纯化菌株进行16S rDNA 鉴定分析。结果表明,对照36 株菌中4 株为血杆菌(Sanguibactersp.),32 株为蒙氏肠球菌(Enterococcus mundtii);溴氰虫酰胺处理中10 株为血杆菌,26 株为蒙氏肠球菌。72 株菌的序列均上传至GenBank 数据库(基因登录号:MZ869106—MZ869177)。
2.3 基于16S rRNA基因测序的小菜蛾肠道细菌群落结构
2.3.1 小菜蛾肠道细菌群落组成 原始序列经过优化处理之后,对照中能同时匹配到正向和反向引物的序列共37 989 条,单一样本序列数在8 893~10 327 条,去噪后有效序列共32 049 条。溴氰虫酰胺处理中能同时匹配到正向和反向引物的序列共38 359条,单一的样本序列数在8 713~11 257条,去噪后有效序列共32 394 条。在97%的相似度水平对样品序列进行OTU 聚类,结果表明,对照中4 个样本共鉴定到细菌7 个门,4 个目,6 个科,31 个属;溴氰虫酰胺处理中4 个样本共鉴定到细菌7 个门,4个目,35个科,60个属。
在门水平,厚壁菌门(Firmicutes)为绝对优势菌,在正常小菜蛾(对照)肠道细菌群落中的相对丰度为94.0%,经溴氰虫酰胺处理后相对丰度显著降低至74.0%(P<0.05);蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)在对照小菜蛾肠道细菌群落中的相对丰度分别为3.4%、0.5%,而在溴氰虫酰胺处理中二者相对丰度分别显著增加至8.6%、2.5%(P<0.05);变形菌门(Proteobacteria)在对照小菜蛾肠道细菌群落中的相对丰度(0.8%)低于溴氰虫酰胺处理(13.4%),且溴氰虫酰胺处理CY12-1 和CY12-4 样品中的变形菌门相对丰度明显高于其他样品(图1A)。
在属水平,肠球菌属(Enterococcus)为绝对优势菌,溴氰虫酰胺处理中其相对丰度(74.0%)显著低于未经处理的对照(94.0%)(P<0.05);对照小菜蛾肠道样品中血杆菌属(Sanguibacter,0.5%)和菖蒲属(Acorus,0.11%)相对丰度显著低于溴氰虫酰胺处理(血杆菌属2.5%,菖蒲属0.34%)(P<0.05);假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、草螺菌属(Herbaspirillum)、泛菌属(Pantoea)、寡养单胞菌 属(Stenotrophomonas)、鞘 氨 醇 杆 菌 属(Sphingobacterium)、梭菌属(Clostridium)只存在于溴氰虫酰胺处理部分样品中(图1B)。
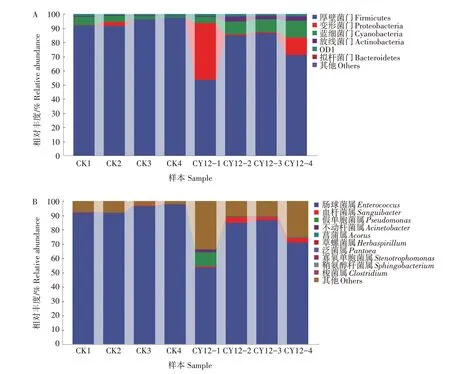
图1 小菜蛾肠道细菌群落组成Fig.1 The composition of intestinal bacterial community of P.xylostella
2.3.2 小菜蛾肠道细菌群落的Alpha 多样性
Alpha 多样性指数分析结果表明,溴氰虫酰胺处理后小菜蛾肠道细菌群落的多样性(Shannon、Simpson 指数)、丰富度(Chao1、Observed species 指数)和均匀度(Pielou指数)均增加,而覆盖度(Good’s coverage 指数)降低。对照小菜蛾肠道细菌群落Shannon、Simpson 指 数 分 别 为2.02、0.67,Chao1、Observed species指数均为12.23,Pielou指数为0.56,Good’s coverage 指数为0.999 978;溴氰虫酰胺处理小菜蛾肠道细菌群落Shannon、Simpson、Chao1 和Observed species 指数均显著增加,分别为2.95、0.78、26.98、26.95,Pielou 指数虽有增加但与对照无显著差异,Good’s coverage指数较对照降低,但无显著差异(图2)。

图2 属水平上小菜蛾肠道细菌群落Alpha多样性指数Fig.2 Alpha diversity index of intestinal bacterial community of P.xylostella at genus level
2.3.3 小菜蛾肠道细菌群落的Beta 多样性 基于Bray-Curtis 距离的细菌群落主坐标分析(PCoA)如图3 所示,对照组4 个样品聚集在一起,表明对照组小菜蛾肠道细菌类群组成相似;而溴氰虫酰胺处理4个样品间细菌类群组成差异较大,尤其CY12-1与其余3个样品间差异较大。溴氰虫酰胺处理组与对照组样品在图中被明显区分开,表明溴氰虫酰胺处理后小菜蛾肠道菌群组成与对照组存在较大差异。
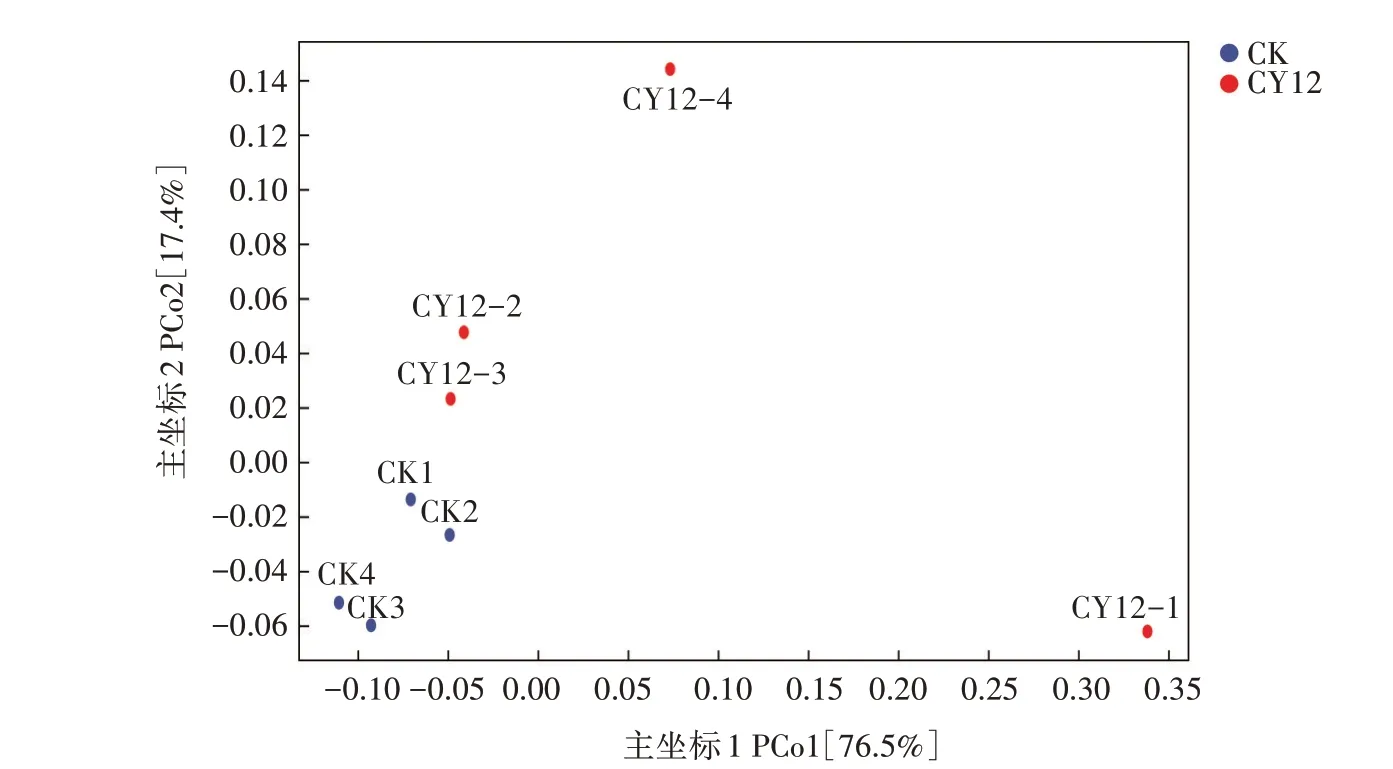
图3 小菜蛾肠道细菌群落的主坐标分析Fig.3 Principal coordinates analysis of intestinal bacterial community of P.xylostella
2.3.4 小菜蛾肠道细菌群落的物种差异分析
LEfSe 物种差异分析结果表明,在LDA 阈值为3的情况下,厚壁菌门、肠球菌属、杆菌纲(Bacilli)、乳杆 菌 目(Lactobacillales) 和 肠 杆 菌 科(Eenterobacteriaceae)的细菌在对照中高于溴氰虫酰胺处理,为对照的标志菌群。蓝细菌门、假单胞菌目(Pseudomonadales)、放线菌门、血杆菌属、血杆菌科(Sanguibacteraceae)、放线菌纲(Actinobacteria)、放 线 菌 目(Actinomycetales)、伯 克 氏 菌 目(Burkholderiales)、β-变形菌纲(Betaproteobacteria)、菖蒲属、立克次氏体目(Rickettsiales)、α-变形菌纲(Alphaproteobacteria)在溴氰虫酰胺处理中的相对丰度高于对照,为溴氰虫酰胺处理的标志菌群(图4)。
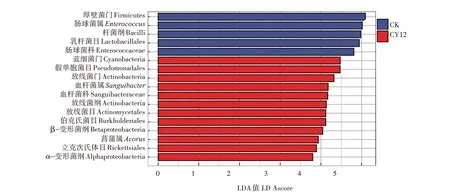
图4 小菜蛾肠道细菌群落的LEFSe物种差异分析Fig.4 LEFSe species difference analysis of intestinal bacterial community of P.xylostella
2.4 溴氰虫酰胺对小菜蛾肠道微生物代谢功能的影响
以1 mg/L 溴氰虫酰胺处理的甘蓝叶饲喂小菜蛾后,小菜蛾肠道菌群对α-环糊精、D-纤维二糖、D-甘露醇、N-乙酰基-D-葡萄糖胺、4-羟基苯甲酸、L-丝氨酸和苯基乙胺的代谢能力降低,对葡萄糖-1-磷酸盐、D-半乳糖酸-γ-内酯、D-苹果酸和L-精氨酸的代谢能力增加(图5A)。
在0.1 mg/L和1 mg/L溴氰虫酰胺的直接胁迫作用下,小菜蛾肠道微生物对ECO 碳源代谢板中31种碳源代谢的能力与对照(0 mg/L)无显著差异,对衣康酸、L-精氨酸、L-天冬酰胺酸、L-苯基丙氨酸、L-苏氨酸和甘氨酰-L-谷氨酸的代谢能力略微降低。在10 mg/L 溴氰虫酰胺直接胁迫下,肠道微生物对吐温40、吐温80、糖原、D-纤维二糖、α-D-乳糖、β-甲基-D-葡萄糖苷、D,L-α-甘油磷酸盐、i-赤藓糖醇、γ-羟基丁酸、α-丁酮酸、L-丝氨酸和苯基乙胺12种碳源代谢能力与对照无明显差异,对于剩余19 种碳源的代谢能力均有不同程度的降低。在100 mg/L 溴氰虫酰胺胁迫下,小菜蛾肠道微生物群落对于31种碳源的代谢能力均降低,且对i-赤藓糖醇、D-甘露醇、4-羟基苯甲酸、L-苏氨酸等多数碳源的代谢能力降低显著(图5B)。
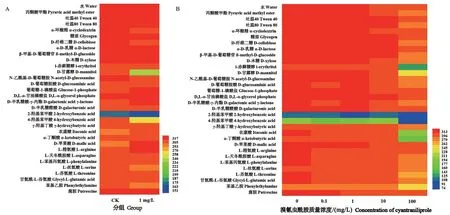
图5 溴氰虫酰胺对小菜蛾肠道菌群代谢功能的影响Fig.5 The effects of cyantraniliprole on the metabolic function of intestinal microflora in P.xylostella
3 结论与讨论
肠道微生物在小菜蛾的生长发育中发挥着至关重要的作用,肠道菌群的紊乱会导致宿主免疫调节能力、取食消化能力以及病原清除能力降低[32]。本研究表明,溴氰虫酰胺对小菜蛾肠道微生物的群落组成及代谢功能均存在影响。沈金红等[33]发现,抗生素处理可清除小菜蛾肠道可培养细菌,而本研究中溴氰虫酰胺处理只是显著降低了小菜蛾肠道中部分可培养细菌数量,未能完全将其清除,可能是因为溴氰虫酰胺主要是作用于昆虫本身,对肠道菌群的影响不及抗生素。相关研究表明,小菜蛾肠道可分离的细菌包括沙雷氏菌属(Serratia)、肠杆菌属(Enterobacter)、寡氧单胞菌属、香味菌属(Myroides)、肉食杆菌属(Carnobacterium)和肠球菌属等[12,21,34]。而本试验中只分离出血杆菌和蒙氏肠球菌2 类,这可能是受到了培养基和分离条件的限制,后续将通过增加培养基类型、优化培养条件,从而分离出更多的肠道细菌。蒙氏肠球菌除了在小菜蛾肠道中大量存在外,在家蚕[35]、粉纹夜蛾[36]以及棉铃虫[37]等昆虫肠道中也有分布。推测该细菌可能是昆虫肠道中普遍存在的菌群,其对宿主的作用和功能有待后续深入研究。
不同药剂对不同宿主昆虫肠道微生物的影响不同,七氟菊酯和溴氰菊酯处理后棉铃虫肠道厚壁菌门和蓝细菌门相对丰度升高,拟杆菌门相对丰度降低[10]。本研究中,高通量测序结果表明,对照小菜蛾肠道中厚壁菌门为最优势菌门,其相对丰度大于90%,这与LI 等[12]的研究结果一致。溴氰虫酰胺处理后小菜蛾肠道厚壁菌门相对丰度降低,而变形菌门和蓝细菌门相对丰度增加。属水平上,肠球菌属为所有样品的优势菌属,溴氰虫酰胺饲喂处理后其相对丰度显著降低。相关文献表明,肠球菌属可增加小菜蛾对毒死蜱的抗性[38],而其是否能增加小菜蛾对溴氰虫酰胺的抗性有待后续试验进一步验证。溴氰虫酰胺处理后小菜蛾肠道微生物多样性显著提高,这可能是由于溴氰虫酰胺处理后导致小菜蛾肠道环境改变,优势菌群数量降低,非优势菌群数量增加。
前人研究表明,碳源代谢能力与微生物数量呈正相关关系[39]。小菜蛾肠道可培养细菌分离结果表明,溴氰虫酰胺浸叶饲喂后的小菜蛾肠道可培养细菌数低于对照,因此,其碳源代谢能力低于未经溴氰虫酰胺处理的小菜蛾肠道微生物。通过Biolog-ECO 碳源代谢表型试验还发现,溴氰虫酰胺浸叶饲喂处理对小菜蛾肠道菌群碳源代谢的影响高于溴氰虫酰胺直接对肠道菌群的作用。这可能是因为溴氰虫酰胺是一种内吸性杀虫剂,并未直接作用于微生物群落本身,而是通过降低小菜蛾自身的机能、改变肠道环境,最终影响肠道微生物的数量以及代谢能力。据报道,植物叶际微生物对植食性昆虫肠道菌群的形成有着重要的作用[40],GAYATRI PRIYA 等[41]研究表明,棉铃虫肠道细菌可能源于其寄主植物叶片。因此,推测溴氰虫酰胺是通过降低小菜蛾取食量引起肠道菌群数量下降,从而降低小菜蛾肠道微生物的碳源代谢能力,该假设将在后续研究中加以验证。
本研究通过传统分离培养技术、高通量测序技术以及代谢表型技术研究了溴氰虫酰胺作用下小菜蛾肠道细菌群落组成以及微生物代谢能力的变化情况。传统分离培养结果表明,小菜蛾肠道可培养优势细菌主要为蒙氏肠球菌和血杆菌,经1 mg/L溴氰虫酰胺浸叶饲喂处理后小菜蛾肠道可培养细菌数目显著降低。高通量测序结果表明,厚壁菌门、蓝细菌门和变形菌门为小菜蛾肠道优势细菌门,肠球菌属和血杆菌属为优势菌属。1 mg/L 溴氰虫酰胺浸叶饲喂处理小菜蛾肠道中细菌群落多样性、均匀度和丰富度均不同程度的增加。Biolog-ECO 代谢表型试验结果表明,低质量浓度溴氰虫酰胺无论是浸叶饲喂还是直接作用对小菜蛾肠道菌群的代谢能力均无明显影响,而高质量浓度溴氰虫酰胺直接作用可降低肠道微生物的碳源代谢能力。

