基于高通量测序分析喙核桃内生真菌多样性
张桂华李旦 何承忠
(1. 西南林业大学生物多样性保护学院,云南 昆明 650224;2. 西南林业大学林学院,云南 昆明 650224;3. 西南林业大学云南生物多样性研究院,云南 昆明 650224;4. 云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224)
喙核桃(Annamocarya sinensis)属于胡桃科(Juglandaceae)喙核桃属常绿乔木,是第三纪古热带孑遗植物[1],为«全国极小种群野生植物保护实施方案»中保护物种,«中国植物红皮书»中濒危等级物种,2021年«国家重点保护野生植物名录»中的二级保护植物。喙核桃仅在中国西南部和越南北部有分布,中国仅分布于贵州、广西、云南[2]。喙核桃繁育困难,自我更新能力弱,野外分布范围极其狭窄,多年来人为破坏严重,植株数量极少,极度濒临灭绝[3],有必要对其展开多方面研究,以解决其濒临灭绝的问题。
植物内生菌是指其生活史的一定阶段或全部阶段定殖于植物器官、组织内部以及细胞间隙的微生物,可分为植物内生真菌、细菌及放线菌[4,5]。植物内生菌与宿主植物之间长期协同进化,形成互利共生关系,植物能提供内生菌生长所需的营养物质和生存空间,内生菌的一些代谢物质如生长激素、抗生素、分泌蛋白酶等可以促进植物的生长发育[6,7],并且可以协助参与植物活性成分和次生代谢产物的合成,有些内生菌的代谢产物还可以增加宿主植物对外界恶劣环境的抗逆性及提高宿主植物的抗病性[8]。Wu 等[9]发现三七内生菌的丰富度大小影响植株正常发育;Fadaei 等[10]研究表明杜鹃花类菌根真菌能增强杜鹃花科植物的耐盐性。
对植物内生真菌的分离主要是通过体外培养法纯化得到。然而近年来的研究表明,传统的纯化培养法所鉴定的微生物仅占环境微生物总数的0.1%~10%[11]。有的内生菌不能在人工培养基上生长,是因人工培养基缺乏来自宿主植物的某些具有相互作用的活性物质,从而导致一些内生菌不可培养[12]。高通量测序技术是新一代测序方式,具有测序速度快、信息量大、准确率高的优点,将此技术应用于揭示微生物的物种和群落多样性具有很强的优势性[13]。
本课题组前期研究发现,喙核桃自身繁育困难,种子萌发率极低,无法通过嫁接、扦插等无性繁殖方法扩大种群数量,利用组织培养的方法对其展开腋芽诱导以及愈伤组织诱导发育成完整植株的试验研究,均因内生真菌污染导致试验失败。本研究采用高通量测序技术对喙核桃幼嫩茎段和叶片中真菌rDNA ITS 基因进行提取并测序,结合生物信息学对喙核桃幼嫩茎段和叶片中内生真菌多样性进行分析,探讨喙核桃内生真菌的多样性,以期为其内生真菌资源开发利用及其他研究提供理论依据。
1 材料与方法
1.1 试验材料
于2021年12月采摘课题组前期培育于西南林业大学苗圃的新鲜、健康、无虫害喙核桃3年实生苗幼嫩茎段和叶片作为内生真菌测序所用试验材料。
1.2 材料处理
茎段和叶片材料采集后迅速带回实验室,使用洗洁精溶液浸泡20 min,并用软毛刷擦拭清理材料表面,之后流水冲洗6 h。将冲洗好的材料移至超净工作台上,进行不同消毒处理(表1)。
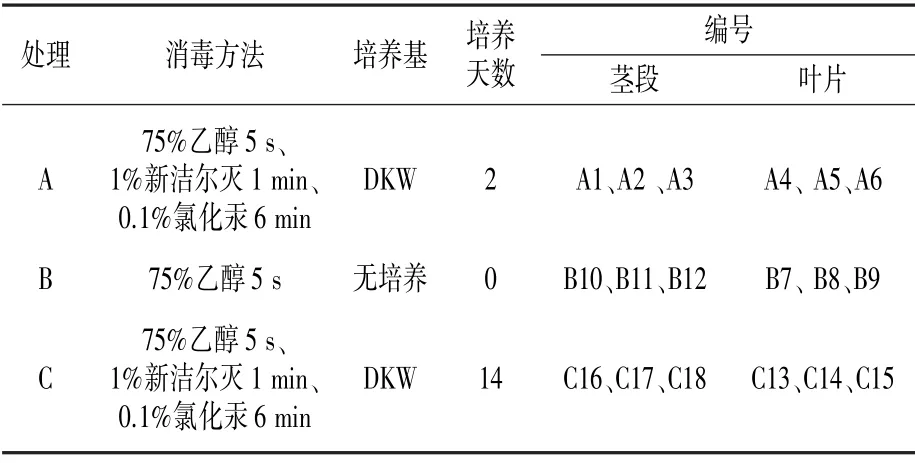
表1 材料预处理方法
详细步骤为:(1)把茎段和叶片移入无菌培养瓶中,使用75%乙醇浸泡消毒5 s 后取出,用无菌水清洗3 次,每次2 min;(2)将茎段和叶片均分为18 等份,取出其中6 份材料装入无菌冻存管-80℃冷冻保存,作为B 处理;(3)将余下12 份移入1%新洁尔灭溶液中,浸泡消毒1 min 后取出,用无菌水清洗3 次,每次2 min,再用0.1%氯化汞溶液消毒6 min 后取出,无菌水清洗6 次,每次2 min;(4)将完成消毒的茎段和叶片材料接种至DKW 培养基,(20 ± 3)℃条件下进行暗培养;(5)暗培养2 d 后,在超净工作台内取出6 份材料装入无菌冻存管-80℃冷冻保存,作为A 处理;(6)暗培养14 d 后,在超净工作台内取出6 份材料,装入无菌冻存管-80℃冷冻保存,作为C 处理。
1.3 样品建库测序
将冻存的样品送北京百迈客生物科技有限公司做进一步建库测序。具体流程如下:提取样品总DNA 后,根据保守区设计引物,在引物末端加上测序接头,进行PCR 扩增并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina Novaseq 6000 进行测序。测序得到的原始图像数据文件,经碱基识别(Base Calling)分析转化为原始测序序列(Sequenced Reads),结果以FASTQ 文件格式存储,其中包含测序序列(Reads)的序列信息以及其对应的测序质量信息。
1.4 信息分析流程
1.4.1 数据预处理 首先使用Trimmomatic v0.33软件对测序得到的Raw Reads 进行过滤;然后使用cutadapt 1.9.1 软件进行引物序列的识别与去除,得到不包含引物序列的Clean Reads;使用Usearch v10 软件,通过overlap 对每个样品的Clean Reads 进行拼接,然后根据不同区域的长度范围对拼接后数据进行长度过滤;使用UCHIME v4.2 软件鉴定并去除嵌合体序列,得到最终有效数据(Effective Reads)。
1.4.2 OTUs(Operational Taxonomic Units)分析使用Usearch 软件对Reads 在97.0%的相似度水平下进行聚类,获得OTUs。
1.4.3 物种注释及分类学分析 以UNITE 为参考数据库使用朴素贝叶斯分类器对特征序列进行分类学注释,得到每个特征对应的物种分类信息,进而在各水平(门、纲、目、科、属、种)统计各样品群落组成,利用QIIME 软件生成不同分类水平上的物种丰度表,再利用R 语言工具绘制样品各分类学水平下的群落结构图。
1.4.4 Alpha 多样性指数分析 使用QIIME 2 软件,对样品Alpha 多样性指数进行评估。
1.4.5 真菌生态功能预测分析 软件FUNGuild(Fungi Functional Guild)是可用于解析真菌OTUs的工具,基于该软件对样品进行生态功能分析。
1.4.6 真菌关联网络分析 进行斯皮尔曼(Spearman)秩相关分析并筛选相关性大于0.1 且P值小于0.05的数据构建相关性网络,并基于Python 绘制真菌相关性网络图。
2 结果与分析
2.1 内生真菌ITS 序列数量与OTUs 数量分布
18 个喙核桃样品中,每个样品至少产生477 021条质控序列,平均产生478 005 条质控序列。对所有样本的有效序列以97%的一致性进行OTUs 聚类,然后对OTUs 序列进行物种注释,共得到832 个序列,分属于7 门、33 纲、78 目、163科、278 属。物种丰度稀释曲线上升到一定高度后趋于平稳(图1),表明测序的深度已足够代表样品中大多数真菌种类,Alpha 多样性分析结果能够代表物种的丰富度。
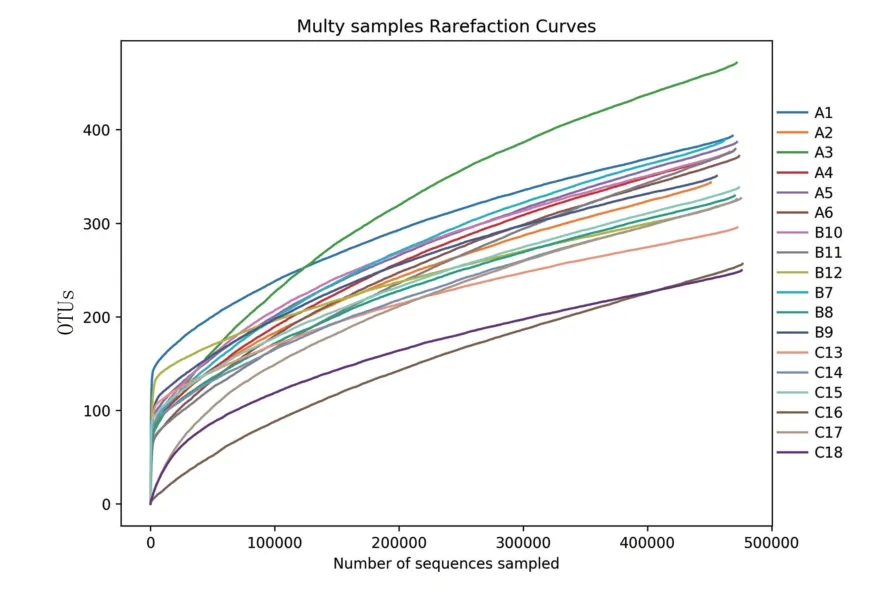
图1 样品稀释曲线
Venn 图用于统计多个样本中所共有和独有的OTUs 数目,可直观地表现样本的OTUs 数目组成相关性及重叠情况。由图2 可知,从喙核桃茎段和叶片中检测到的真菌共有OTUs 为686 个,特有OTUs 分别为114 个和32 个,分别占真菌总OTUs 的13.70%、3.85%。

图2 真菌OTUs 分布Venn 图
2.2 喙核桃茎段和叶片内生真菌群落多样性和丰富度分析
ACE 或Chao 1 指数越大,表明群落的丰富度越高,从表2 可以看出,喙核桃内生真菌具有较高的丰富度。真菌ACE 指数均表现为茎段大于叶片。C 处理Chao 1 指数表现为叶片大于茎段,Chao 1 是度量物种丰富度的指标,其与丰度、均匀度无关,但是对稀有物种很敏感,推测叶片材料中某些稀有菌种在长时间组培条件下大量繁殖导致C 处理的Chao 1 指数升高。Shannon 指数和Simpson 指数是用来估算菌群多样性的,Shannon指数越大,Simpson 指数越小,菌群多样性越高,Shannon 指数对群落的丰富度以及稀有OTUs 更敏感,而Simpson 指数对均匀度和群落中的优势OTUs 更敏感[14]。Shannon 指数在A 处理中表现为叶片小于茎段,B 处理中表现为叶片略大于茎段,C 处理中表现为叶片指数远远大于茎段,即自然状态下,叶片的真菌多样性略高于茎段,经过2 d 的组织培养后,茎段真菌多样性高于叶片,但经过14 d 组织培养后,茎段真菌的多样性远远低于叶片。Simpson 指数在A、B 处理中则表现为茎段大于叶片,即自然状态和经过2 d 的组织培养条件下,内生真菌的均匀度均表现为叶片大于茎段,而经过14 d 组织培养后,茎段Simpson、Shannon指数降低,叶片的Simpson 指数略微增大,推测是由于茎段和叶片在长时间培养过程中某些稀有真菌急剧增长成为优势菌属所致。
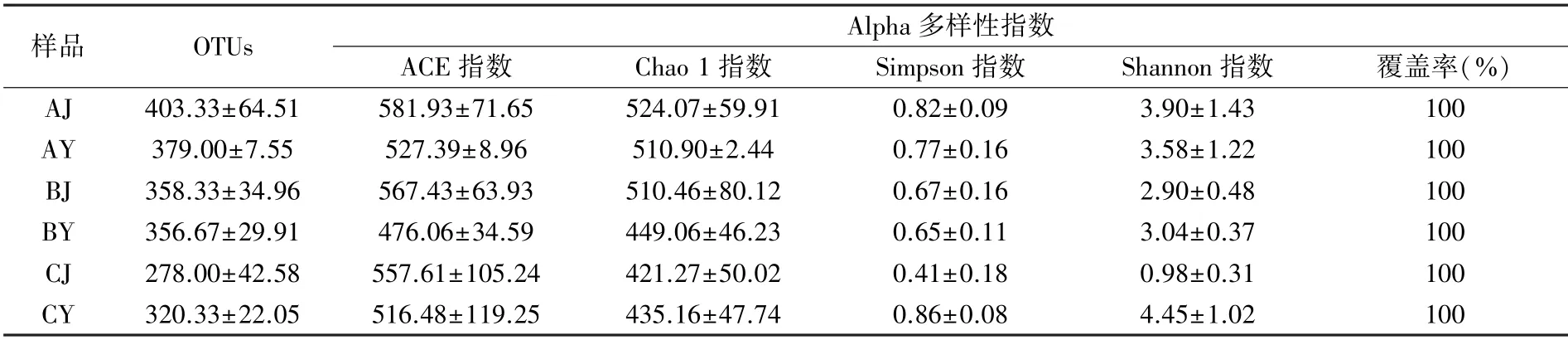
表2 Alpha 多样性指数分析
2.3 喙核桃茎段和叶片内生真菌群落结构
2.3.1 门水平群落结构 由图3 可以看出,喙核桃叶片和茎段中内生真菌门类主要包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)、罗兹菌门(Rozellomycota)、油壶菌门(Olpidiomycota)及未鉴别的菌门(Unclassified)。其中,子囊菌门(Ascomycota)的相对丰度在叶片和茎段中分别为65.43%和74.08%,为优势菌门;其次是担子菌门(Basidiomycota),相对丰度分别为22.54%和12.40%;未得到分类学注释的菌门相对丰度分别为8.86%和11.60%。
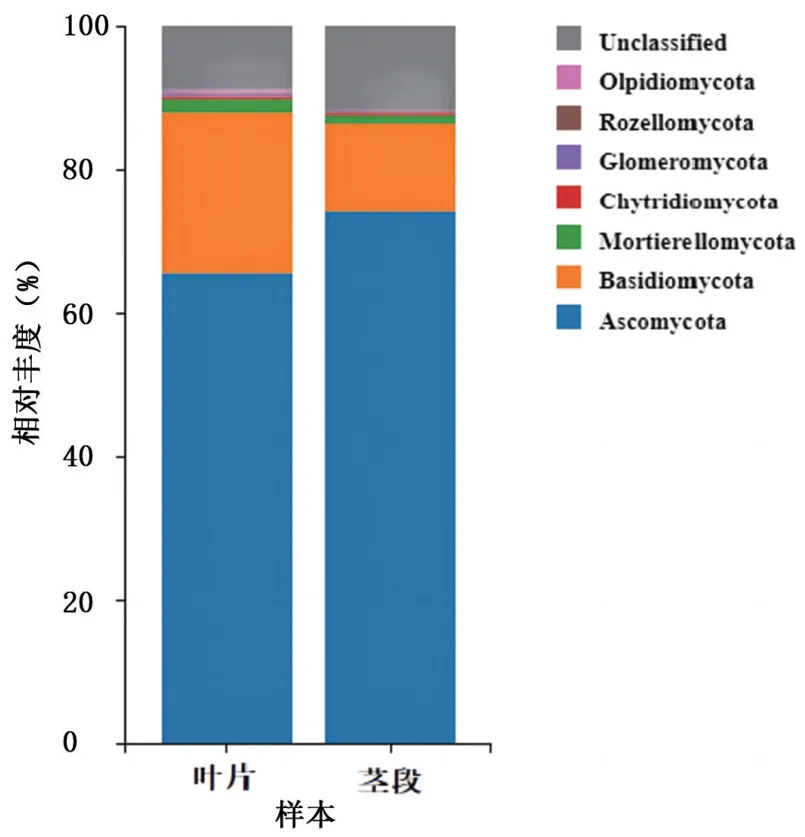
图3 内生真菌门水平群落结构
2.3.2 属水平群落结构 从图4 可以看出,无论是茎段还是叶片,其属水平丰度前15 的菌属均为枝顶孢属(Acremonium)、维希尼克酵母属(Vishniacozyma)、枝孢属(Cladosporium)、被孢霉属(Mortierella)、曲霉属(Aspergillus)、镰刀菌属(Fusarium)、色二孢属(Diplodia)、亚隔孢壳属(Didymella)、链格孢属(Alternaria)、酵母属(Saccharomyces)、掷孢酵母属(Sporidiobolus)、戈卢别夫氏酵母属(Golubevia)、马拉色菌属(Malassezia)、茎点霉属(Setophoma)、刺盘孢属(Colletotrichum),同时还有大量未被分类学注释的菌属。
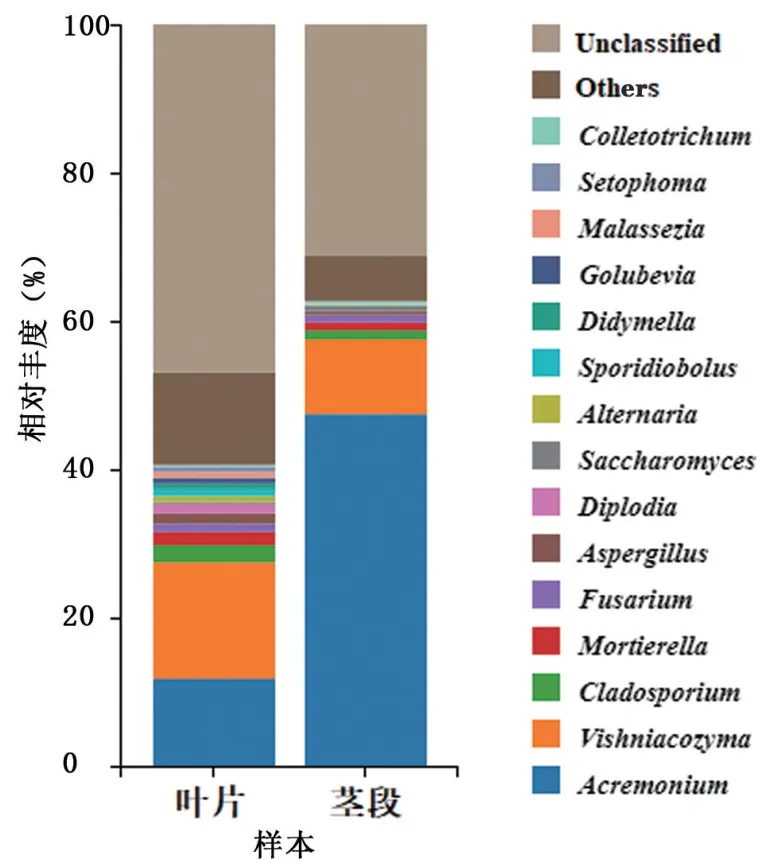
图4 茎段和叶片内生真菌属水平群落结构
从图5 可以看出,不同处理时期,各菌属丰度占比具有明显变化,自然状态下(B 处理),枝顶孢属为喙核桃茎段中的优势菌属,其丰度占比高达51.80%,而在叶片中的丰度仅为1.74%;维希尼克酵母属为喙核桃叶片中的优势菌属,丰度占比为14.12%,但其在茎段中的占比仅为9.99%。经过2 d 的组织培养后(A 处理),茎段中丰度前15 的菌属占比总体呈下降趋势,仅占34.75%,与自然状态下相比,下降34.45 个百分点;叶片中的维希尼克酵母属丰度大幅增长,占比达24.77%,与自然状态下相比,增长10.65 个百分点,丰度前15 的菌属占比较自然状态下增长16.44 个百分点。经过14 d 的组织培养后(C 处理),枝顶孢属和维希尼克酵母属依旧为茎段和叶片中的优势菌属,较自然状态,茎段中分别增长13.68 个百分点和9.21 个百分点,叶片中枝顶孢属增长23.86 个百分点,维希尼克酵母属则下降5.86 个百分点;一些菌属则相对丰度大幅下降甚至消失,如茎段中亚隔孢壳属。表明短期组织培养能降低部分菌属的相对丰度,同时导致部分优势菌属急剧增长,经过长期组织培养后,部分优势菌属急剧生长占据主要生态位和微生态环境,导致其他菌属相对丰度降低,甚至消失。此外,喙核桃内生真菌在属水平上仍有较多的菌属未能被鉴定。
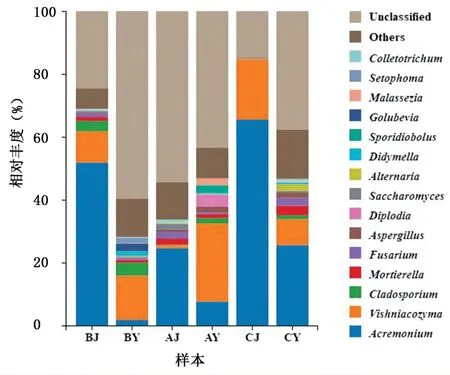
图5 不同处理下茎段和叶片内生真菌属水平群落结构
2.4 喙核桃茎段和叶片真菌的生态功能预测
对3 个处理的喙核桃茎段和叶片样本进行FUNGuild 真菌功能预测,结果表明,喙核桃茎段中3 种基本营养型丰度占比分别为共生营养型占15.28%、腐生营养型占49.90%、病理营养型占34.82%,叶片的3 种基本营养型占比为共生营养型占11.25%、腐生营养型占48.93%、病理营养型占39.82%。由图6 可知,根据Guilds 小类,又分为植物病原菌(Plant Pathogen)、动物病原菌(Animal Pathogen)、真菌寄生菌(Fungal Parasite)、植物内生菌(Endophyte)、植物腐生菌(Plant Saprotroph)、木腐生真菌(Wood Saprotroph)、粪腐生真菌(Dung Saprotroph)、外生菌根真菌(Ectomycorrhizal)、丛枝菌根真菌(Arbuscular Mycorrhizal)、土壤腐生菌(Soil Saprotroph)、动物寄生虫(Animal Parasite)、动物共生真菌(Animal Endosymbiont)、附生真菌(Epiphyte)、杜鹃花类菌根真菌(Ericoid Mycorrhizal)及未定义腐生菌。其中,植物病原菌在自然状态(B 处理)的叶片样本中占比最高,为36.40%,在茎段样本中占比25.26%;组织培养2 d 后(A 处理),其占比最多下降21.37个百分点;经过14 d 组织培养后(C 处理),与B处理比较,至多增长7.30 个百分点,但其丰度始终低于自然状态下。其次,未定义的腐生菌、粪腐生菌、动物病原菌在自然状态下的相对丰度低于经过组培处理后的;植物内生菌、土壤腐生菌的相对丰度经过组培处理后明显升高,动物共生真菌相对丰度经过组培处理后明显降低。
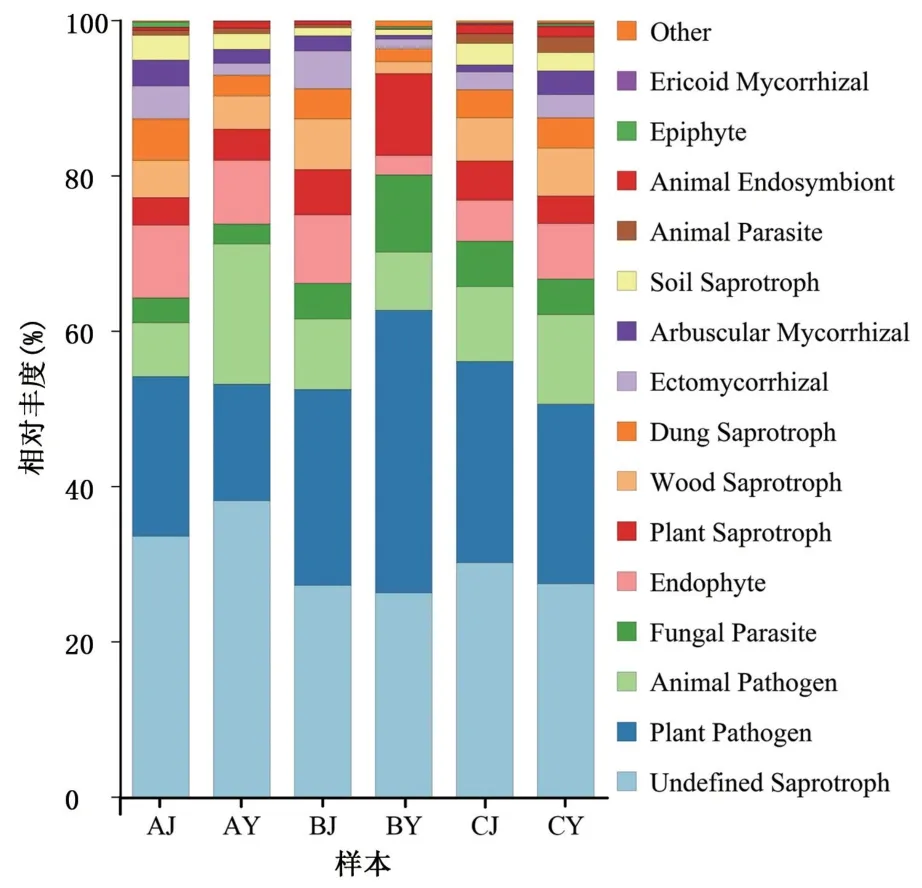
图6 真菌生态功能预测
2.5 真菌网络关系
以相关性最高的前50 个属绘制真菌网络关联图,从图7可以看出枝顶孢属的平均丰度远大于其他属,每个属在平均丰度上均存在一个甚至多个与其存在关联的属。除外囊菌属(Taphrina)与Archaeorhizomyces、尾孢菌属(Cercospora)与蜡壳菌属(Sebacina)、枝顶孢属(Acremonium)与黑团孢属(Periconia)、裂壳属(Schizothecium)与枝鼻菌属(Cladorrhinum)等少数几个属间呈负相关关系外,其余大多数属间呈正相关关系,如煤炱属(Capnodium) 与Scolecoxyphium、拟魏克酵母属(Wickerhamiella) 与毛孢子菌属(Cutaneotrichosporon) 等。该关联网络具有较高的模块度(0.417)和平均聚类系数(0.318)。
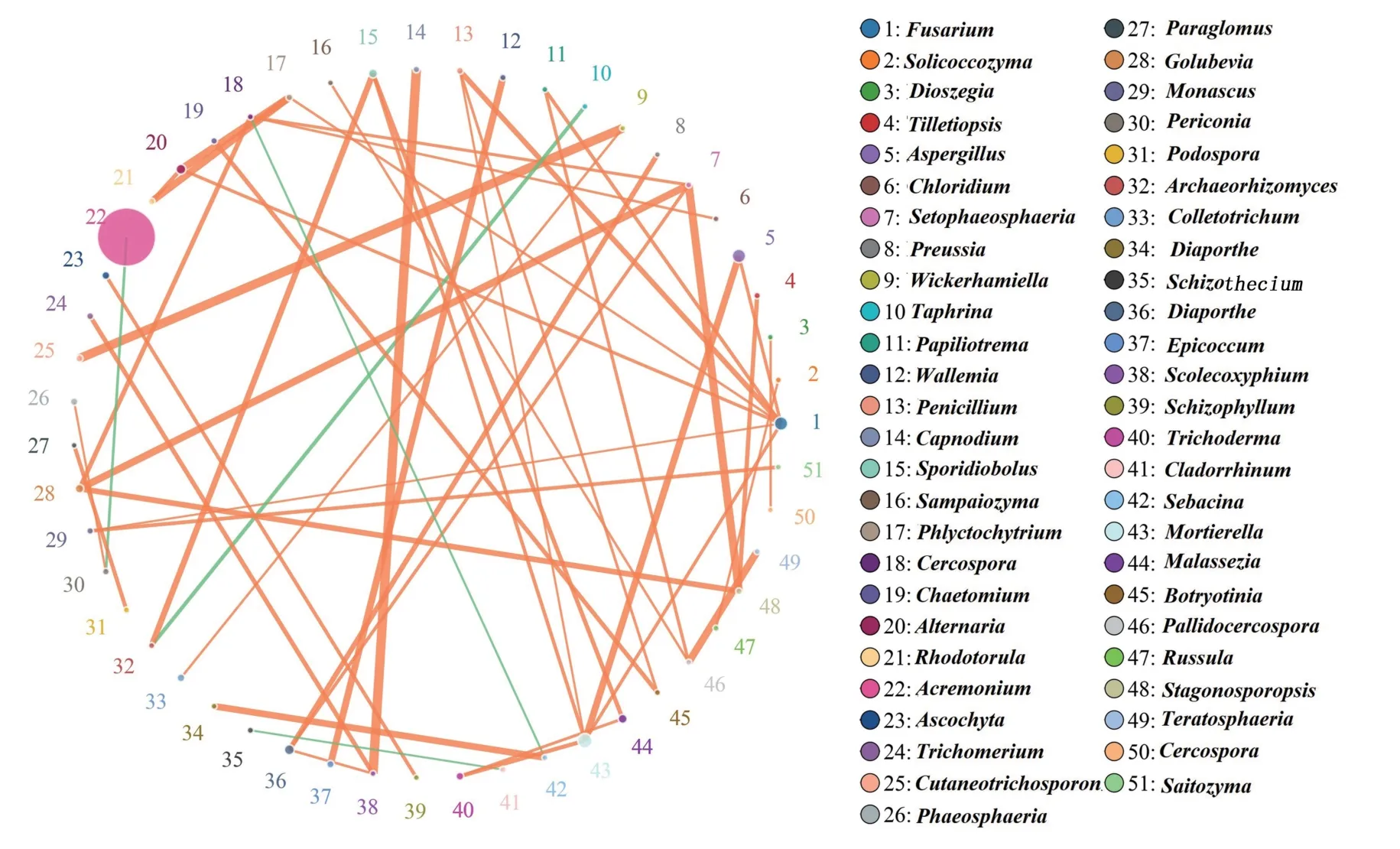
图7 真菌网络关系(属水平)
3 讨论与结论
本研究首次采用高通量测序方法对喙核桃茎段和叶片内生真菌的多样性与群落结构展开分析,以97%的一致性进行OTUs 聚类,共得到内生真菌OTUs 832 个,分属于7 门、33 纲、78 目、163科、278 属。分析结果显示喙核桃内生菌具有高丰富度和多样性,自然状态下喙核桃茎段真菌丰富度高于叶片,但多样性低于叶片,经过长期组织培养后,茎段中的优势真菌属急剧增长,导致茎段整体真菌群落多样性大幅度下降,而叶片中真菌群落多样性在组织培养后增高,表明喙核桃内生真菌分布具有随环境改变而变化、不同组织分布不同的特点,与惠建超[15]、臧威[16]等研究得到的内生真菌群落在不同环境以及根、茎、叶中分布具有明显差异的结论一致。
从门水平群落结构看,喙核桃叶片和茎段中内生真菌主要包括子囊菌门、担子菌门、被孢霉门、球囊菌门、罗兹菌门、油壶菌门等,其中子囊菌门为优势菌门,担子菌门为亚优势菌门。据McInroy 等[17]研究发现,大多数植物内生真菌以子囊菌门和担子菌门为主,这与本研究结果一致。Beinforde 等[18]研究表明子囊菌门大多数为腐生菌,可以分解难降解性有机质,在养分循环中起着重要作用,作为喙核桃内生优势真菌的子囊菌门真菌在其养分循环中同样起重要作用。从属水平群落结构看,丰度前15 的菌属包括枝顶孢属、维希尼克酵母属、枝孢属、被孢霉属、曲霉属、镰刀菌属、茎点霉属等,其中枝顶孢属、维希尼克酵母属为优势菌属。张向月[19]、周丽思[20]等研究表明,枝顶孢属、枝孢属具有促生、抗逆、抗病害和产活性代谢产物等功能。枝顶孢属、维希尼克酵母属为喙核桃的优势菌属,可能也具有相应功能。Broeckling 等[21]研究认为被孢霉属相较其他真菌更易在贫瘠生境中生长,从而导致其相对丰度较其他类群真菌高,推测是其在喙核桃植株内有高丰度的原因。de Oliveira Rocha 等[22]研究表明镰刀菌可造成植物根、茎、叶的腐烂萎蔫,引起苗枯、穗腐、植物种子和块茎的腐烂等;于莉等[23]研究表明茎点霉属真菌是一种重要的病原菌,有强烈的纤维素酶活性,会引起植物的茎腐、枝枯症状,这些菌属是导致组培试验中材料污染、死亡及腐烂的主导因素。
喙核桃茎段和叶片中的真菌以腐生营养型为主,平均相对丰度分别为49.41%,其次为病理营养型(37.32%),而共生营养型的平均相对丰度较低,仅为13.26%。在Guilds 小类中,发现植物病原菌在自然状态的叶片样本中占比最高,在已知的植物病害中,70%~80%是由植物病原真菌引起的[24],推测其是喙核桃幼苗在野外条件下存活率低的原因之一,同时也是导致组培试验失败的致病真菌。石晶盈等[25]研究发现感染内生菌的植株往往比未感染内生菌的植株更具生存竞争力,并表现出生长快速、抗病害、抗动物危害等生存优势;Huang 等[26]研究发现具有菌根真菌定植的植物可能因其真菌共生体提高10%~20%的光合作用效率;曲跃军等[27]研究发现丛枝菌根真菌可以作为因伤害引起的植物病原体的生物防治真菌,还可以利用其代谢物质提高农作物的效率。外生菌根真菌菌丝体既可以增加植物根系吸收面积来增强植物获取水分和营养的能力,还可以提高作物对干旱、重金属、病虫害的抵抗力[28],推测这些真菌在喙核桃植株内具有一定的促生长发育和增强抗逆、抗病能力。此外,动物病原菌、真菌寄生菌、动物寄生虫、动物共生真菌等也被检测出来,其与各种腐生菌和寄生菌组成了多功能的营养型。
喙核桃内生真菌具有较高丰富度和多样性,且有较多的菌属及菌种未能被鉴定,说明喙核桃植物的内生真菌还有很广的研究面,值得继续深入研究。子囊菌门为其优势菌门,丰度占比最高达74.08%,枝顶孢属、维希尼克酵母属为其优势菌属和亚优势菌属,经组织培养处理后,能降低部分真菌的相对丰度,但不能使其灭亡,同时还会导致优势菌属相对丰度的急剧增长。真菌以腐生营养型为主,平均相对丰度达49.41%,真菌生态功能群包括植物病原菌、动物病原菌、真菌寄生菌、植物内生菌、植物腐生菌、木腐生菌、粪腐生真菌、外生菌根真菌、丛枝菌根真菌、土壤腐生菌、动物寄生虫、动物共生真菌、附生植真菌、杜鹃花类菌根及未定义腐生菌。真菌网络关系显示每个属在平均丰度上均存在一个甚至多个与其存在关联的属,除少数几个属间呈负相关关系,其余大多数属间呈正相关关系。
致谢:本研究依托西南林业大学云南生物多样性研究院完成。

