小反刍兽疫基因工程疫苗的研究进展
郗珊珊,贾伟娟,秦瑶,楚秋娟,李文博,何云江,孟庆磊,陈云娇,王学理
(1. 内蒙古民族大学动物科技学院,内蒙古 通辽 028000;2. 内蒙古良欣农牧业开发有限公司,内蒙古 赤峰 024000;3. 巴林左旗科技创新和成果转化中心,内蒙古 赤峰 024000 )
小反刍兽疫(Peste des petits ruminants,PPR)又称“羊瘟”,是由小反刍兽疫病毒(Peste des petits ruminants virus, PPRV)引起的一种危害严重的山羊、绵羊和野生小反刍兽高度接触性传染病。PPRV 属于副黏病毒科(Paramyxoviridae)麻疹病毒属(Morbillivirus),同属的成员还包括牛瘟病毒(Rinderpest virus, RPV)、犬瘟热病毒(Canine distemper vieus, CDV)、海豹瘟病毒(Porpoise distemper virus, PDV)及麻疹病毒(Measles virus,MV)等。PPRV 基因组全长15 948 nt,病毒粒子大多数呈圆形或椭圆形,直径为130 ~ 390 nm,有囊膜包裹,主要包含N、P、M、F、H、L 六种结构蛋白和C、V 两种非结构蛋白[1-3],其结构、复制周期及各蛋白功能分别如图1、图2、表1 所示。

表1 小反刍兽疫病毒编码蛋白
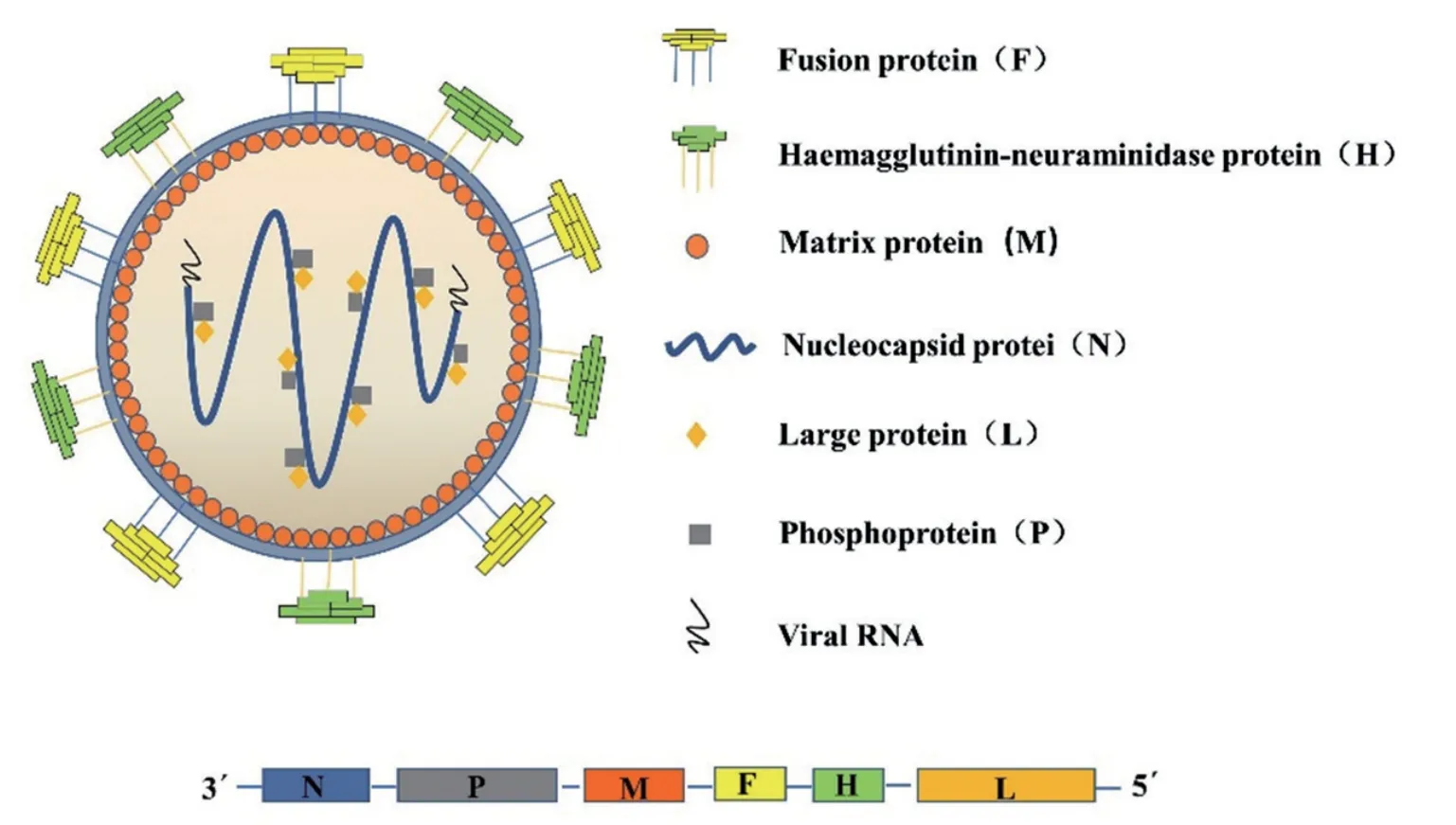
图1 PPRV 结构示意图[15]
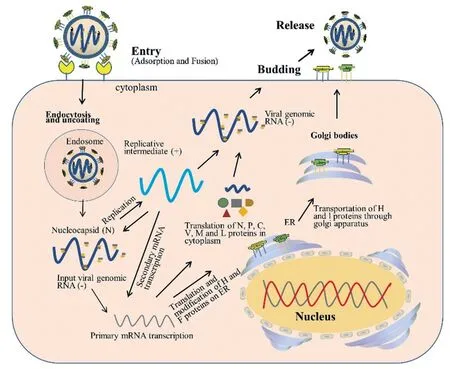
图2 PPRV 复制周期[16]
根据流行病学调查发现,PPRV 只有一个血清型,可分为4 个系,Ⅰ系主要分布在西非,Ⅱ系在尼日利亚、喀麦隆北部等地大量分布,Ⅲ系主要分布在非洲东部,Ⅳ系主要在中东和西亚地区流行。1942年PPR 首次发现于西非的科特迪瓦,之后扩散到阿拉伯半岛、中东、南亚等地,2007年传入我国西藏阿里地区,2013年后新疆、甘肃、内蒙古等地陆续有该病的报道[4,5]。2015—2019年间,66 国向世界动物卫生组织(World Organization for Animal Health,OIE)报告了12 757 起疫情,亚洲和中东9 582 起,占75.1%;非洲3 166 起,占24.8%;欧洲(保加利亚)9 起,占0.1%。其中贝宁(480 起)、阿富汗(824 起)、伊朗(3 710 起)、科威特(761 起)和土耳其(402 起)这五个国家的PPR 疫情占比48.4%,迫切需要加强对PPR 的预防和控制[6]。PPRV 的潜伏期为2~7 d,以高热、口腔黏膜糜烂、眼部分泌物增加、白细胞数量减少、腹泻和呼吸困难为特征。通常在出现发热症状后的4 ~ 6 d 内迅速死亡,有着高发病率(可达100%)和高死亡率(可达90%)。该发病特点给PPRV 的临床预防、诊断和治疗带来了严峻的挑战,OIE 和粮食及农业组织(Food and Agriculture Organization,FAO)计划将在2030年前彻底消除PPR[7,8]。
目前该病主要靠疫苗免疫进行预防,科研人员已研发出Nigeria 75/1、Sungri/96、Arasur/87 和Coimbatore/97 四种PPR 同源弱毒苗[9],其中以Nigeria 75/1 和Sungri/96 应用最为广泛,可对四种谱系的PPRV 产生良好的保护性免疫[10-13]。但是这种疫苗还不能达到区分疫苗毒株和野毒株感染(differentiation of infected versus vaccinated animals, DIVA)以及安全高效的效果,因此新型疫苗的研发显得尤为重要[14]。随着生命科学研究的不断发展,基因工程苗研究也随之成熟,并且有着与弱毒疫苗相似的效果,有望进行大规模应用。
1 重组亚单位疫苗
F 蛋白和H 蛋白是PPRV 囊膜表面的两种糖蛋白,均可诱发保护性免疫应答,其中H 蛋白相较F 蛋白能产生更高水平的中和抗体,是宿主免疫应答的主要靶点,因此H 蛋白是目前PPR 亚单位疫苗和重组活载体疫苗的主要免疫性抗原[24]。在研究中可将表达H 和F 蛋白的杆状病毒用作亚单位疫苗的抗原,它们能引起强烈的中和抗体反应,却不能对强毒株提供免疫保护,但将杆状病毒表达的H 蛋白嵌入免疫刺激复合物(ISCOMs)中,就可对强毒攻击起到较好的保护作用[25]。其中ISCOM 能诱导细胞介导的免疫反应,因此该反应可能是诱导针对PPRV 的保护性免疫反应的主要因素。
目前已有多种原核和真核表达系统用于制备病毒样颗粒(virus-like particle, VLP),VLP 仅由PPRV 衣壳蛋白组成,缺乏感染性基因组,其结构模拟亲本病毒粒子的构象和组织,却不能在细胞内进行自我复制[26]。杆状病毒是昆虫的主要病原体,研究者构建了重组杆状病毒来共表达PPRV-H、N 和M 蛋白,可使昆虫细胞膜上的VLP出芽增殖,同时发现这些VLP 还可在小鼠体内诱导大量的病毒特异性中和抗体,这表明基于VLP制成的疫苗具有抗PPRV 的潜力[27,28]。有研究发现,仅M 蛋白的表达就足以组装和释放PPRV的VLP,单独通过F 蛋白的表达也可支持低水平的VLP 装配,但在不存在M 的情况下未观察到VLP 的释放,进一步突显了M 蛋白作为结构蛋白在VLP 装配和释放中的关键作用[23]。
利用杆状病毒在昆虫细胞中表达VLP 已被证明是疫苗研发的有效策略,Engerix-B,Porcilis和Cervarix 等基于VLP 的疫苗已经获得商业化许可。基于VLP 制成的疫苗,通常是利用病毒疫苗株序列构建的,然而,由于某些结构蛋白翻译后糖基化修饰的改变和遗传物质的缺乏,衍生自疫苗株的VLP 的免疫原性并不总是最佳,需要通过测定进行判断。Yan 等[29]利用杆状病毒对PPRVM、H 和F 蛋白表达后,产生了两种PPRV VLP 候选毒株,分别来自Ⅳ系Tibet/30 毒株和Ⅱ系Nigeria 75/1 疫苗株;使用这些VLP 来免疫小鼠、山羊和绵羊,二次免疫后发现两种PPRV 的VLP 都能够在小鼠、山羊和绵羊体内引发体液免疫和细胞免疫反应,与Nigeria 75/1 VLP 相比,Tibet/30毒株的VLP 表现出更大的免疫原性。以上研究表明两种PPRV VLP 都是控制和根除PPR 的合适候选疫苗株,而Tibet/30 VLP 由于具有更大的免疫原性而成为最有前途的候选疫苗株。
2 活载体疫苗
2.1 痘病毒载体
痘病毒因其基因组容量大、含有大量的非必需基因、可载入大片段的外源基因而被广泛应用于构建基因载体病毒疫苗。孙一瑞等[30]利用egfp报告基因和gpt筛选基因筛选纯化了包含PPRV H 基因的重组绵羊痘病毒(Sheeppox virus,SPV),将其经皮内注射105.5TCID50免疫绵羊,结果显示该疫苗能够诱导绵羊产生高滴度的抗PPRV 特异性中和抗体,抗体阳转率达100%,并且外源H 基因的插入并未影响亲本病毒的复制,为研究PPR 新型痘病毒重组疫苗的研制提供了理论依据。Chen 等[31]研究制备了表达PPRV H和F 蛋白的重组羊痘病毒(Capripoxvirus,CPV)rCPV-PPRV-H 和rCPV-PPRV-F,发现相比于rCPV-PPRV-F,rCPV-PPRV-H 能诱导更强的PPRV 中和抗体,首次免疫rCPV-PPRV-H 后,羊群的血清转化率大于80%,6 个月后进行二次接种,免疫效果更强,可保护山羊免受强毒株攻击。Chandran 等[32]利用安卡拉病毒(MVA)构建了两种重组痘病毒MVA-F 和MVA-H,用105空斑形成单位(pfu)的MVA-F 和MVA-H 通过肌肉注射免疫山羊,结果显示,该疫苗安全性较好,未出现不良反应,即使是免疫4 个月后的山羊依然具有抵抗PPRV 攻击的能力。痘病毒载体疫苗尽管被发现具有相对的热稳定性,但并没有激活最佳的抗体反应,此外,使用痘病毒载体重组疫苗时疫苗接种员的安全性也不容忽略。
2.2 腺病毒载体
腺病毒载体疫苗能诱导T 细胞产生强烈的免疫反应,这种T 细胞反应通常是模拟了病原体诱导的保护性反应,最常用的为人5 型腺病毒(Ad 5)[33]。Ad 5 被认为是一种较好的用于小型反刍动物的重组载体,由于动物对该种载体缺乏先天免疫力,因此可达到更好的免疫效果。
研究发现将PPRV-H 和F 基因插入腺病毒载体构建的Ad-H 和Ad-F 疫苗,对山羊进行单独免疫和联合免疫,均可诱导高效抗体和细胞介导免疫应答,但Ad-H 和Ad-F 联合使用比Ad-H或Ad-F 单独使用诱导的保护效果更好[34,35]。Holzer 等[36]为了确定表达PPRV-H、F 蛋白的Ad制成疫苗的最低剂量,对东非PPR 常发国家肯尼亚的山羊展开了研究,发现仅需107pfu 的Ad-H或108pfu 的Ad-F 就可保护机体不受野生型PPRV 的攻击,同时还发现由108pfu(Ad-H+Ad-F)组成的疫苗可能对山羊提供无菌保护,并且联合使用Ad-H 和Ad-F 比单独使用Ad-H 具有更强的保护作用。Rojas 等[37]检测到,在接种重组Ad 5 疫苗和感染PPRV 后触发的CD4+和CD8+T细胞反应十分相似,在PPRV 强毒株攻击下可激活Ad 5-F 和Ad 5-H 疫苗诱导的CD4+、CD8+T 记忆细胞分化。这些研究表明使用表达PPRV 基因的重组腺病毒疫苗可在机体受到PPRV 攻击后,诱导T 细胞大量增殖起到保护作用。
有研究者对表达PPRV-F 和H 蛋白的重组鸡痘病毒与Ad 5 载体疫苗进行了免疫效果比较,发现Ad 5 载体疫苗诱导了更高水平的病毒特异性抗体和中和抗体,并激发了更多数量的CD8+T细胞,同时还发现,无论是否添加集落刺激因子或绵羊白细胞介素-2(IL-2),Ad-H 均能在免疫4个月后诱导山羊产生较强的抗体和细胞免疫,并能完全保护山羊免受PPRV 强毒株的攻击[38,39]。重组腺病毒载体疫苗具有高度免疫原性,可诱导先天性和适应性免疫,是能够区别自然感染动物与疫苗接种感染动物的疫苗。
3 核酸疫苗
PPR 核酸疫苗是将编码PPRV 抗原的基因制成疫苗,再接种到动物体内使之可在机体内进行表达,并诱导机体产生抗体,从而起到免疫的效果。核酸苗接种后与自然免疫相似,不存在毒力返强和散毒的风险,是由于在激发机体细胞免疫的同时还激发了体液免疫。Wang 等2013年构建了一种基于西门利克森林病毒(SFV)复制子的自杀DNA 疫苗,并测试了其在小鼠体内诱导免疫原性的能力,首先将克隆的PPRV H 基因插入SFV复制子载体pSCA1 中,再将pSCA1-H 质粒转染到BHK-21 细胞中,最后通过Western blot 来检测表达蛋白的抗原性。将pSCA1-H 质粒通过肌肉注射入BALB/c 小鼠体内,共注射3 次,每次间隔两周,检测结果表明pSCA1-H 可在BHK-21 细胞中表达H 蛋白,并且可在小鼠体内诱导特异性抗体、中和抗体和淋巴细胞增殖反应[40];2015年又利用同样的方法对表达PPRV-F 基因构建的pSCA1-F 质粒的抗原性进行了测试,结果表明pSCA1-F 也可在小鼠体内诱导同样的反应,并且pSCA1-F 在初次免疫小鼠24 h 后,白细胞介素(IL-2、IL-10)含量不断升高,干扰素(IFN-γ)和肿瘤坏死因子(TNF-α)也从此时开始上升,之后逐渐下降,这种自杀性DNA 疫苗为PPR 新型疫苗的研发提供了新思路[41]。由此可见核酸苗具有同时引起细胞免疫和体液免疫的特性,还具有抗体产生制备周期短、效价高、储存条件简单等优点。
4 反向遗传学技术重组苗
反向遗传学技术可从遗传上改变病毒RNA组成,用于添加标记基因(阳性标记疫苗)或删除抗原成分(阴性标记疫苗),利用这种方法操控PPRV 基因组来引入特异性突变位点,从而为疫苗的研发提供了一种新的思路[42]。有研究者为了从血清学上区分野毒株和疫苗毒株,利用反向遗传技术建立了带有绿色荧光蛋白(GFP)标记的PPRV 重组疫苗,同时还构建了表达PPRV-H 和F 基因的山羊痘病毒(Goatpox virus,GPV)活载体苗,这种情况下只需要对PPRV-H 或F 基因进行检测就可有效区分疫苗株和野毒株,如果在注射过疫苗的动物体中检测到H 或F 蛋白的抗体,那么证明其感染毒株为野毒株,反之则证明为免疫毒株感染,注射此种疫苗可同时预防PPRV 和SPV 的感染[43]。Muniraju 等[44]通过反向遗传学技术,利用PPRV Nigeria 75/1 疫苗株研发了一种rPPRV-C77 重组苗,注射山羊后没有表现出任何不良反应,但是,该疫苗在PPRV 血凝素(H)包膜糖蛋白上缺乏C77 单克隆抗体的结合位点,对此需要进行更深入的研究。使用反向遗传学方法研发的疫苗的一个潜在问题是,标记蛋白可能会被整合到病毒的包膜中,因此可能会改变宿主的趋向性和致病性。
各疫苗优缺点具体见表2。

表2 几种疫苗的优缺点
5 展望
动物在接种疫苗后由于接种时间、接种部位、母源抗体及疫苗配制时间等原因会造成不同的免疫效果[45]。经研究发现,90 日龄以上的羊群免疫后抗体合格率和抗体水平最高,具有母源抗体的羔羊100 日龄为最佳免疫时间;颈部皮下注射优于肌肉注射,但两者均能获得一定水平的免疫效果。鲁立柱等[46]对初免21 d 后羊群进行了第二次免疫,同时监测不同时间血清中抗体浓度,结果显示,初免21 d 抗体滴度平均可达5.18±2.87;二次免疫后3、7、14、21 d 平均滴度分别为5.65±2.56、6.95±1.82、7.28±1.18、8.12±1.31,呈上升趋势,试验表明,对已经有PPR 抗体的羊进行二次免疫可增强免疫效果。严斯刚等[47]为测试PPRV 疫苗配置后不同时间接种的免疫效果,将疫苗配置后1、1~2、2~3、5~6 h 分别免疫本地山羊,并在接种后当天和30、120 d 分别测定抗体水平,结果显示前三组在30 d 和120 d 抗体阻断率均在85%以上,表明稀释后的疫苗在3 h 内用完均有良好的免疫效果。
由于内蒙古地区得天独厚的生态环境和我国畜牧业经济的发展,蒙东地区肉羊产业发展迅猛,个别养殖企业由于饲养管理体系、防疫体系不健全导致一些羊源病毒性疾病频繁发生,给个体养殖户及大型养殖场均造成了一定的经济损失。但到目前为止,还未研发出一种各方面都完美的疫苗,其中应用最广泛的传统弱毒苗和灭活苗无法将接种疫苗的动物与自然感染的动物区分开来,而基因工程苗有实现这一目标的可能。减毒活疫苗免疫效果好却不耐热,需要健全的冷链运输系统送到现场,故还需要研发一种热稳定性疫苗,但技术及基因工程苗在研发上还存在一些问题,需要更深入的探索。此外,还应研发气雾剂、滴眼液疫苗,为大规模免疫提供方便。防止病毒传播所需的群体免疫水平为80%,然而,阻止PPR 有效传播所需的确切群体免疫水平需要进一步研究。综上所述,新兴的PPR 基因工程疫苗和减毒活疫苗在实验室研究中取得了飞跃性进展,为临床应用奠定了基础,但研制安全高效的疫苗仍存在很多问题,如病毒的易变异性、保护性抗原的不确定性、活载体的不稳定性、免疫效果的评价指标不健全等,这将导致未来PPR 疫苗的发展仍然艰辛。

