超声波酶法辅助提取紫萁黄酮工艺及抗氧化活性研究
李克香,向建英,唐军荣,邱旭,阚欢,,刘云,
(1. 西南林业大学生命科学学院,云南 昆明 650224;
2. 西南林业大学西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224;3. 云南省高校大健康类森林资源开发利用工程研究中心,云南 昆明 650224)
紫萁(Osmunda japonica)为紫萁属多年生草本蕨类植物[1],别名薇菜、高脚贯众、猫儿蕨等,生于林下或溪边酸性土上,北起山东,南达两广,东自海边,西达云、贵、川西,北至秦岭南坡均有分布,素有绿色保健食品之称,可药食两用[2],以“山菜之王”和“山珍”闻名中外[3]。紫萁幼叶作为蔬菜食用在我国已有3 000 多年的历史,加工成紫萁干后,长期出口到日本、韩国及东南亚等国家[4]。紫萁含有黄酮类[5]、 内酯类[6]、 多糖类[7-9]、鞣质[10]及氨基酸类[11]等多种活性成分,其中黄酮类化合物是紫萁资源中的重要活性成分之一。
紫萁黄酮具有抗衰老、抗肿瘤、抑菌、提高机体免疫力等生理活性功能[12-14],提取方法主要有乙醇提取法[15]、丙酮提取法[16]、微波辅助提取法等[17]。植物中的黄酮类化合物通常以糖苷或其它共轭体的形式存在液泡中[18]。植物细胞壁主要由纤维素组成,紫萁中的纤维素含量高达37.4%[19]。纤维素酶能水解植物细胞中的纤维素β-D-葡萄糖苷键,破坏植物细胞壁,有助于黄酮成分的充分溶出。超声波产生的空化效应、机械效应及振荡作用,能够破坏植物组织,加速黄酮成分的溶出[20]。超声波酶辅助提取法具有安全、环保、效率高等优点[21],此法在提取紫萁黄酮中的研究至今未见报道。本研究以云南野生紫萁为原料,采用响应面分析优化超声波酶辅助提取紫萁黄酮的工艺[22],并对其进行抗氧化活性评价,以期为紫萁的综合利用提供科学依据。
1 材料与方法
1.1 材料与试剂
野生紫萁材料采自云南迪庆。将采集的新鲜紫萁于50℃恒温干燥后,粉碎过80 目筛,得到的紫萁粉于4℃冰箱内保存备用。
芦丁标准品(≥98%)、纤维素酶(50 U/mg)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS):上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):北京博奥拓达科技有限公司;维生素C(VC):广东光华科技股份有限公司。
1.2 仪器与设备
UV-2600 紫外可见分光光度计:岛津仪器(苏州)有限公司;SB25-12DTDS 超声波清洗机:宁波新艺超声设备有限公司;DK-98-Ⅱ电热恒温水浴锅:天津市泰斯特仪器有限公司;Spectra-Max190 酶标仪:美谷分子仪器(上海)有限公司;FD5-3 冷冻干燥机:金西盟(北京)仪器有限公司。
1.3 试验方法
1.3.1 紫萁黄酮的提取 准确称取适量紫萁粉末于离心管中,按一定液料比加入不同浓度的乙醇溶液,混匀后调节pH 为5,采用纤维素酶在50℃水浴中对样品进行酶解,酶解后将酶灭活,然后将灭活后混合溶液在50℃下进行超声提取,离心取上清液,即为紫萁黄酮提取液。
1.3.2 建立芦丁标准曲线 参考李欣燃等[23]的方法,稍加改动。准确称取10 mg 芦丁标准品,用50%乙醇定容至100 mL,配成浓度为0.1 mg/mL的芦丁标准液,之后吸取0、2、4、6、8、10、12 mL,分别置于25 mL 刻度试管中,依次加入5%亚硝酸钠1 mL、10%硝酸铝溶液1 mL 、5%氢氧化钠溶液10 mL,最后用50%乙醇定容、静置15 min,用50%的乙醇作为空白对照,于510 nm 处测定吸光值。以吸光值为纵坐标(A)、芦丁质量浓度为横坐标(C,mg/mL)绘制标准曲线,并拟合得到回归方程为A=11.2664C+0.0007(R2=0.9994)。
1.3.3 紫萁黄酮的得率测定 将1.3.1 中所得紫萁黄酮提取液定容至25 mL,取1 mL 按1.3.2 中建立标准曲线的方法测定,根据公式(1)计算紫萁黄酮得率:
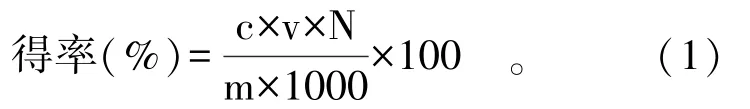
式中:c 为紫萁黄酮质量浓度,mg/mL;N 为稀释倍数;v 为待测提取液的总体积,mL;m 为紫萁粉样品质量,g。
1.3.4 紫萁黄酮提取单因素试验 在1.3.1 的基础上,分别考察超声时间(10、20、30、40、50 min)、纤维素酶添加量(0.2%、0.6%、1.0%、1.4%、1.8%)、液料比(10、20、30、40、50 mL/g)、乙醇浓度(30%、40%、50%、60%、70%)、纤维素酶解时间(10、25、40、55、70 min)、超声功率(100、200、300、400、500 W)对紫萁黄酮得率的影响。
1.3.5 紫萁黄酮提取响应面优化试验 用SPSS 26 软件分析单因素试验结果,选取4 个对紫萁黄酮得率影响显著的因素作为自变量,以紫萁黄酮得率(Y)为响应值,进行Box-Behnken 响应面设计,优化紫萁黄酮的提取工艺条件[24]。响应面试验因素与水平设计见表1。

表1 响应面试验因素与水平设计
1.3.6 紫萁黄酮抗氧化活性测定 DPPH 自由基清除能力测定:参照袁燕等[25]的方法并稍加改动。将紫萁黄酮粗提液冻干后,用蒸馏水复溶,配制浓度为0.1、0.2、0.3、0.4、0.5、0.6 mg/mL 的紫萁黄酮样品溶液,之后分别取3 mL 于10 mL 离心管中,加入3 mL 浓度为0.08 mg/mL 的DPPH-无水乙醇溶液混匀,避光30 min 后,取200 μL 混合液于96 孔酶标板中,在酶标仪517 nm 处测定吸光值。同时设定空白组和样品对照组,每组试验重复3 次。配制浓度为0.01、0.02、0.03、0.04、0.05、0.06 mg/mL 的VC 溶液作为对照。根据公式(2)计算清除率。
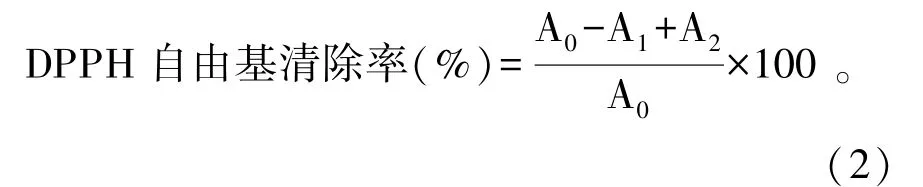
式中:A0为DPPH 自由基和无水乙醇的吸光值;A1为紫萁黄酮提取液和DPPH 自由基的吸光值;A2为紫萁黄酮提取液和无水乙醇的吸光值。
ABTS 自由基清除能力测定:参照李伟等[26]的方法并稍加改动。将7 mmol/mL ABTS 溶液5 mL 与140 mmol/mL 过硫酸钾水溶液88 μL 混合均匀并避光反应12 h,得到ABTS+·储备液;使用前用蒸馏水稀释ABTS+·储备液使其734 nm 处吸光值为0.70±0.02,即得ABTS+·工作液,现配现用。将紫萁黄酮粗提液冻干后,用蒸馏水复溶,配制浓度为0.04、0.08、0.12、0.16、0.20、0.24 mg/mL 的紫萁黄酮样品溶液。移取不同浓度紫萁黄酮样品溶液50 μL 于96 孔酶标板中,再加入ABTS+·工作液200 μL,暗反应6 min,于酶标仪734 nm 处测定吸光值。配制浓度为0.003、0.006、0.009、0.012、0.015、0.018 mg/mL 的VC 溶液作为对照。根据公式(3)计算清除率。
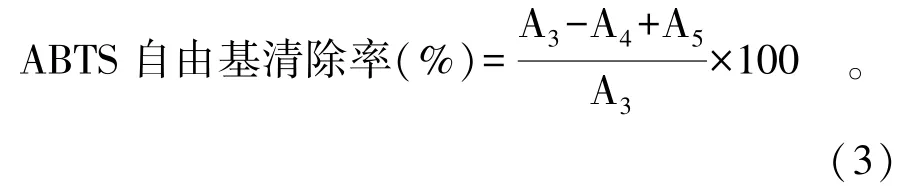
式中:A3为ABTS 自由基和蒸馏水的吸光值;A4为紫萁黄酮提取液和ABTS 自由基的吸光值;A5为紫萁黄酮提取液和蒸馏水的吸光值。
1.4 数据处理
所有试验均重复3 次,采用软件Design-Expert 12、Origin 2018、SPSS 26 对数据进行处理和分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 超声时间对紫萁黄酮得率的影响 由图1可知,紫萁黄酮得率随超声时间的延长呈先增后减的趋势,20 min 时得率最高,为3.113%;继续延长超声时间,得率显著减少,可能是超声产生的空化效应、搅拌作用破坏了黄酮的结构[27],影响紫萁黄酮得率。因此超声时间选择20 min 为宜。
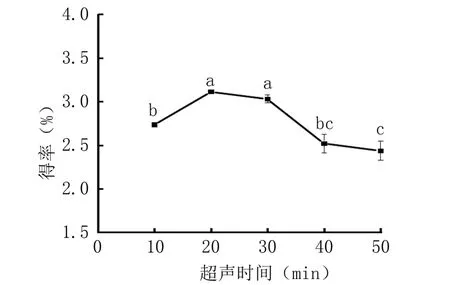
图1 超声时间对紫萁黄酮得率的影响
2.1.2 纤维素酶添加量对紫箕黄酮得率的影响
由图2 可知,随着纤维素酶添加量的增加,紫萁黄酮的得率先增加后减少,添加量为1.0%时得率最高,为3.468%;之后,紫萁黄酮得率随着酶添加量的增加反而显著性降低,可能是随着纤维素酶添加量的增加,酶和分解后的纤维素会阻止黄酮类化合物与提取溶剂的接触,导致紫萁黄酮得率降低[21]。因此选择0.6%、1.0%、1.4%的纤维素酶添加量进行响应面试验。

图2 纤维素酶添加量对紫萁黄酮得率的影响
2.1.3 液料比对紫箕黄酮得率的影响 由图3可知,在液料比10~40 mL/g 范围内,随着液料比的增加,紫萁黄酮得率呈显著上升趋势,液料比为40 mL/g 时得率最高(3.624%);继续增加液料比,紫萁黄酮得率显著下降。原因可能是随着液料比增大,液体体积增加,体系黏度降低,传质过程加快,紫萁黄酮得率相应得到提高;当液料比增加到一定程度,体系中可能会有一些可溶性物质随溶剂溶出,导致体系黏度上升,扩散系数随之降低,从而导致紫萁黄酮得率下降[28]。综上,选择30、40、50 mL/g 的液料比进行响应面试验。
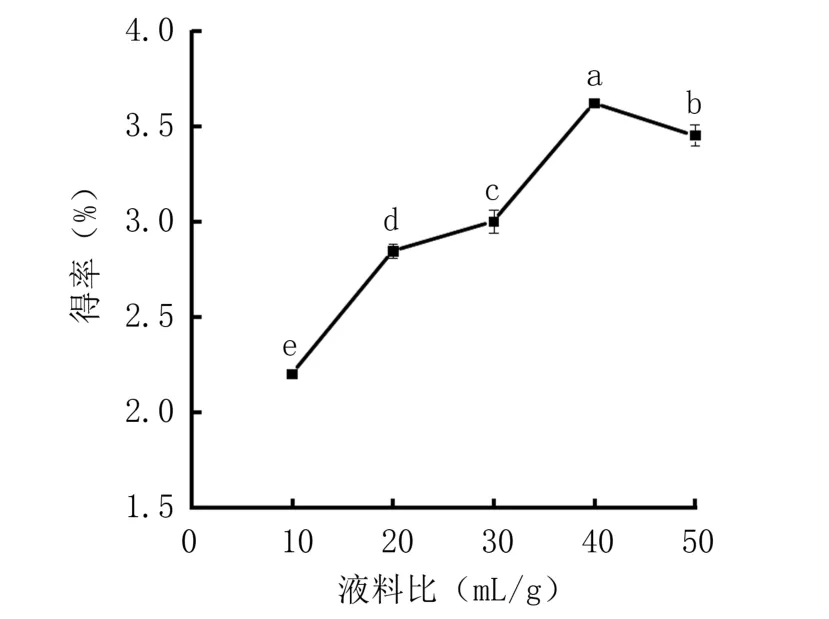
图3 液料比对紫萁黄酮得率的影响
2.1.4 乙醇浓度对紫箕黄酮得率的影响 由图4可知,乙醇浓度为40%时,紫萁黄酮得率达到最高峰3.513%;再继续升高乙醇浓度,紫萁黄酮得率呈显著下降趋势。乙醇对细胞穿透能力强,溶解性好,用不同浓度的乙醇处理紫萁粉时,会使细胞内外形成浓度差,有利于细胞内部紫萁黄酮的溶出;当乙醇浓度达到40%时,可能紫萁黄酮的溶出已经趋于饱和,而随着乙醇浓度的持续增加,一些能够溶解于乙醇的杂质、色素等溶出,导致紫萁黄酮得率出现下降趋势;同时较高浓度的乙醇可能也会抑制纤维素酶活性,导致黄酮溶出变少[29]。综上,选择30%、40%、50%的乙醇浓度进行响应面试验。
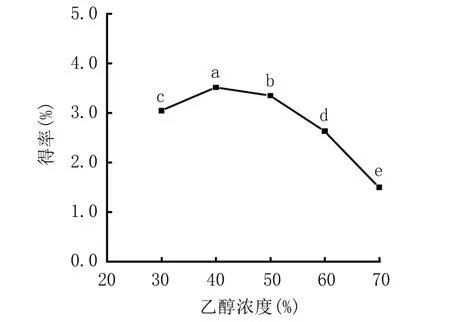
图4 乙醇浓度对紫萁黄酮得率的影响
2.1.5 酶解时间对紫箕黄酮得率的影响 由图5可知,随着酶解时间的延长,紫萁黄酮得率呈先升后降趋势,40 min 时得率达到最高,为3.801%,之后得率显著下降。原因可能是随着酶解时间的延长,纤维素酶与底物的作用越充分,细胞壁被完全破坏,紫萁细胞内部黄酮充分溶出;但当继续延长酶解时间,底物浓度降低或者产物积累会对酶的活性有抑制作用[30]。故酶解时间选择40 min 为宜。

图5 酶解时间对紫萁黄酮得率的影响
2.1.6 超声功率对紫箕黄酮得率的影响 由图6可知,随着超声功率的增大,紫萁黄酮得率呈先升后减趋势,超声功率为300 W 时得率达到最大值,为4.156%,之后得率显著下降。原因是随着超声功率的增大,所产生的空化效应及振荡作用相应增强,对细胞壁的破坏程度也增强,有利于细胞内黄酮的溶出,紫萁黄酮得率升高;然而超声功率过大可能会引起黄酮内部结构破坏,导致黄酮损失,因此紫萁黄酮得率降低[31]。综上,选择200、300、400 W 的超声功率进行响应面试验。

图6 超声功率对紫萁黄酮得率的影响
2.2 紫萁黄酮提取响应面优化试验结果
2.2.1 响应面试验结果及回归模型方差分析由表2 所示,通过回归分析得到二次多项回归方程为:Y=4.310-0.003A+0.200B+0.100C+0.007D-0.018AB+0. 025AC +0. 0170AD - 0. 055BC -0.012BD+0.035CD-0.081A2-0.240B2-0.440C2-0.230D2。

表2 响应面试验设计及结果
由表3 可知,模型P<0.0001,表示该回归模型差异极显著;失拟项的P>0.05,表明模型与试验因素拟合较好;模型的决定系数R2=0.9899,调整系数R2Adj=0.9798,进一步表明此模型精确度高,试验设计较可靠,可用此模型对紫萁黄酮提取工艺进行分析和理论预测。
从表3 可看出,一次项B、C,二次项A2、B2、C2、D2对紫萁黄酮得率的影响达到差异高度显著水平(P<0.01),交互项BC 对紫萁黄酮得率的影响达到差异显著水平(P<0.05),这说明各因素综合交互影响紫萁黄酮得率。4 个因素对紫萁黄酮得率影响的顺序为:液料比(B)>乙醇浓度(C)>超声功率(D)>纤维素酶添加量(A)。

表3 响应面试验二次模型方差分析
2.2.2 响应面各因素交互作用分析 响应面图曲面坡度越陡、等高线越密集,表示响应面值受该因素影响就越大。从图7 可看出,乙醇浓度与液料比交互作用的响应面图最陡峭,等高线较密集,说明该交互作用对紫萁黄酮提取率的影响最显著,而其余交互项显著性相对较差。


图7 两两因素交互作用对黄酮得率影响的响应面和等高线图
2.2.3 验证试验 通过回归模型预测,得到最佳提取工艺条件为:超声时间20 min、纤维素酶添加量0.98%、液料比44 mL/g、乙醇浓度40%、酶解时间40 min、超声功率300 W,得率4.357%。结合实际情况,将预测最佳工艺条件优化为:纤维素酶添加量0.98%、液料比44 mL/g、乙醇浓度40%、超声功率300 W。同时进行3 次平行试验验证,实际得率为(4.371±0.020)%,与模型预测值相差较小,证实了该模型的可靠性和有效性,具有一定实用价值。
2.3 紫萁黄酮抗氧化活性结果
2.3.1 DPPH 自由基清除能力 由图8 可知,紫萁黄酮对DPPH 自由基的清除率随着质量浓度的增加而逐渐增强,当质量浓度为0.6 mg/mL 时,清除率达到93.23%,表明其具有一定的量效关系。通过计算,紫萁黄酮与VC 对DPPH 自由基清除率的IC50值分别为0.169 、0.015 mg/mL。
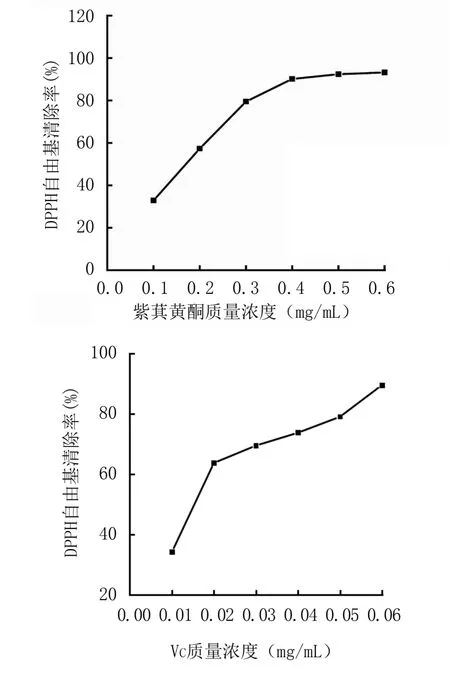
图8 紫萁黄酮与VC 对DPPH 自由基的清除率
2.3.2 ABTS 自由基清除能力 由图9 可知,随着紫萁黄酮质量浓度的增大,其对ABTS 自由基的清除率不断升高,当质量浓度为0.24 mg/mL时,清除率为85.72%,表明其具有一定的量效关系。通过计算,紫萁黄酮与VC 对ABTS 自由基清除率的IC50值分别为0.101、0.008 mg/mL。

图9 紫萁黄酮VC 对ABTS 自由基的清除率
3 结论
本试验采用超声波酶法辅助提取紫萁黄酮,考察了6 个因素对紫萁黄酮得率的影响,并通过响应面法优化提取工艺,得到最佳提取工艺条件为:超声时间20 min、纤维素酶添加量0.98%、液料比44 mL/g、乙醇浓度40%、纤维素酶解时间40 min、超声功率300 W,得率可达4.371%。这为袁亮等[32]采用80%乙醇提取陕南紫萁黄酮得率的2.8 倍,田国政等[15]采用60%乙醇提取湖北紫萁黄酮得率的3.4 倍,可见超声波酶法能够较好地对紫萁中的黄酮类物质进行提取。抗氧化活性研究发现紫萁黄酮清除DPPH、ABTS 自由基的IC50值分别为0.169、0.101 mg/mL,其清除率是随紫萁黄酮质量浓度的升高而加强,具有一定的量效关系。该研究结果可为紫萁资源的进一步开发利用提供理论依据。

