一个遗传性抗凝血酶缺陷症家系的表型与基因突变分析
周星星,谢耀盛,谢海啸,王明山
温州医科大学附属第一医院 医学检验中心 浙江省检验诊断及转化研究重点实验室,浙江 温州 325015
抗凝血酶(antithrombin, AT)是由肝细胞和内皮细胞分泌产生的天然抗凝物,为小分子单链糖蛋白,由432个氨基酸组成。AT可以与凝血酶以及多种凝血因子的丝氨酸蛋白酶活性中心特异性结合,抑制其活性,达到抗凝作用[1]。合成AT蛋白的基因(SERPINC1)位于1q23-25,由6个内含子和7个外显子组成[2]。遗传性AT缺陷症是由于SERPINC1基因突变外周血中AT异常的先天性凝血系统异常疾病,呈常染色体显性遗传,实验室检查表现为外周血中AT蛋白功能或者浓度的异常。遗传性AT缺陷症可以分为两型:I型,因AT合成障碍导致,表现为AT活性和抗原同步降低;II型,因AT结构异常导致,表现为AT活性降低,而抗原含量正常[3]。笔者报道1例遗传性AT缺陷症家系,分析各成员临床表型和基因型,结合生物信息学软件预测结果,探讨其可能的分子致病机制。
1 对象和方法
1.1 对象 先证者,男,25岁,江西省吉安市人。自述3个月前有右下肢肿胀病史,4 d前无明显诱因下出现左下肢肿胀,行走后出现显著酸胀,持续时间较长,经卧床休息后症状可得到缓解,无胸闷气促,遂至温州医科大学附属第一医院进一步治疗。入院后行肺动脉造影示:左肺部可见多处动脉末端栓塞,主要分布于下肺动脉主干和上部肺叶;行双侧下肢动(静)脉彩超示:双侧髂外静脉及双下肢全程深静脉血栓形成,部分血管见再通,予“那屈肝素钙注射液”抗凝治疗后疼痛稍缓解。为了明确血栓形成的原因,对先证者进行了易栓症遗传性危险因素的筛查,结果显示先证者蛋白S活性(PS:A)和蛋白C活性(PC:A)无明显异常,而抗凝血酶活性 (AT:A)降低为29%,抗凝血酶抗原(AT:Ag)降低至59 mg/L。将先证者及家系其他成员共3代7人纳入本调查范围,除先证者外,其余家系成员目前均无相关临床症状,家系图谱见图1。为建立实验室参考范围,筛选100名健康献血者作为正常对照,男50名,女50名,年龄16~52岁,平均28岁,均无心血管及肝肾疾病,无糖尿病及血栓性疾病史。本研究经医院伦理委员会批准(伦理批准号:伦审2012-17),研究对象均知情同意。

图1 遗传性AT缺陷症家系图
1.2 方法
1.2.1 样本采集:采集各家系成员外周静脉血2管,一管采集2.7 mL于0.3 mL枸橼酸钠(浓度: 109 mmol/L)抗凝管中,4 ℃ 1 500×g离心10 min, 收集上层血浆用于凝血指标检测;另一管采集2 mL于EDTA抗凝管中用于基因组DNA提取。
1.2.2 血浆凝血指标检测:活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time, PT)、纤维蛋白原(fibrinogen, FIB)、凝血酶时间(thrombin time, TT)及PS:A采用一期凝固法,D-二聚体(Ddimer, D-D)含量采用免疫比浊法,AT:A和PC:A采用发色底物法,AT:Ag采用酶联免疫法,检测仪器为Stago血凝仪(法国斯塔高公司),采用配套试剂盒并严格按照试剂说明书进行操作。
1.2.3 PCR扩增基因组DNA:采用酚-氯仿法提取家系各成员外周血细胞基因组DNA。参考文献[4]中提供的引物序列,通过NCBI Primer软件设计引物,使其能涵盖SERPINC1基因所有外显子及其侧翼序列(见表1),引物由生工生物工程(上海)股份有限公司合成。PCR产物经纯化后在Illumina NextSeq 500平台进行高通量测序(由上海派森诺生物科技股份有限公司完成检测),在Chromas2.01软件中导入回报的测序结果与SERPINC1标准序列(GenBank ID:NG_012462.1)进行比对分析,寻找突变基因位点,并对可疑位点重新进行PCR扩增,予以正、反向测序验证;确定基因突变的存在和类型后,再对家系成员相应位点进行PCR扩增及测序。

表1 SERPINC1基因PCR引物序列和片段长度
1.2.4 生物信息学分析:采用Mutation Taster、Poly-Phen-2和LRT生物信息学软件预测基因突变位点对蛋白质结构和功能的影响;通过ClustalX-2.1-win多重序列比对软件分析突变氨基酸在其余9个同源物种间的保守性;从现有蛋白质数据库中检索出AT蛋白模型范本(PDB ID:P01008),在Swiss-Pdb Viewer软件中建模突变前后AT蛋白的结构图,比对分析突变对AT蛋白质空间构象和分子间作用力的影响。
2 结果
2.1 表型检测结果 先证者及其外祖母、父亲、母亲和弟弟的AT:A和AT:Ag均降低,分别为29%、 59 mg/L,86%、200 mg/L,65%、99 mg/L,90%、 206 mg/L,83%、180 mg/L;各家系成员PC:A和PS:A的检测结果均在正常范围内。见表2。
2.2 基因型检测结果 先证者和其父亲的SERPINC1基因第1号外显子存在c.1A>G杂合错义突变,导致氨基酸第2位的酪氨酸突变为终止密码子(p.Tyr2Stop),查阅基因突变数据库(HGMD,https://www.hgmd.cf.ac.uk/ac/all.php)和相关文献,未见c.1A>G杂合错义突变的相关报道。此 外,先证者的SERPINC1基因第5号外显子存在c.1005G>A杂合同义突变,其外祖母、母亲和弟弟也携带该突变,家系其余人员该位点均为野生型(见表2和图2)。

图2 先证者SERPINC1基因测序图
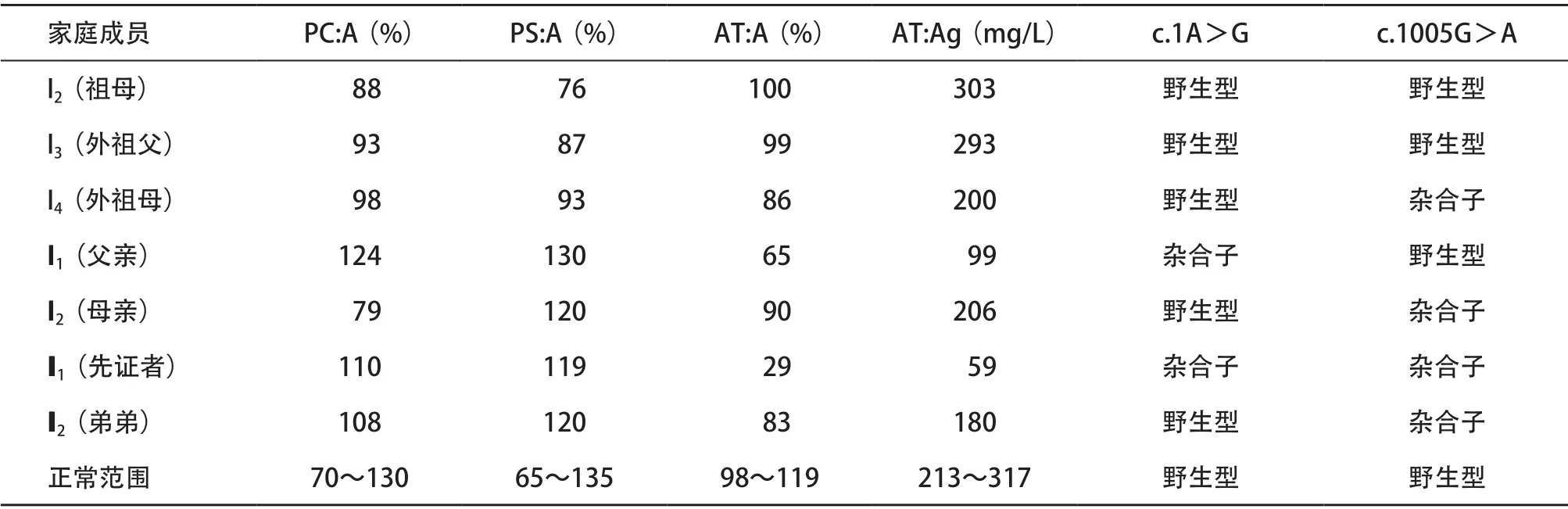
表2 遗传性AT缺陷症家系表型和基因检测结果
2.3 生物信息学软件分析结果 p.Tyr2stop突变在MutationTaster、PolyPhen-2、LRT三个软件中分析得分分别为1.000、1.000、0.000,提示该突变的预测结果为“致病的、有害的”。保守性分析显示Tyr2在10种同源物种中高度保守(见图3)。利用Swiss-Pdb Viewer软件构建突变蛋白模型,与野生型对比分析显示,p.Tyr2stop突变导致第2位产生终止密码子,后续蛋白翻译无法正常进行,形成截短型蛋白质(见图4)。

图3 Tyr2位点同源物种保守性分析

图4 p.Tyr2stop突变模型分析
3 讨论
在人体抗凝系统中,AT的作用非常重要,当AT基因发生突变时,血液中的AT蛋白出现浓度下降或者功能缺失,最终引起遗传性AT缺陷症[5]。该病临床表现为血栓的反复形成,其中以肺栓塞、下肢深静脉血栓最为常见,还可见于髂静脉和肠系膜静脉,临床发病率为5/105~5/104。而在静脉血栓栓塞症患者中,AT缺陷症的发病率高达1/200~1/20。有研究表明AT缺陷能够使血栓形成的危险性增加20倍[6],中国人在静脉血栓栓塞症中的发病率为5.75%~7.14%,是静脉血栓栓塞的主要遗传性危险因素之一。截至2022年7月,人类基因突变数据库收集的数据中包含420多种AT基因突变位点,58.1%为错义突变,移码突变占35.4%,其他类型突变占6.5%。
先证者在早期即发现了多处静脉血栓并伴有显著症状,而家系携带单杂合突变成员均无相关临床症状。家系各成员的基因分析结果显示,先证者携带复合杂合突变(c.1A>G和c.1005G>A),AT:A水平降至29%;其父亲携带c.1A>G突变,AT:A水平降至65%且伴有下肢静脉血栓病史;其外祖母、母亲和弟弟携带c.1005G>A突变,AT:A水平略微下降而不伴有静脉血栓病史。前期收集的临床资料和遗传家系图显示,其家系成员均无基础疾病,且各凝血指标均正常,AT:Ag与AT:A同步降低,而且均携带相同突变位点,可推断先证者携带的两个基因突变遗传自其父亲和母亲,并导致了其早期的临床症状,其中c.1A>G是导致疾病的主要突变。三个生物信息学软件分析显示p.Tyr2stop突变为“致病的、有害的”,可能会导致AT缺陷。为了进一步验证p.Tyr2stop突变对AT蛋白结构的影响,本研究进行了蛋白模型分析,结果显示:第1位碱基发生突变后,破坏了Tyr2下游的正常阅读框,形成一组终止密码子,核糖体识别到后停止蛋白质的翻译合成,造成肽链合成提前终止或者稳定性下降,产生截短蛋白,高度不稳定且易降解。
外周血中成熟的具有功能性的AT蛋白需要在内质网中经历二次翻译和修饰产生4个天冬酰胺的N-糖基化和3个半胱氨酸二硫键[7],而引导AT新生蛋白进入内质网的一段编码信号肽则至关重要,由AT蛋白二级结构中1至32位的氨基酸构成,p.Tyr2stop突变会引起该功能区域缺失,体内产生的截短蛋白呈高度不稳定性,易被捕获降解或者分泌障碍,最终导致血清中AT蛋白水平下降,同时会降低那屈肝素钙的治疗效果。蛋白质同源性分析显示:Tyr2在同源物种(哺乳动物、爬行类动物、鸟类、鱼类等)之间高度保守,表明它对AT正常结构的维持和蛋白功能的发挥有重要作用。同时先证者还携带有c.1005G>A杂合同义突变,第1005位G碱基位于SERPINC1基因外显子第5区,翻译后的功能蛋白并非AT的主要功能区或者肝素结合区,该突变在文章中曾有报道[8-9],氨基酸序列未发生改变,但是它改变了核苷酸序列,可通过miRNA影响基因的表达,影响翻译过程中蛋白质同步折叠,最终影响蛋白质结构[10]。观察家系成员的临床表现和凝血指标,推测两个突变之间可能存在协同作用。其他仅存在单一c.1005G>A突变的家系成员,没有相关临床表现,但是当存在其他获得性易栓因素,如高龄、长期制动、妊娠、肝脏疾病等,血栓形成的概率将大幅度增加[11]。
综上所述,笔者对一个遗传性AT缺陷症家系进行表型和基因突变分析,证明先证者出现深静脉血栓形成可能与c.1A>G和c.1005G>A复合杂合突变有关,其中c.1A>G杂合错义突变国内外尚未见报道;采用生物信息学软件预测突变危害性和建立突变蛋白模型,初步探讨了其致病机制,但两种突变导致外周血中AT水平降低的具体机制,需要通过体外实验做进一步的探讨。

