基于16S rDNA测序分析功能性便秘婴幼儿的肠道菌群组成
李辉,王娟,袁新华
湖州市妇幼保健院 儿科,浙江 湖州 313000
功能性便秘(functional constipation, FC)是指除外肠道或全身器质性疾病及药物性因素所引起的便秘,占儿童便秘的90%~95%,是儿童常见的功能性胃肠道疾病。目前全球儿童FC患病率为 9.5%,但4岁以下儿童的患病率更高,为17.5%[1]。FC在临床表现上主要为排便费力、排干硬便、排便不尽感,排便时肛门直肠堵塞感等。长期便秘严重影响儿童身心健康,尤其对于婴幼儿,影响其生长发育,并给患儿家长带来了沉重心理负担[2]。FC的发病病理生理机制复杂,目前确切病因尚未明确,可能与遗传、饮食、代谢、精神、肠道菌群等因素有关。随着核酸技术发展,16S rDNA序列测定可被用于细菌的分型鉴定,以及发现和描述新的细菌种类,因而被广泛用于肠道菌群的研究。本研究通过16S rDNA测序对0~3岁患有FC婴幼儿的肠道菌群进行研究,分析其菌群结构以及潜在的细菌生物标志物,旨在为指导临床干预与治疗提供依据。
1 资料和方法
1.1 一般资料 选取2020年1月至12月在湖州市妇幼保健院门诊就诊的0~3岁FC患儿17例作为观察组。纳入标准:符合2016年儿童功能性胃肠病罗马IV诊断标准[3],年龄<4岁的儿童至少符合以下条件中2项,持续时间达1个月:①每周排便≤2次;②大量粪便潴留史;③有排便疼痛和排便费力史;④排粗大粪便史;⑤直肠内存在大量粪便团块;⑥接受排便训练,能控制排便后每周至少出现1次大便失禁;⑦粗大粪便曾堵塞抽水马桶。排除标准:①合并有严重的先天性畸形者;②合并有严重的恶性肿瘤者;③伴有严重血液性疾病者;④有消化道疾病及手术史;⑤甲状腺功能减低等内分泌疾病史;⑥1周内曾使用抗生素、粗纤维、多糖类食物及益生菌等微生态药物者。同期选取纳入儿保科常规体检及系统管理的排便正常的0~3岁婴幼儿15例做为对照组。患儿家属均自愿参加并签署知情同意书。本研究通过湖州市妇幼保健院伦理委员会批准(编号:2018-R-007)。
1.2 主要仪器和试剂
1.2.1 主要仪器:包括Eppendorf Centrifuge 5424的常温离心机,Microfuge R 22RCentrifuge的冷冻离心机,上海华利达公司WH-861 Vortex Shaker的旋涡震荡仪,杭州朗基科学仪器有限公司A200基因扩增仪以及上海天能公司REPS300的电泳仪等。
1.2.2 主要试剂:包括上海仪涛生物仪器有限公司生产的货号为M0536L的Pusion Hot start flex 2X Master Mix,日本Takara公司生产的货号为3427A的DL2000 DNA Maker,美国Life Technologies 公司生产的货号为Q32854的Qubit dsDNA HS Assay Kit(500次)以及北京金博益生产的货号为GBY-1的Gene colour等。
1.3 方法
1.3.1 粪便标本采集:采用无菌棉签,于清晨采集研究对象的粪便,并将排出的粪便立即置于密闭避光的粪便储存器内作为粪便标本待检测,随机标记后迅速将装有粪便标本的粪便储存器置于-80 ℃的低温冰箱内保存待检。
1.3.2 粪便标本DNA提取与PCR扩增:选择E.Z.N.A.®Stool DNA Kit(杭州联川生物技术股份有限公司)分离试剂盒从粪便样本中提取细菌全基因组DNA,并通过琼脂糖凝胶电泳检测DNA提取质量,同时采用紫外分光光度计对DNA进行定量。按说明书进行操作,将细菌总DNA主带完整无污染的样本进一步检测。使用PCR扩增引物:正向引物341F(5’-CCTACGGGNGGCWGCAG-3’),反向引物805R(5’-GACTACHVGGGTATCTAATCC-3’);对细菌总DNA中16S(V3+V4)区进行扩增建库,以及使用PCR扩增引物:正向引物F(5’-GTGARTCATCGAATCTTTG-3’),反向引物R(5’-TCCTCCGCTTATTGATATGC-3’),对细菌总DNA中ITS2区进行扩增建库。
1.3.3 文库制备及基因测序:PCR扩增产物通过 2%琼脂糖凝胶电泳进行检测,并对目标片段进行回收,回收采用AxyPrep PCR Cleanup Kit回收试剂盒。纯化后的PCR产物采用Quant-iT PicoGreen dsDNA Assay Kit在Qbit荧光定量系统上对文库进行定量,合格的文库浓度应在2 nmol/L以上。将合格的上机测序文库(Index 序列不可重复)梯度稀释后,根据所需测序量按相应比例混合,并经NaOH变性为单链进行上机测序,使用NovaSeq测序仪进行2×250 bp的双端测序。PCR反应成分和体积包括Phusion Hot start flex 2X Master Mix, 12.5 μL;Forward Primer 2.5 μL;Reverse Primer 2.5 μL;Template DNA 50 ng;Add ddH2O 25 μL。PCR反应条件:95 ℃温度下预变性30 s以及10 s,再进行30个循环,每一循环的过程在54 ℃环境下进行30 s的变性,最后在72 ℃的环境下进行45 s以及10 min的变性,并在4 ℃环境下退火。
1.3.4 生物分析流程:通过cutadapt1.9软件对数据预处理,将测序得到的原始数据进行过滤低质量数据处理,保证后续信息分析结果的准确性;使用FLASH软件对16S(V3+V4)扩增区和PEAR软件对ITS2扩增区双端拼接,将双端数据合并成一条长的扩增子片段;利用qiime2 DADA2软件进行降噪,获得ASV(feature)特征序列和ASV(feature)丰度表格,并去除singletons ASVs,基于得到的ASV(feature) 特征序列和ASV(feature)丰度表格进行Alpha多样性分析和betau多样性分析。其中Alpha多样性分析主要通observed_species、shannon、simpson、chao1、goods_coverage、pielou_e七大指数对生境内的多样性进行评估。Beta多样主要通过计算四种距离(weighted_unifrac、unweighted Unifrac、 jaccard、bray_curtis),采用六大分析对生境间(样本/分组间)的多样性进行评估分析。根据ASV(feature)序列文件采用SILVA(Release 138)数据库以NT-16S数据库进行物种注释,并根据ASV(feature)丰度表对各物种在各样本中的丰度进行统计。基于得到的物种丰度统计信息,进行2组之间的差异分析。LEfSe(LDA effect size)分析是一种用于发现和解释高维度数据生物标识的分析工具,利用LEfSe(LDA effect size)分析在组与组之间寻找丰度具有统计学差异的生物标识。
1.4 统计学处理方法 采用SPSS24.0统计学软件进行数据分析,正态分布的计量资料以±s表示,采用t检验,非正态分布计量资料以M(P25,P75)表示,采用Mann-WhitneyU检验。计数资料以[例(%)]表示,2组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组的一般资料比较 2组年龄、体质量、性别差异无统计学意义(P>0.05),见表1。
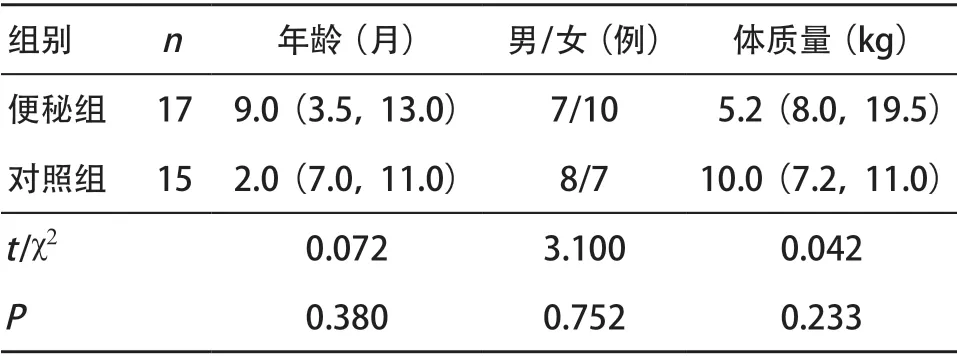
表1 2组一般资料比较
2.2 Alpha多样性分析结果 通过计算observed_species、shannon、simpson、chao1和goods_ coverage指数的分析方法进行Alpha多样性分析,2组Chao1指数差异具有统计学意义(P=0.027),见图1A,表明便秘儿童的肠道菌群物种有很好的丰富度;2组Simpson指数差异无统计学意义(P=0.310),见图1B,表明2组肠道菌群Alpha多样性无显著性差异。
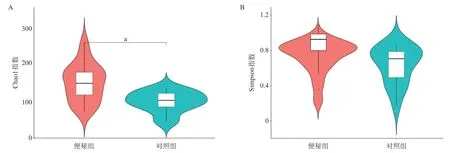
图1 2组菌群Alpha多样性分析结果
2.3 Beta多样性分析结果 采用PCoA分析方法对2组进行Beta多样性分析,基于unweighted UniFrac距离的Beta多样性分析表明,2组的微生物组成是不同的,见图2。进行相似性分析,结果表明便秘组肠道微生物组的结构与对照组显著不同(r=0.158,P<0.01)。
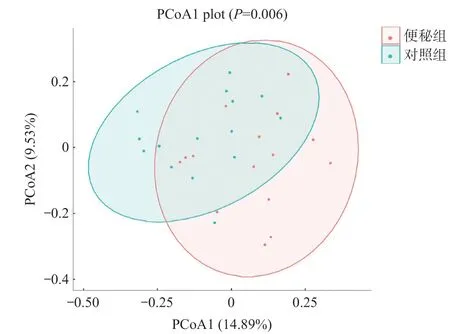
图2 2组肠道菌群的Beta多样性分析结果
2.4 菌群组成分析结果 从细菌“门”水平对两组样本进行群落分析:便秘组丰度前3位的分别是放线菌门(Actinobacteria)、厚壁菌门 (Firmicutes)、变形菌门(Proteobacteria),占比分别为46.7%、31.3%、13.58%;对照组丰度前3位的分别为放线菌门、厚壁菌门、变形菌门,占比分别为48.2%、23.9%、27.2%,见图3。另外,疣微菌门 (Verrucomicrobia)在便秘组中丰度较多,占比为7.3%,而在对照组中极少,占比为0.003%,差异具有统计学意义(P<0.05)。从细菌“属”水平对两组样本进行群落分析:便秘组丰度前5位的分别是双歧杆菌属(Bifidobacterium)、链球菌属 (Streptococcus)、伯克霍尔德菌属(Burkholderia)、 乳酸菌属(Lactobacillus)、阿克曼菌属 (Akkermansia),占比分别为43.9%、10.38%、8.2%、8.0%、7.3%;而对照组丰度前5位的分别是双歧杆菌属、链球菌属、伯克霍尔德菌属、乳酸菌属、阿克曼菌属,占比分别为41.92%、11.65%、2.83%、0.87%、0.003%,见图4;另外,乳酸菌属和阿克曼菌属在便秘组中丰度所占比明显高于对照组,差异具有统计学意义(P<0.05)。
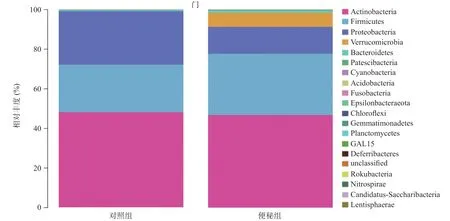
图3 2组间肠道细菌“门”水平群落组成对比
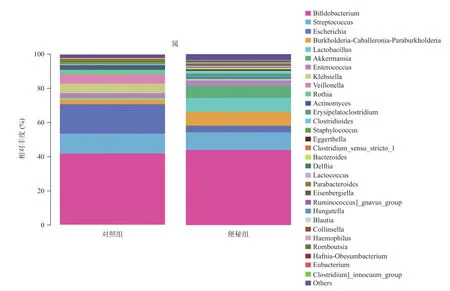
图4 2组间肠道细菌“属”水平群落组成对比
2.5 肠道菌群LEfSe分析结果 LEfSe分析2组间丰度具有统计学差异的生物标识。便秘组中双歧杆菌种HGAT9(Bifidobacterium_sp_HGAT9)、疣微菌门、阿克曼菌属、副干酪乳杆菌(Lactobacillus_ paracasei)等物种丰度差异有统计学意义(P<0.05);对照组中齿双歧杆菌(Bifidobacterium_sp_ dentium)、放线菌目(Actinomycetales)、放线菌科(Actinomycetaceae)、放线菌属(Actinomyces)、鼠李糖乳杆菌(Lactobacillus_rhamnosus)物种丰度差异有统计学意义(P<0.05),见图5。
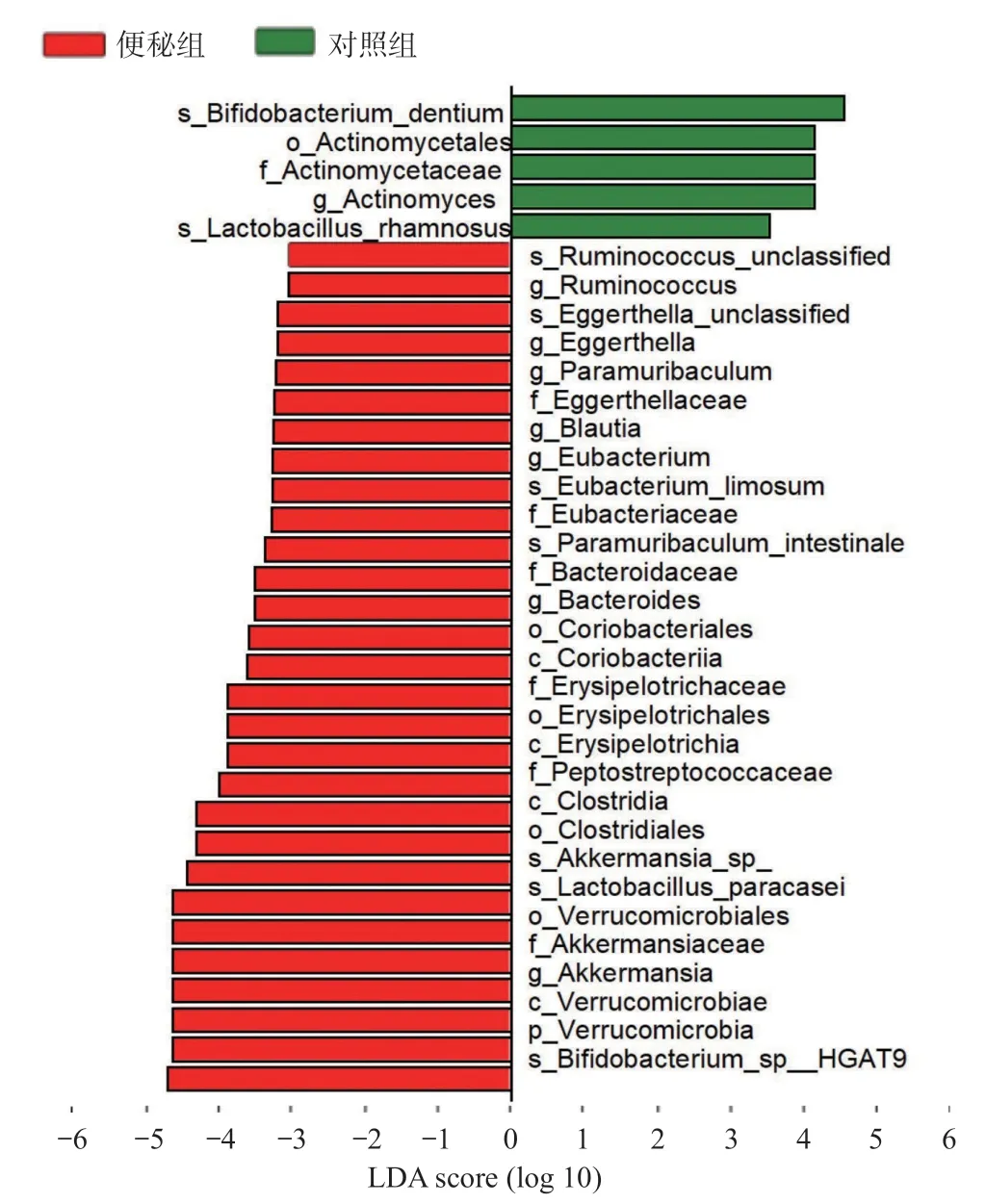
图5 2组的LEfSe分析图
3 讨论
便秘是临床上常见的幼儿疾病,其中约有95%为FC。FC的病理生理机制复杂,目前确切病因尚未明确,临床治疗具有挑战性。本研究基于16S rDNA测序分析FC儿童和正常儿童肠道菌群的组成,发现两组儿童在肠道菌群的结构及多样性上存在差异,另外研究也发现了两组肠道菌群的生物标志物。
本研究的肠道菌群多样性结果表明,便秘组儿童的肠道菌群物种丰富度增加,但两组肠道菌群之间物种Alpha多样性无显著性差异,而Beta多样性存在明显差异,这表明便秘组的肠道微生物在结构上与对照组有显著不同,便秘与肠道菌群之间存在着相关性。目前有大量研究也证实了这一点[4-5]。本研究中肠道菌群构成分析显示便秘组儿童和对照组儿童在门水平上均以放线菌门、厚壁菌门、变形菌门为优势菌。两组间的差异菌门为疣微菌门,便秘儿童肠道内疣微菌门明显高于对照组儿童。疣微菌门为肠道常见的微生物菌群,目前发现与多种疾病有关。有动物实验发现用多菌株益生菌和合生元联合给药能显著降低疣微菌门的数量,且减少疣微菌门的数量可能对便秘有缓解作用[6]。WANG等[7]在研究洛哌丁胺诱导的动物便秘时发现厚壁菌的相对丰度降低,而疣状菌的相对丰度增加。这些说明疣微菌可能与便秘有关,但发生机制仍需进一步研究。在属水平上,双歧杆菌为两组优势菌种,两者所占比例相差不大,与国外的研究结果一致[4]。双歧杆菌属可以通过调节便秘患者血清中的胃肠调节肽水平,刺激肠道产生短链脂肪酸(short chain fatty acids, SCFAs),另外还可促进乳酸的产生,降低肠道pH值,促进肠道蠕动,改善便秘症状[8]。乳酸菌属在便秘组中丰度高于对照组,这与国外的一些研究不一致[9],考虑到本研究人群为0~3岁婴幼儿,可能与乳酸菌属早期在肠道定植不稳定以及饮食对肠道菌群的调节有关[10]。乳酸菌具有较好的肠道保护作用,尤其是对有肠道症状的患儿,它通过合成SCFA、刺激肠道蠕动和增加粪便颗粒中的水分含量来缓解便秘[11]。LI等[12]通过动物实验发现给予乳杆菌NCU116可显著改善小鼠便秘症状,并导致其粪便中乙酸和丙酸水平显著升高。但另一项涉及129名FC儿童的随机对照研究发现罗氏乳杆菌DSM 17 938对FC秘治疗无效[13]。目前乳酸菌与便秘之间的关系仍需进一步研究。另外本研究发现阿克曼菌属在便秘组中丰度也高于对照组。阿克曼菌目前发现与肥胖、糖尿病、阿尔茨海默病等疾病有关。在国内的一项动物实验中发现便秘小鼠粪便微生物群中阿克曼菌属丰度较高,但机制不明确,可能与其能降解肠黏蛋白,使大便干燥,最终导致肠黏膜屏障受损有关[14]。至今为止,很少有报道阿克曼菌属与儿童便秘之间存在相关性。本研究发现阿克曼菌属是具有统计学差异的生物标志物,这为未来研究其与便秘之间的关系提供了思路。
目前对于儿童肠道菌群的相关研究并不多见且研究结果不一,且尚未确定FC儿童的肠道微生物群特征。出现这些不同可能与以下因素有关:①不同的研究人群数量、年龄以及地区可能会影响实验结果[13];②检测肠道菌群方法不同,不同研究结果之间的直接比较缺乏说服力[5];③微生物分析通常在粪便样本中进行,然而,粪便中存在的微生物群可能与黏膜相关的微生物群存在差异[15];④肠道微生物组分和便秘受饮食的影响很大,这也可能会影响研究之间的直接比较等。因此,未来的研究应控制相关的混杂因素,并采用多组学研究策略对FC进行微生物研究,有助于获得更完整、更深入的结论。
综上所述,0~3岁婴幼儿FC与肠道菌群之间存在一定的关系,但FC的发病受饮食、地域、种族、年龄以及性别等诸多因素影响。本研究仅对婴幼儿FC者进行了粪菌检测,且样本量偏小,研究结果比较局限,未来仍需大量深入的研究来探讨健康儿童和便秘患者肠道微生物组成间的差异,并有益于发现更多的肠道菌群制剂,或许在未来对肠道菌群的调节会成为治疗FC儿童的靶点。

