基于KEGG通路富集分析颗粒酶B-穿孔素选择性诱导胰腺炎时巨噬细胞凋亡的作用
孔鸿儒,俞浩辉,陈格尔,陈咨苗,戴胜杰,孙学成,金约朋,杨文军,孙洪伟
1.温州医科大学附属第一医院 肝胆胰外科,浙江 温州 325015;2.温州医科大学 第一临床医学院(信息与工程学院),浙江 温州 325035;3.温州医科大学附属第一医院 内分泌科,浙江 温州 325015;4.温州医科大学附属第一医院 消化内科,浙江 温州 325015
尽管近年来重症急性胰腺炎(severe acute pancreatitis, SAP)的疗效有所提高,但病死率高、住院时间长、并发症多、医疗费用高昂等治疗现状仍未见显著改观[1]。作为一种非恶性肿瘤性疾病,10%~20%的病死率仍难以接受。SAP患者的临床表现一般为系统性炎症反应综合征(systemic inflammatory reaction syndrom, SIRS),而SIRS产生的炎症因子会攻击富血供的靶器官,随之产生多器官功能障碍(multiple organ dysfunction syndrome, MODS),而MODS是SAP最主要的直接死 因[2]。单核-巨噬细胞是参与SAP病理生理过程中的主要炎症细胞之一[3],急性胰腺炎炎症反应初期,单核-巨噬细胞和中性粒细胞在黏附分子作用下,从血液迁移至胰腺间质,单核细胞趋化因子蛋白-1(monocyte chemoattractant protein-1, MCP-1)、巨噬细胞炎性蛋白-1α(macrophage inammatory protein 1α, MIP-1α)、CC类趋化因子-5(CC chemokine ligand-5, CCL5)参与活化单核细胞,随之这些浸润细胞参与产生不同的细胞因子和炎症介质,产生级联反应,致使胰腺局部炎症加重,而炎症因子进入血液影响其他器官如肺、肝脏、脾等。因此,抑制巨噬细胞活性,可以从SAP-SIRS发生的源头上阻断此炎症级联反应,对治疗急性胰腺炎具有 重要的价值。颗粒酶(granzyme)是一种丝氨酸蛋白酶,存在于细胞毒淋巴细胞和自然杀伤细胞的胞浆内。凋亡过程中,颗粒酶和穿孔素(pore-forming protein, PFP)释放到靶细胞附近,在PFP作用下颗粒酶进入靶器官,诱导含半胱氨酸的天冬氨酸蛋白水解酶3(caspase8)活化,激活RIP1参与的细胞凋亡[5]。基于颗粒酶B(granzyme B, GRB)有效的凋亡诱导作用,本研究旨在探索GRB-PFP是否能有效影响巨噬细胞活性,减轻胰腺炎模型的炎症反应。
1 材料和方法
1.1 主要材料 人单核巨噬细胞系(TPH-1)购于中国科学院上海细胞所。DMEM购自美国Hyclone公司;FBS购自美国Gibco公司;Cell Counting Kit-8和凋亡试剂盒购自北京索莱宝科技有限公司;TRIzol购自美国Invitrogen公司;RNA反转录试剂盒和Bestar SYBR GreenRT-PCR Master Mix购自日本Toyobo公司;RQ1 Dnase购自美国普洛麦格(北京)生物技术有限公司;TruSeq链总RNA LT样品制备试剂盒购自美国Illumina公司,肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、PFP和GRB购自美国Sigma公司。
1.2 方法
1.2.1 筛选TNF-α和TNF-α+PFP+GRB的最适浓度:鉴于在急性炎症早期,TNF-α是参与炎症的主要炎性细胞因子之一,故采用TNF-α刺激巨噬细胞,模拟急性胰腺炎时巨噬细胞炎症反应。设置浓度梯度并开展细胞增殖实验进行筛选,浓度梯度和作用时间具体为:0.1 mg/L PFP 25 μL+0.1 mg/L GRB 10 μL;0.1 mg/L PFP 25 μL+0.1 μg/mL GRB 5 μL; 0.1 mg/L PFP 25 μL+0.1 μg/mL GRB 2.5 μL; 20 ng/mL TNF-α 10 μL;20 ng/mL TNF-α 10 μL+ 0.1 mg/L PFP 25 μL+0.1 mg/L GRB 10 μL;20 ng/mL TNF-α 10 μL+0.1 mg/L PFP 25 μL+0.1 mg/L GRB 5 μL;20 ng/mL TNF-α 10 μL+0.1 mg/L PFP 25 μL+ 0.1 mg/L GRB 2.5 μL。接种1 000个细胞至96孔板,每孔加100 μL培养基,将培养板置37 ℃,5% CO2培养箱中培养0、24、48、72 h,每孔加入10 μL CCK-8溶液,用加了相应量细胞培养液和CCK-8溶液但没有加入细胞的孔作为空白对照,在细胞培养箱内继续孵育0.5 h,用酶标仪在450 nm测定吸光度。
1.2.2 细胞凋亡实验:将细胞分为NC组、TNF-α组、PFP+GRB组、TNF-α+PFP+GRB组4组,采用Annexin V异硫氰酸荧光素(FITC)凋亡检测试剂盒通过流式细胞术检测细胞凋亡。在37 ℃下处理48 h后,收获细胞(2×105),用PBS洗涤2次,并与Annexin V FITC和碘化丙啶在室温黑暗中孵育10 min。 然后使用MoFLO XDP流式细胞仪和Cell Quest 3.3软件检测和分析染色细胞。
1.2.3 RNA提取及文库制备:细胞样本分为3组:正常细胞组(NC组)、TNF-α刺激组(Treat1组)和TNF-α+PFP+GRB 10 μL刺激组(Treat2组),每组实验重复3次。使用TruSeq链总RNA LT样品制备试剂盒得到纯化的mRNA,用带有Oligo(dT)的磁珠富集mRNA,向得到的mRNA中加入Fragmentation Buffer使其片断成为短片段,再以片断后的mRNA为模板,用六碱基随机引物合成cDNA第一链,并加入缓冲液、dNTPs、RNaseH和DNA Polymerase I合成cDNA第二链,经过QIAQuick PCR试剂盒纯化并加EB缓冲液洗脱。洗脱纯化后的双链cDNA再进行末端修复、加碱基A、加测序接头处理,然后经琼脂糖凝胶电泳回收目的大小片段并进行PCR扩增,从而完成整个文库制备工作。构建好的文库用Illumina平台进行测序,测序策略为PE150。
1.2.4 转录组学分析:样本间相关性分析:以每个样本中所有基因的表达量为变量,用Pearson相关系数计算每个样本之间的相关性。差异基因分析:采用R软件包DESeq2对各组细胞进行差异基因分析。显著差异基因的筛选阈值为FDR<0.01且fold change>2;富集分析:将分析所得的差异基因进行GO分析和KEGG分析功能富集。
1.2.5 qRT-PCR:使用ReverTra Ace qPCR RT Kit进行反转录反应。通过qRT-PCR检测部分基因的表达水平,设计的引物见表1。qRT-PCR在Bio-Rad S1000上使用Bestar SYBR GreenRT-PCR Master Mix进行。PCR条件包括:95 ℃变性1 min,95 ℃变性15 s,40个循环,然后60 ℃退火和延伸30 s。使用2-ΔΔCt方法计算相对基因表达,并将参考基因Actin归一化。每个样品进行3个重复的PCR扩增。

表1 验证基因PCR引物序列
1.3 统计学处理方法 采用SPSS.21软件进行数据分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 确定TNF-α、PFP、GRB的最适浓度 根据设置的浓度梯度并开展细胞增殖实验,结果显示各组细胞活性没有明显差异(见图1),由此确定20 ng/mL TNF-α,0.1 mg/L PFP 25 μL,0.1 mg/L GRB 10 μL作为最适浓度并开展后续实验。
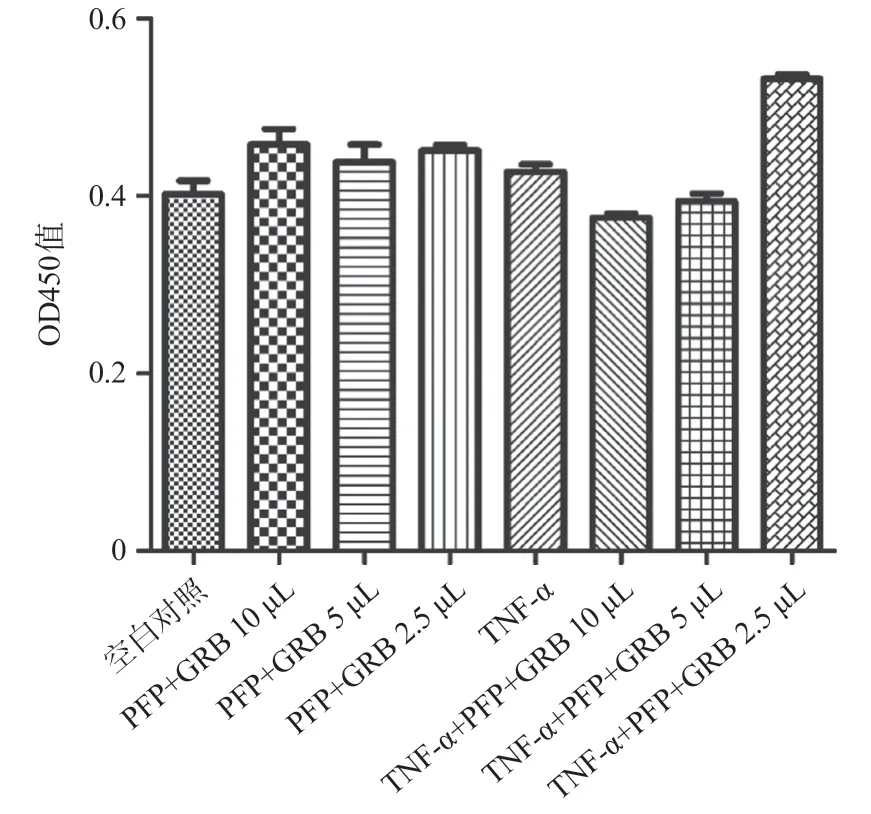
图1 CCK8 48 h各浓度梯度下细胞活性变化
2.2 细胞凋亡比例比较 流式细胞实验结果显示,TNF-α+PFP+GRB组细胞的凋亡比例与NC组、TNF-α组、PFP+GRB组相比显著升高(P<0.05),见图2。

图2 4组细胞凋亡比例比较
2.3 转录组数据样本间相关性分析 每组组内3次重复实验结果的相关性都非常高(r>0.90),尤其是Treat组(r≥0.99)),说明本研究重复性较好。NC组与Treat组的相关性相对较低,而Treat1组和Treat2组间的相关性较高,见图3。说明NC与Treat组在转录组整体水平上存在差别。
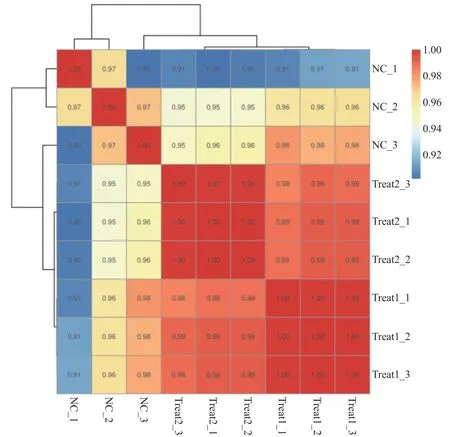
图3 样本聚类图
2.4 差异基因分析 从差异基因的数目可以看出:NC组与Treat1组、Treat2组的差异比较大,显著差异基因较多,而Treat1组与Treat2组的显著差异基因较少,表明Treat1组与Treat2组之间转录表达水平的差异不明显,见图4。

图4 差异基因分析图
另外将Treat1组、Treat2组与NC组比较的差异基因上下调分别做Venn图,结果显示,Treat1组与Treat2组相对于NC组的上调基因绝大部分都是相同的(见图5)。而下调基因中Treat2组有更多的特异性下调基因。总体可以判断,相比于Treat1组和NC组的变化,Treat2组相对于NC组的变化更大。

图5 Treat1组、Treat2组与NC组比较的差异基因的Venn图
2.5 富集分析 GO分析和KEGG分析功能富集,结果表明,从Treat2组与Treat1组分别相对于NC组的差异基因富集KEGG通路来看,富集到的显著KEGG通路都非常相似,最显著富集的通路均为“Cytokinecytokine receptor interaction”(见图6、图7)。
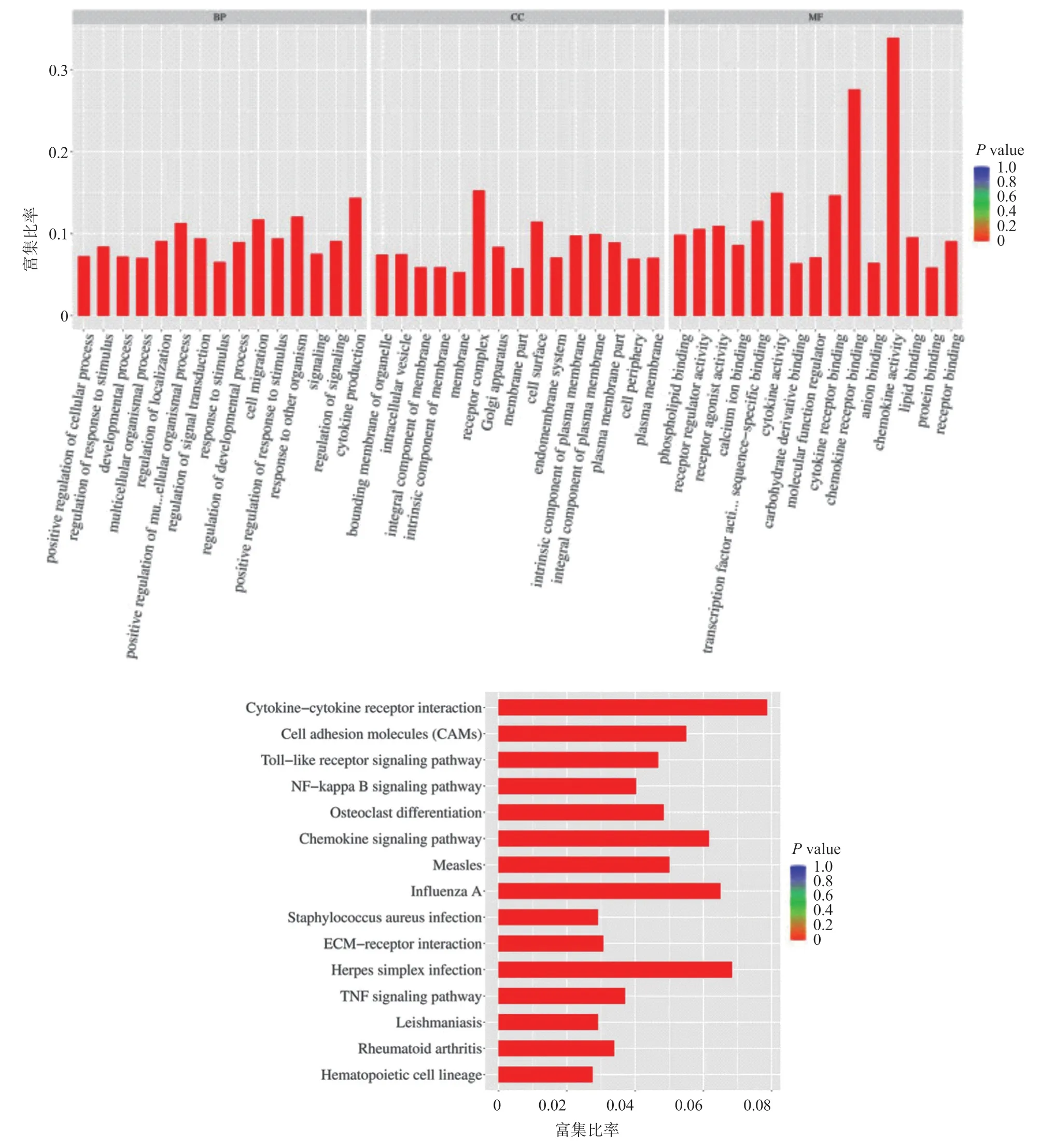
图6 Treat1相对于NC组差异基因的GO富集结果柱状图及KEGG富集结果柱状图

图7 Treat2相对于NC组差异基因的GO富集结果柱状图及KEGG富集结果柱状图
2.6 炎症相关基因网络图 我们将“Cytokinecytokine receptor interaction”通路在Treat1vs.NC与Treat2vs.NC中的显著差异基因提取出来,取交集,得到45个显著差异基因,为了更进一步研究这些基因的互作关系,将这些基因用String数据库分析得到以下的互作网络图(见图8)。

图8 差异基因互作网络图
2.7 qRT-PCR验证转录组学分析结果的准确性 从45个差异基因中挑选7个差异基因(RAB37、GPA33、USH1C、SYTL1、MSRB3、GPER1和CD1B)进行qRT-PCR实验,其结果和转录组学结果一致(见图9)。

图9 差异基因实时荧光PCR表达结果
3 讨论
在胰腺炎发生初期,胰腺腺泡细胞损伤,从而释放炎症因子,巨噬细胞是最早产生应答的免疫细胞之一[6]。巨噬细胞激活后分泌产生细胞因子又进一步激活免疫细胞,触发炎症级联反应,而产生的大量炎症因子随循环系统攻击如肺、肾、肠之类的远处器官,引起SIRS和MODS,严重时可引起多脏器功能衰竭。SHIFRIN等[7]建立的胰腺炎模型,采用药物消耗巨噬细胞,胰腺炎小鼠的存活率明显升高,说明了巨噬细胞参与了胰腺炎时炎症加重的环节。此外,传统观点认为胰腺炎的发生是由于胰腺腺泡细胞内的胰蛋白酶原异常激活[8],但有研究表明,在胰腺炎产生免疫应答过程中,有一部分胰蛋白酶原在巨噬细胞内激活[9],从而进一步加重急性胰腺炎病情[10]。这也进一步说明了巨噬细胞在胰腺炎病理生理过程中的作用。
Caspase是一类半含半胱氨酸的天冬氨酸蛋白水解酶,在细胞凋亡的过程中起着关键性作用[11]。Caspase-8是该家族的成员之一,可以作为凋亡始动子参与细胞凋亡过程,Procaspase-8可以自我活化,也可以在GRB的剪切作用下活化。GRB可活化各种Procaspase(如Pro-caspase-3、Pro-caspase-7、Pro-caspase-8、Pro-caspase-9、Pro-caspase-10),从而促进凋亡的发生[12]。
本研究显示,相比于其他各组,在TNF-α+PFP+ GRB的共同作用下,巨噬细胞活性明显降低,细胞凋亡比例明显升高,提示在TNF-α的诱导下,PFP+GRB可以诱导巨噬细胞凋亡,而并非PFP+GRB自身的药物作用。发生急性胰腺炎后,胰蛋白酶原激活,胰腺局部发生强烈的炎症反应,一旦细胞发生坏死,细胞内炎症因子释放而激活全身炎症系统,从而诱发SAP及SIRS。若细胞仅发生凋亡时,细胞体积变小但细胞膜完整,胞内成分不外扩,引起的胰腺炎病变较轻,也不会激活SIRS反应。BHATIA等[18]通过实验证实,诱导细胞发生凋亡时细胞内成分释放明显减少,周围炎症反应明显减轻。CAO等[19]也证实在胰腺炎发生初期,主动诱导胰腺腺泡细胞及炎症细胞凋亡,能够有效减轻急性胰腺炎的严重程度。ORABI等[20]发现,当腺泡细胞及炎症细胞发生凋亡时,胰腺炎症相对较轻,因此若诱导细胞凋亡,而非坏死,可能可以减轻急性胰腺炎的严重程度。
此外,通过高通量转录组测序技术,将NC组、Treat1组和Treat2组的表达基因进行对比,差异基因主要富集于细胞因子-细胞因子受体相互作用信号通路。这个通路参与机体防御、细胞生长和分化、细胞死亡、血管生成以及维持内环境稳态等[13]。细胞因子几乎参与了机体所有的生理病理过程。本研究发现,从这个通路中我们可以看到实验组对炎症有显著的应激反应,诸如,MsrB3对细胞增殖有重要作用,MsrB3缺乏会引起细胞通过p53和内质网应激途径发生凋亡,而过表达会促进细胞的增殖[14-15]; RAB37是Ras小GTP酶家族成员,负责细胞内信号转导和囊泡运输[16]。近期研究发现,RAB37直接与自噬相关基因5结合,从而诱导自噬[17]。细胞因子及其受体是机体信号传导的重要组成部分,急性胰腺炎时,胰腺腺泡细胞坏死,释放TNF-α、IL-1β、IL-6等炎性细胞因子,加重胰腺局部和全身炎症反 应[21-22]。因此,下调细胞因子表达,可以从源头上遏止炎症反应进一步加重,从而减轻全身炎症反应综合征。
本研究也有一些不足之处,并未对差异基因进行调控,进一步探究其潜在机制,从分子层面明确各细胞因子对炎症反应的影响。另外,关于诱导巨噬细胞凋亡的类型,也有待进一步实验研究。
综上所述,GRB-PFP可选择性诱导胰腺炎时巨噬细胞凋亡,并下调细胞因子及其受体。通过主动改变细胞死亡方式,减轻炎症介质释放,源头及发展过程上打断此炎症级联反应,为急性胰腺炎临床治疗上提供了新思路。

