早期肠内营养与快速康复护理干预联合应用对胃癌手术患者术后肠功能恢复的影响
张正侠, 任立梅, 张辉
(徐州市中心医院 胃肠外科, 江苏 徐州 221000)
0 引言
胃癌是消化系统恶性肿瘤中较为常见的一种, 手术是当前常用治疗方式, 可有效予以肿瘤病灶切除, 使患者预后得以改善。但胃癌患者术前多伴有食欲差、消化不良等症状, 存在一定程度的营养不良, 加之手术切除一定胃部组织、创伤产生的影响, 可只会患者术后出现严重营养不良, 不仅可增加手术并发症风险, 降低术后胃肠功能恢复效果, 而且可影响术后抗肿瘤治疗的顺利开展[1-2]。因此, 对胃癌患者实施手术治疗时, 临床上不断强调营养支持与快速康复方面的干预。早期肠内营养支持可为患者提供充足的营养供给, 使机体细胞能够正常代谢, 并使肠黏膜细胞结构、功能保持完整, 促进术后胃肠道功能恢复[3]。快速康复护理通过对围术期各项护理措施进行优化, 可使手术相关应急反应减轻, 达到促进患者术后顺利康复的效果[4]。本院近年来早期肠内营养与快速康复护理干预联合的方案应用于胃癌手术患者中, 并以2019年6月至2020年6月接收的96例患者为对象探讨应用效果, 现报告如下:
1 资料与方法
1.1 一般资料
选取98例2021年3月至2022年2月在本院接受手术治疗的胃癌患者, 采用电脑数字表法实施随机分组, 共2个组。对照组49例, 包括男性30例, 女性19例;年龄45~67岁, 平均(56.12±8.75)岁;TNM分期:Ⅰ期15例, Ⅱ期29例, Ⅲ期5例;手术方式:近端胃切除12例, 远端胃切除15例, 全胃22例。观察组49例, 包括男性29例, 女性20例;年龄46~67岁, 平均(56.50±8.78)岁;TNM分期:Ⅰ期14例, Ⅱ期29例, Ⅲ期6例;手术方式:近端胃切除12例, 远端胃切除14例, 全胃23例。纳入标准:(1)符合《胃癌规范化诊疗指南(试行)》[5]中的诊断标准与手术适应证;(2)术前未接受内镜切除、化疗、放疗;(3)术前卡氏功能状态评分≥60分;(4)配合知情同意书签字。排除标准:(1)姑息手术;(2)出现穿孔、肠梗阻等需实施急诊手术;(3)术前有严重脏器功能障碍、基础性疾病及免疫相关疾病;(4)联合脏器切除;(5)出现严重手术并发症, 生命体征不稳。本院医学伦理会已审批通过了此项研究, 且对比两组性别、年龄、TNM分期及手术方式可见(P>0.05), 可对比。
1.2 方法
对照组行早期肠内营养与快速康复护理干预:(1)早期肠外营养。术后5d禁食, 实施肠外营养支持:总热量为125.5kJ/(kg/d), 静脉输液量设定为50mL/(kg•d), 107.34kJ/(kg•d)的非蛋白热量, 0.15g/(kg•d)的补氮量, 热氮比设置为150:1, 氮通过复方氨基酸注射液(湖北一半天制药有限公司, H20046192)补充, 非蛋白热量包括30.0%~40.0%的脂肪乳(鹿邑弘道药业有限公司, H22021693)+60%~70.0%的葡萄糖注射液(四川科伦药业股份有限公司, H51020634), 维生素由水溶性维生素(蓬莱诺康药业有限公司, H20055731)10mL+脂溶性维生素(山西普德药业股份有限公司, H20090175)10mL, 术后第6d, 开始尝试予以清水、流质饮食, 并依据患者实情逐渐调整。(2)快速康复外科护理。①术前宣教。面对面与患者展开交流, 详细介绍胃癌及手术的相关知识、手术团队等, 并借此时机了解患者心理状况, 通过告知医护人员会全力予以帮助、安抚与鼓励、介绍预后良好病例等方式增强其手术信心;②术前营养支持。术前对患者展开营养筛查, 营养不良者予以营养支持, 控制白蛋白在32g/L以上, 血红蛋白在80g/L以上;③肠道准备。术前1d, 开始予以15mL乳果糖(Abbott Biologicals B.V., H20171057)口服, 术前6h禁食, 2h禁饮, 并于术前2h予以400mL的10%葡萄糖口服;④管道留置。导尿管留置于麻醉成功后进行, 尽量减少腹腔引流管留置, 并尽早拔除;⑤术中保温。手术室室温调节为24℃~26℃, 予以保温毯, 术中注射液、冲洗液加温至37℃;⑥输液与镇痛。实施目标导向性补液, 并予以多模式镇痛, 依据患者术后疼痛情况动态调整镇痛方式;⑦早期进食与活动。患者胃肠功能有所恢复后, 指导其早期经口进食, 并实施早期下床活动、康复活动指导。
观察组予以早期肠内营养与快速康复护理干预:(1)早期肠内营养。术后第1d, 经营养管予以250mL葡萄糖氯化钠注射液(山东金朗制药有限公司, H20043115)滴注, 滴速控制为50~60mL/h, 第2d经营养管予以500mL肠内营养混悬液(能全力, 纽迪希亚制药有限公司, H20030011)滴注, 滴速控制为50~60mL/h依据患者耐受情况逐渐增量, 第3~4d逐渐增加至1000mL, 滴速控制为80~100mL/h第5~7d完全通过肠内营养供给能量, 总能量目标为25kcal/(kg•d), 控制营养液滴速为100~150mL/h, 总液体量为50mL/(kg•d);(2)快速康复外科护理。与对照组一致。
1.3 观察指标
(1)术后营养状态。术后1d、术后7d时, 予以两组患者静脉血液标本采集, 通过酶联免疫吸附法检测血清前白蛋白(PAB)、血清白蛋白(ALB)及转铁蛋白(TF)水平;(2)并发症发生情况。统计两组尿路感染、肠梗阻、腹胀、吻合口瘘、肺部感染、脂肪液化等并发症发生情况;(3)术后胃肠功能恢复情况。术后1d、术后7d时, 对两组患者实施静脉血液标本采集, 通过酶联免疫分析法检测血浆二胺氧化酶(DAO)水平, 并采用比色法检测D乳酸(D-LA)水平。同时, 记录两组术后排气、胃管拔除、下床活动及住院时长。
1.4 统计学分析
此研究数据处理以SPSS 20.0进行, [n(%)]表示计数资料, 检验方法是χ2, (±s)表示计量资料,t检验, (P<0.05)为差异有统计学意义。
2 结果
2.1 术后营养状态
术后1d时, 两组PAB、ALB、TF水平对比, 差异无统计学意义(P>0.05);术后7d再次检测时, 两组PAB、ALB、TF水平均升高, 且观察组更高(P<0.05), 见表1。
表1 两组术后营养状态比较(±s)
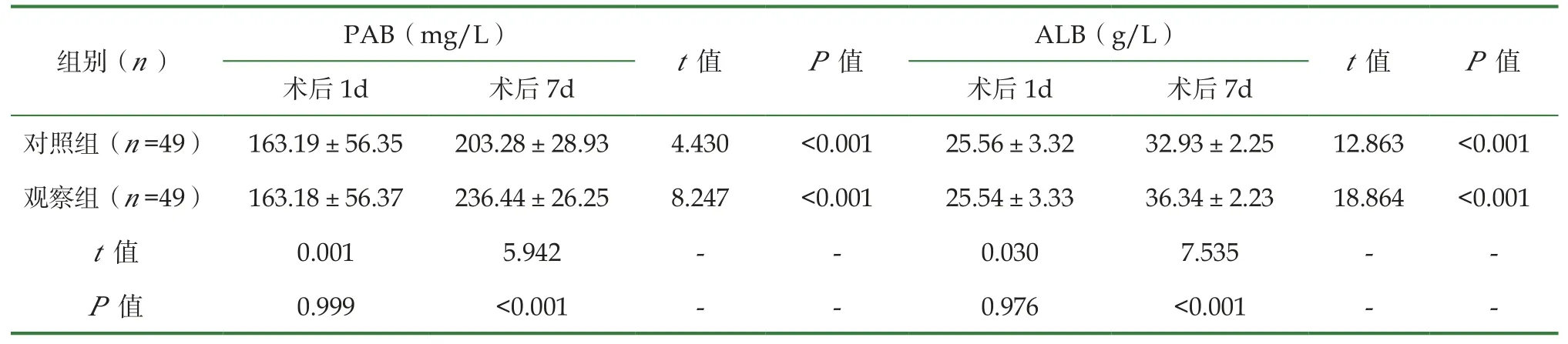
表1 两组术后营养状态比较(±s)
组别(n)PAB(mg/L)t值 P值ALB(g/L)t值 P值术后1d 术后7d 术后1d 术后7d对照组(n=49)163.19±56.35 203.28±28.93 4.430 <0.001 25.56±3.32 32.93±2.25 12.863 <0.001观察组(n=49)163.18±56.37 236.44±26.25 8.247 <0.001 25.54±3.33 36.34±2.23 18.864 <0.001 t值 0.001 5.942 - - 0.030 7.535 - -P值 0.999 <0.001 - - 0.976 <0.001 - -
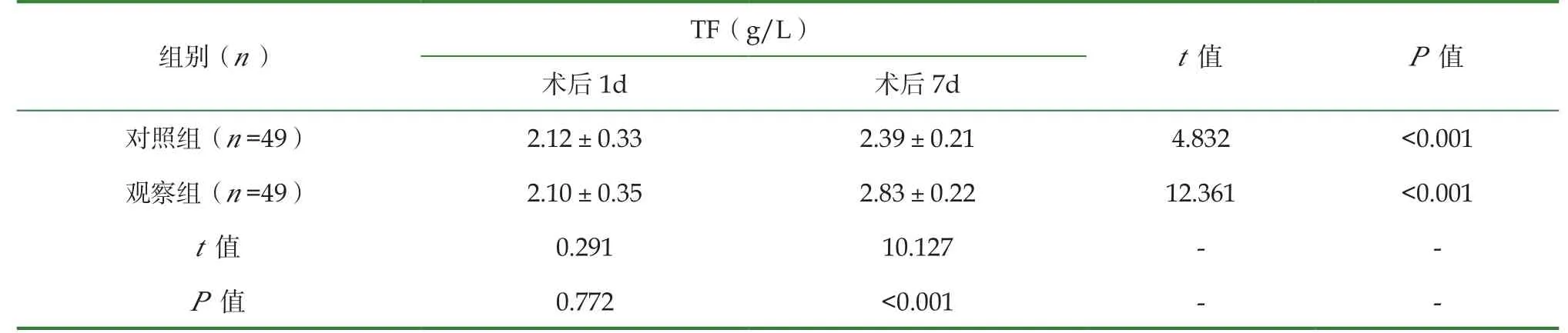
续表1
2.2 并发症发生情况
观察组并发症发生率是6.12%, 比对照组的20.41%低(P<0.05), 见表2。

表2 两组并发症发生情况对比[n(%)]
2.3 胃肠功能恢复情况
术后1d时, 两组DAO、D-LA水平比较, 差异无统计学意义(P>0.05);术后7d再次检测时, 两组DAO、D-LA水平均降低, 且观察组更低(P<0.05), 见表3。观察组术后排气、胃管拔除、下床活动及住院时长均比对照组短(P<0.05), 见表4。
表3 两组DAO、D-LA水平比较(±s)

表3 两组DAO、D-LA水平比较(±s)
组别(n)DAO(U/mL) t值 P值D-LA(mg/L) t值 P值术后1d 术后7d 术后1d 术后7d对照组(n=49) 4.35±0.42 3.09±0.31 16.896 <0.001 18.12±2.26 13.43±2.12 10.595 <0.001观察组(n=49) 4.32±0.45 2.31±0.28 26.547 <0.001 18.14±2.28 10.67±1.82 17.924 <0.001 t值 0.341 13.071 - - 0.044 6.915 - -P值 0.734 <0.001 - - 0.965 <0.001 - -
表4 两组胃肠功能恢复时间比较(±s, d)
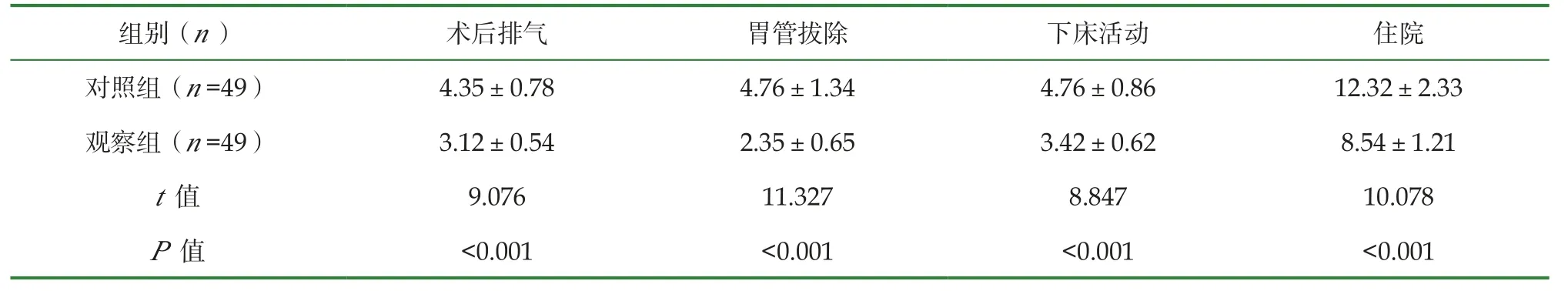
表4 两组胃肠功能恢复时间比较(±s, d)
组别(n) 术后排气 胃管拔除 下床活动 住院对照组(n=49) 4.35±0.78 4.76±1.34 4.76±0.86 12.32±2.33观察组(n=49) 3.12±0.54 2.35±0.65 3.42±0.62 8.54±1.21 t值 9.076 11.327 8.847 10.078 P值 <0.001 <0.001 <0.001 <0.001
3 讨论
胃癌是常见胃肠道恶性肿瘤的一种, 近年来发病率不断提升, 且年轻化趋势越来越明显。手术是现阶段临床上对胃癌的常用治疗方式之一, 可使肿瘤病灶有效切除, 但手术创伤产生的应激反应可致使患者出现相关不良影响, 影响术后恢复效果[6]。不仅如此, 大量临床研究均显示, 胃癌患者围术期多会有营养不良状态存在, 而机体营养储备下降可致使机体对手术的耐受程度下降, 致使相关并发症发生的风险增大, 并延迟术后恢复[7-8]。因此, 近年来临床上选择通过手术对胃癌患者展开治疗时, 不断强调营养支持与护理干预, 通过实施科学化、全面化的护理干预, 并予以适当的营养支持, 可达到进一步提升手术安全性的效果, 并有效促进患者术后恢复。
早期肠内营养通过胃肠道为患者提供营养物质, 与人体生理状态更相符合, 肠道对营养成分进行吸收, 并为肠粘膜细胞提供营养, 对肠粘膜的屏障功能进行保护, 刺激消化液分泌、肠蠕动[9]。快速康复护理于围术期对患者实施具有循证证据的护理措施, 可有效促进患者术后早期康复[10]。本次研究将以上两种干预联用于胃癌手术患者中, 结果显示, 观察组术后7d时的PAB、ALB、TF水平比对照组高(P<0.05), 且观察组并发症发生率比对照组低(P<0.05), 提示予以胃癌手术患者早期肠内营养联合快速康复护理可有效改善患者术后营养状态, 并减少手术并发症。早期肠内营养直接将营养物质输入肠道, 肝脏通过门静脉系统吸收营养物质, 为肝脏蛋白合成提供营养需求, 使术后正氮平衡得以维持[11]。不仅如此, 肠内营养的营养液可对胃肠道产生良好的刺激作用, 使肠液、胆汁等消化液顺利恢复, 对机体消化吸收产生良好的促进作用, 改善机体营养状态[12]。快速康复护理术前的宣教可使患者认知水平提升、负性情绪改善, 正确对手术进行配合, 降低手术风险;营养支持可为机体提供营养供给, 促进手术耐受度提升;肠道准备、管道留置、术中保温护理措施可使手术对机体产生的创伤减轻;输液、镇痛护理可有效减少手术应激反应;早期进食与活动指导可促进患者术后尽早恢复。对胃癌患者实施早期肠内营养联合快速康复护理干预后, 患者机体营养需求得以满足, 为胃肠道提供充足的代谢底物, 使术后分解代谢得以满足, 对营养供需平衡进行维持, 预防肠粘膜功能屏障受损触发的免疫抑制、促炎联级反应, 从而达到减少手术并发症的效果。
肠道为人体最大黏膜免疫系统, 大量临床研究均指出, 肠内营养缺乏可致使肠粘膜萎缩, 使肠粘膜屏障功能受损, 改善肠粘膜屏障功能对促进术后康复有重要价值[13]。胃癌手术创伤较多, 且手术时间较长, 手术过程中患者机体处于高应激状态, 营养需求增加, 且胃肠道功能处于抑制状态[14]。本次研究中, 观察组术后7d时的DAO、D-LA水平比对照组低(P<0.05), 术后排气、胃管拔除、下床活动及住院时长均比对照组短(P<0.05), 提示早期肠内营养与快速康复护理干预联合应用于胃癌手术患者中可有效促进术后胃肠功能恢复。DAO存在于小肠黏膜上层绒毛细胞中, 小肠黏膜受损时, 大量释放入血。D-LA是肠道菌群发酵产物, 肠道菌群温度时处于动态平衡状态, 肠道受损时, 由创口进入血液。肠内营养直接向胃肠道对营养进行供给, 可对支配肠道运动的神经内分泌系统产生激活作用, 并促进器官血流量增加, 对肠粘膜细胞代谢提供支持, 使胃肠蠕动加快, 促进胃肠道功能恢复, 降低DAO、D-LA水平[15]。快速康复护理通过予以患者术前宣教、营养支持、肠道准备, 可使患者身心方面的手术耐受性提升, 导管留置、术中保温、输液与镇痛、早期进食与活动护理可有效减轻手术产生的创伤, 达到提升手术安全性的效果。对胃癌手术患者展开肠内营养、快速康复护理干预时, 可为患者提供充足的营养需求, 并降低手术应激反应, 减少相关手术并发症, 促进患者顺利完成术后康复, 从而使术后胃肠功能恢复时间缩短。
综上所述, 早期肠内营养、快速康复护理干预应用于胃癌患者中可有效改善其术后营养状态、减少手术并发症, 促进提升胃肠功能康复效果。但此次研究存在样本量仅为98例、仅观察至术后7d等不足, 研究结论客观性可能受此影响, 后续需展开进一步的大规模的研究, 以更为客观地分析早期肠内营养与快速康复护理干预联合应用于胃癌手术患者中的临床价值。

