甜菜碱类离子液体化学修饰猪胰脂肪酶提升其酶学性能
鲁泽平,裴新华,薛誉,张晓光,胡燚
(南京工业大学药学院,材料 化学工程国家重点实验室,江苏 南京 211816)
化学修饰具有价格低廉、实验所需时间短、操作便利等优点,是对脂肪酶进行分子改性的一种重要手段[1]。目前的修饰剂主要依赖于一些小分子(酸酐、脂肪酸等)和大分子(聚乙二醇、右旋糖酐、蔗糖聚合物等),且修饰后的脂肪酶的酶学性能提升并不显著,各项酶学性能也不能同时得到提升,不能够满足酶分子修饰多样性的需求[1-3]。例如,Liu等[4]分别利用柠檬酸酐、邻苯二甲酸酐和顺丁烯二酸酐对氯过氧化物酶进行化学修饰,修饰改性后的氯过氧化物酶的催化效率分别提高了7%~53%,然而修饰后的酶有机溶剂耐受性却发生了大幅度的降低。Jayawardena 等[5]利用苯甲酸酐对南极假丝酵母脂肪酶A(CALA)进行化学改性,修饰酶的热稳定性与储存稳定性得到了提升,但有机溶剂耐受性、选择性却发生了一定程度的降低。
离子液体是由阴阳两种离子组成,在室温下为一种液态的熔融状的盐。由于其可设计性与良好的理化性质,离子液体在化学合成、生物催化等多个领域中表现良好的适用性[6-7]。离子液体对酶非常友好,离子液体作为酶催化的反应介质时,酶催化反应的效率大大提高,反应的区域/对映体选择性也有所增加,当反应底物为高极性底物时,离子液体优越性更是十分明显[8-10]。在以离子液体为溶剂的酯交换和酯水解反应中,酶的活性和稳定性都有所提高,可能是因为离子液体对酶的活性构象起到了积极的作用[11-12]。故本文选择离子液体为修饰剂,以期更好地提高脂肪酶酶学性能。
甜菜碱作为代谢的次生产物,是非常重要的渗透调节物质,在生物化学领域应用较为广泛[13-14]。有文献报道,甜菜碱类离子液体可以作为反应介质参与一系列的化学反应。例如,Zhu 等[15]合成了一系列不同阴离子的甜菜碱离子液体,将其运用到Hantzsch反应的催化性能研究中,结果表明,在温和条件下,这些离子液体对一锅法制备吖啶二酮的Hantzsch反应具有较高的选择性,其中乳酸甜菜碱的催化活性最高。
本文作者课题组前期工作设计合成了多种离子液体用以修饰脂肪酶,展现出离子液体作为酶的新型修饰剂的优势[16-20]。例如,徐超等[16]用手性脯氨酸类离子液体化学修饰PPL,结果表明,经过[BMIM][N-AC-L-pro]修饰后的PPL展现出最佳的酶学性能,在酶活提高了1.0 倍的同时,热稳定性提高了2.6 倍(50℃,2.5h),对映体选择性提高了1.5 倍,在50%的二甲基亚砜中的稳定性提高了0.7倍,且在不同温度、pH下也展现出了较好的稳定性与耐受性。Jia 等[17]利用不同链长、不同阴阳离子的咪唑类离子液体对南极假丝酵母脂肪酶B(CALB)进行化学修饰。其中,[HOOCMMIm][Cl]修饰后的CALB 活性提高了1.5 倍,在70℃下保存2h的耐热性提高了7.0倍,在50%的二甲基甲酰胺中耐受性提高了0.8倍,在50%甲醇溶液中耐受性提高了5.0倍。
本文利用离子液体的可设计性,设计并合成不同链长、不同阴离子的甜菜碱离子液体对猪胰脂肪酶(PPL)进行修饰,考察不同链长与阴离子对脂肪酶的活性与稳定性的影响。预期得到能够同时提高PPL的各项酶学性能的甜菜碱类离子液体,并探索其酶学性能变化机制。
1 材料和方法
1.1 材料与仪器
试剂:PPL;三硝基苯磺酸(50g/L);BCA 试剂盒;33%二甲胺水溶液、氯代正丁烷、氯代正辛烷、氯代正十二烷、氯代正十六烷、十二水合磷酸氢二钠、二水合磷酸二氢钠、对硝基苯酚棕榈酸酯、对硝基苯酚、乙酸乙烯酯、N,N-羰二咪唑(CDI)、异丙醇、正己烷、丙酮、甲醇、二甲基亚砜(DMSO)皆为分析纯;阿拉伯树胶粉、牛血清蛋白、Triton-X100皆为生化试剂。
仪器:电子分析天平(BAS224S),北京赛多利斯仪器系统有限公司;透析袋(10kDa),南京圣比奥科技有限公司;振荡恒温/水浴锅(WS20),德国WIGGENS公司;pH计(PHS-3C),上海仪电科学仪器股份有限公司;微量移液器(10-1000µL),德国Eppendorf 公司;荧光分光光度计(F-7000),日本Hitachi 公司;圆二色谱仪(J-1500),JASCO;高 效 液 相 色 谱(UltiMate3000),Dionex;真空冷冻干燥机(SCIENTZ-12N),宁波新芝生物科技股份有限公司;全波长酶标仪(MD190),美谷分子仪器(上海)有限公司;低温高速离心机(TCL-16MS),上海卢湘仪离心机仪器有限公司。
1.2 甜菜碱离子液体的合成
将0.01mol 氯代正丁烷(氯代正辛烷、氯代十二烷、氯代十六烷)加入到过量的33%二甲胺水溶液中;冰浴条件下反应1h,然后在50~100℃下加热回流24h;冷却至室温,用蒸馏水重复洗三次,得到黄色油状液体;将氯乙酸和氢氧化钠按照摩尔比1∶1.2混合搅拌反应10min,然后将得到的氯乙酸钠与等摩尔的黄色油状液体在95℃条件下回流4h;得到的反应液用过量的浓盐酸处理,过滤收集滤渣;用乙醇、乙醚体积比为1∶10混合溶剂重结晶得到白色粉末状离子液体。其中将氯代十六烷基甜菜碱离子液体加入到丙酮溶液中,分别加入过量的磷酸二氢钠和氟硼酸钠,在室温条件下搅拌反应48h,反应液过滤除去沉淀,然后旋蒸除去丙酮溶液,得到H2PO4-和BF4-的十六烷基甜菜碱离子液体。
为了验证离子液体作为修饰剂的优越性,合成了十六烷基肌氨酸。将肌氨酸溶解在甲醇中,缓慢滴加二氯亚砜,得到油状肌氨酸甲酯。将肌氨酸甲酯与氯代十六烷加入到甲醇溶剂中,加入少量的三乙胺作为缚酸剂,加热回流12h,取反应液旋干除去甲醇溶剂,用乙酸乙酯萃取,取有机相旋干得粗品,用丙酮和石油醚混合溶剂重结晶得十六烷基肌氨酸纯品。
如图1所示,修饰剂结构由上往下依次为氯化丁基甜菜碱离子液体[BetaineC4][Cl]、氯化辛基甜菜碱离子液体[BetaineC8][Cl]、氯化十二烷基甜菜碱离子液体[BetaineC12][Cl]、氯化十六烷基甜菜碱离子液体[BetaineC16][Cl]、四氟硼酸根十六烷基甜菜碱离子液体[BetaineC16][BF4]、磷酸二氢根十六烷基甜菜碱离子液体[BetaineC16][H2PO4]、十六烷基肌氨酸Sarcosine。

图1 修饰剂结构
1.3 脂肪酶纯化与化学修饰
(1)纯化 取25mL PPL酶液粗品,在4℃环境下离心20min,转速8000r/min,去除沉淀,取上清液于透析袋中,在冰浴条件下透析除盐24h,中途每隔6h 换一次水,得到纯化后的酶,置于冰箱中4℃条件下保存待用。
(2)化学修饰 称取1mmol合成的甜菜碱类离子液体,加入等摩尔的羰基二咪唑(CDI),在2mL的无水二甲基亚砜的作用下磁力搅拌,室温反应2h 后停止,反应完毕之后取400µL 的修饰剂加入到20mL 的酶液中,在冰浴条件下继续磁力搅拌8h,修饰后的酶装入10kDa的透析袋中,冰浴条件下透析24h,中途每隔6h换一次水,最后得到7种修饰酶,给修饰后的PPL 以如下方式进行命名:[BetaineC4] [Cl] 修 饰 的 酶[BetaineC4] [Cl] -PPL,[BetaineC8] [Cl] 修 饰 的 酶[BetaineC8] [Cl] -PPL,[BetaineC12] [Cl] 修 饰 的 酶[BetaineC12] [Cl] -PPL,[BetaineC16] [Cl] 修 饰 的 酶[BetaineC16] [Cl] -PPL,[BetaineC16][BF4]修饰的酶[BetaineC16][BF4]-PPL,[BetaineC16][H2PO4]修饰的酶[BetaineC16][H2PO4]-PPL, 十六烷基肌氨酸(Sarcosine) 修饰的酶SarcosineC16-PPL。
1.4 蛋白浓度、修饰度以及酶活测定
采用BCA 法测定蛋白浓度。配制不同浓度的牛血清蛋白(BSA)溶液,测定其在562nm 下的吸光值,绘制标准曲线,进而测定酶液中的蛋白浓度。
采用三硝基苯磺酸(TNBS)法测定修饰度。TNBS 可以与未被修饰的赖氨酸反应生成在304nm有特定光吸收的产物,通过测定该波长下的吸光度进而计算出修饰度。
采用对硝基苯酚法测定酶活。脂肪酶可以催化对硝基苯酚棕榈酸酯(p-NPP)水解生成在410nm有特定光吸收的对硝基苯酚(p-NP),通过测定该波长下的吸光度进而计算出酶活。以单位时间内催化水解底物对硝基苯棕榈酸酯产生1µmol对硝基苯酚所需的酶量为一个酶活单位(U)。
1.5 酶学性能测试
(1)最适pH测定 在各自37℃下,设置不同pH梯度的底物溶液6.0、6.5、7.0、7.5、8.0,将稀释后的酶溶液预热5min后,取0.1mL加入到底物溶液反应10min,反应结束加入灭活剂(V乙醇∶V丙酮=1∶1),分别测定原酶与修饰酶酶活。
(2)最适温度测定 在各自最适pH 下,设置不同的温度梯度30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃,将稀释后的酶溶液预热5min 后,取0.1mL 加入到底物溶液反应10min,反应结束加入灭活剂(V乙醇∶V丙酮=1∶1),分别测定原酶与修饰酶酶活。
(3)热稳定性测定 将原酶与修饰酶分别保温在60℃中,每隔10min 取出10µL 样品在各自最适宜的条件下测其酶活。
(4)有机溶剂耐受性测定 将原酶与修饰酶分别在室温下保存在含0~50%的二甲基亚砜中2h,样品取出后在各自最适宜的条件下测试其酶活。
(5)酶动力学测定 将游离酶与修饰酶加入到9~30mg/mL的三乙酸甘油酯中,在各自最适宜的反应温度和pH下反应3min,测定反应的初速度,用Lineweaver-Burk 法求出PPL 的米氏常数(Km)和最大反应速度(Vmax)。
(6)对映体选择性测定 如图2所示,以α-苯乙醇转酯化拆分反应作为反应模型,研究修饰前后PPL催化该反应的对映体选择性变化。将原酶与修饰酶用冷冻干燥机冻干,制成酶粉,称取0.1g的酶粉置于50mL 的离心管中,加入10mL 正己烷溶液、0.05mol 苯乙醇和0.1mol 乙酸乙烯酯。放入水浴摇床中,在37℃、150r/min的条件下反应3h。反应结束,利用高效液相色谱进行测定计算转化率、对映体过剩值ee值、对映体选择率E值等,计算如式(1)~式(6)。
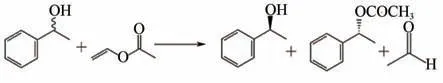
图2 酶促(R,S)-α-苯乙醇转酯化反应

由于底物中(S)-α-苯乙醇参与反应量较小,因此底物ee值采用eeS来表示,而产物以(R)-乙酸苯乙酯为主,产物的ee值以eeR表示。
1.6 光谱结构表征
(1)荧光光谱 室温下,将原酶和修饰酶分别稀释到浓度为100µg/mL,取3mL 酶液进行测定。测定条件为激发波长为295nm,激发和发射光栅均为5nm,扫面范围280~400nm,在荧光分光光度计F-7000 FL Spectrophotometer上测量。
(2)圆二色谱 室温下,取浓度为100µg/mL的酶液置于圆二色谱仪中测定。测定条件为样品池光程为1cm,扫描波长范围为190~260nm,扫描速度为50nm/min,以溶剂(去离子水)作为空白组自动矫正基线, 在圆二色谱仪JASCOJ810 Spectropolarimeter (Jasco Co., Japan)上测定,使用CDpro软件对数据进行分析,计算出二级结构的含量变化。
2 结果与讨论
2.1 原酶与修饰酶活性变化
2.1.1 pH对酶活的影响
测定不同pH 下原酶与修饰酶酶活的变化。如图3 所示,原酶与修饰酶的最适pH 并没有发生变化,而修饰酶在不同pH 下酶活均有了不同程度的提升,其中[BetaineC16][H2PO4]-PPL 酶活提升最明显。Hofmeister 效应将离子分为K 型和C 型,kosmotropic离子具有较高的表面电荷和较强的水合能力[21-23]。将阴离子按照K 型由高到低排序为H2PO4->Cl->BF4-,据报道,当离子液体的阳离子相同时,阴离子更加K 型,修饰酶酶活提升更为明显[24],这与实验结果一致。此外,随着离子液体中烷基链长的增加,修饰酶对pH 的敏感性降低,可能是因为较长的烷烃链可以更好地保护酶活性中心,使之能够适应较宽的pH 范围。这与徐超等[16]利用手性脯氨酸类离子液体修饰PPL的修饰效果不同,经过[BMIM][N-AC-pro]修饰后的PPL 最适pH在6.5,而通过[N-AC-pro][Cl]修饰后的PPL最适pH提高到7.5。

图3 原酶与修饰酶在不同pH下的酶活
2.1.2 温度对酶活的影响
在pH为7.0条件下,测定不同温度下原酶与修饰酶的酶活。如图4所示,在不同温度下,修饰酶酶活较原酶均有不同程度的提升。其中,[BetaineC16][H2PO4]-PPL 酶活提升最为明显,这与不同阴离子对酶的修饰效果差异相符合。40℃之前,原酶与修饰酶没有明显的差异;40℃之后,修饰酶酶活明显升高,可能是因为在较低温度时酶的活性中心不能被完全打开,影响了酶的催化活性。原酶达到最适温度45℃之后,酶活随着温度的升高而降低,并且60℃之后酶几乎失活,修饰酶达到最适温度50℃之后,仍能够保持较高的酶活,65℃之后酶活才发生明显降低,可见修饰酶表现出更好的温度耐受性。这可能与烷基化甜菜碱离子液体长链疏水结构有关,同时较长的烷烃链可以有效增强酶的刚性结构[25-26],两者共同增强了修饰酶对温度的耐受性。

图4 原酶与修饰酶在不同温度下的酶活
2.1.3 修饰度与酶活变化
在原酶与修饰酶各自的最适温度与pH 下,测定其酶活。PPL上可供修饰的赖氨酸残基有22个,且分布比较密集。如表1所示,不同链长的甜菜碱离子液体对PPL的修饰度有明显的差异,随着链长的增加,修饰度逐渐降低。可能是因为空间位阻较大的修饰剂在某种程度上会影响酶蛋白的修饰度[21],因此经[BetaineC16]修饰过的PPL 具有最低的修饰度。此外,修饰度的降低并没有影响到酶活,随着链长的增加,修饰酶酶活也随之增大,[BetaineC16][Cl]-PPL 酶活提升了2.34 倍;经过阴离子交换后,[BetaineC16][H2PO4]-PPL 酶活提升了2.44倍。此外,经十六烷基肌氨酸修饰过的PPL酶活较原酶也有所提升,但是提升效果相比于离子液体并不明显,由此也证明了酶分子改造中离子液体作为修饰剂的优越性。

表1 原酶与修饰酶的修饰度与酶活
2.2 原酶与修饰酶稳定性变化
2.2.1 热稳定性变化
热稳定性是酶在工业应用中的关键因素。如图5 所示,原酶在60℃下保存30min 后酶活几乎丧失,而经[BetaineC16]修饰的PPL 在60℃下保存45min 后仍能够保留40%左右的酶活。结果表明,较长侧链甜菜碱离子液体的引入可以让酶具有较好的热稳定性,可能因为链长越长,甜菜碱离子液体的分子量越大,共价连接到酶分子上后可以稳定酶的整体构象,减少了酶分子在高温环境中的热振动,同时较长的侧链增加了位阻,增强了酶分子的刚性结构,能够更好地保护酶活性中心,避免遭到高温的破坏[27-28]。
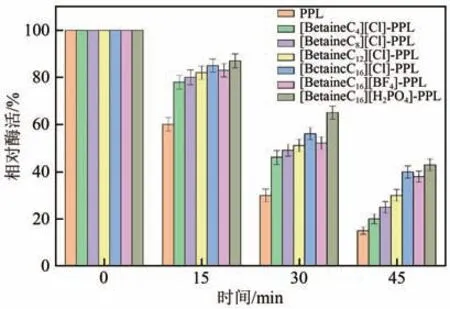
图5 原酶与修饰酶在60℃下的热稳定性
2.2.2 有机溶剂耐受性变化
酶的溶剂稳定性一直是近年来的研究热点,提高脂肪酶对有机溶剂的耐受性可以有效拓宽脂肪酶在实际环境中的应用范围。如图6 所示,原酶在10%的强极性非质子溶剂DMSO中酶活就出现了降低,在50%的DMSO中,原酶的酶活仅为初始酶活的18%。而修饰后的PPL在低浓度的DMSO中出现了不同程度的激活作用,当DMSO 质量分数超过20%之后,酶活缓慢降低,当DMSO的质量分数为50%的时候,修饰酶仍能够保持较高的酶活,其中[BetaineC16][H2PO4]-PPL 修饰酶仍能够保持初始酶活的50%。这可能因为较长的疏水链能够更好地保护酶的活性中心,让其很难暴露在有机溶剂中,进而降低有机溶剂对酶的影响。
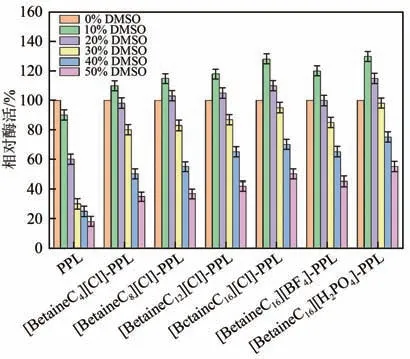
图6 原酶与修饰酶在不同浓度的DMSO中的耐受性
2.3 原酶与修饰酶的酶动力学参数
Doumèche 等[21,29]采用含羟基的咪唑、吡咯等离子液体修饰甲酸脱氢酶,修饰后的甲酸脱氢酶在水溶性[MMIm][Me2PO4]体系中的Km值降低,酶的催化性能提升了2.29~10.21倍。本文作者课题组前期的研究中利用咪唑、胆碱类离子液体化学修饰PPL,修饰后PPL 的Km发生了改变, 其中经过[HOOCBMIm][Cl]和[HOOCBMIm][H2PO4]修饰后PPL的Km值发生降低[18]。动力学测试结果如表2 所示,所有修饰酶的Km都比原酶低,并且随着链长的增加,Km值越来越小。总体来说,[BetaineC16][Cl]-PPL 的底物亲和力高于原酶,且优于其他修饰酶,这可能是因为较长的柔性脂肪长链增加了其脂溶性,让酶更容易与底物结合,并加快反应速度;也可能是因为长链烷基化甜菜碱离子液体具有较强的疏水性,它的引入改变了活性中心附近的疏水环境,使底物与活性中心的亲和力增加。此外,长链烷基化甜菜碱离子液体的引入增加了酶蛋白的刚性结构,使得修饰酶较大程度上保持了PPL 的活性构象[30]。

表2 原酶与修饰酶的动力学参数
2.4 原酶与修饰酶对映体选择性变化
通过α-苯乙醇的转酯化反应,考察了原酶与修饰酶的对映体选择性的变化。表3 中数据显示,所有修饰酶的总体转化率和选择率都比原酶的要高,其中,随着甜菜碱离子液体的侧链链长的增加,催化活性和对映体选择性提升越明显,[BetaineC16][H2PO4]-PPL的选择率E为16.3,是原酶选择率的3.0 倍。总体转化率的大幅提升可能是因为较长的烷烃链具有较强的脂溶性,能够使酶蛋白更好地与底物结合,从而更好地发挥催化活性;此外,较长的烷烃链具有更强的疏水作用,修饰酶的刚性结构得到增强的同时能够稳定酶蛋白盖子结构打开状态,使得底物能够更好地进入到酶活性中心,从而提升修饰酶的选择性[28]。

表3 原酶与修饰酶催化的(R,S)-1-乙酸苯乙酯的对映体选择性水解
2.5 原酶与修饰酶光谱学结构表征
2.5.1 荧光光谱
荧光光谱的灵敏度较高,能够反应酶蛋白某些荧光基团附近环境的变化,因此被广泛应用于生化领域的研究中[31]。如图7所示,修饰前后酶的最大吸收波长并没有发生改变,而修饰酶的荧光强度较原酶荧光强度降低,并且修饰度越高的PPL荧光强度降低得越多,可能是某些具有荧光特性基团附近的赖氨酸被离子液体修饰,从而对荧光基团附近微环境产生了影响。此外还发现,不同阴离子的甜菜碱离子液体修饰的PPL荧光强度变化差异不大。
2.5.2 圆二色谱
利用圆二色谱对原酶与修饰酶二级结构变化进行测定。如表4所示,修饰后PPL的α-螺旋含量明显降低,而β-折叠含量有所上升,且随着链长的增加,α-螺旋与β-折叠变化程度也在增大。α-螺旋含量的降低可能是因为离子液体的引入促进了PPL盖子结构的打开,使底物更好地与酶的活性中心结合,这也解释了酶活提升的原因;β-折叠含量上升可能是因为离子液体的引入,增加了酶蛋白表面的刚性结构,这与修饰酶热稳定性和有机溶剂耐受性等稳定性酶学性能变化规律一致[32-34]。
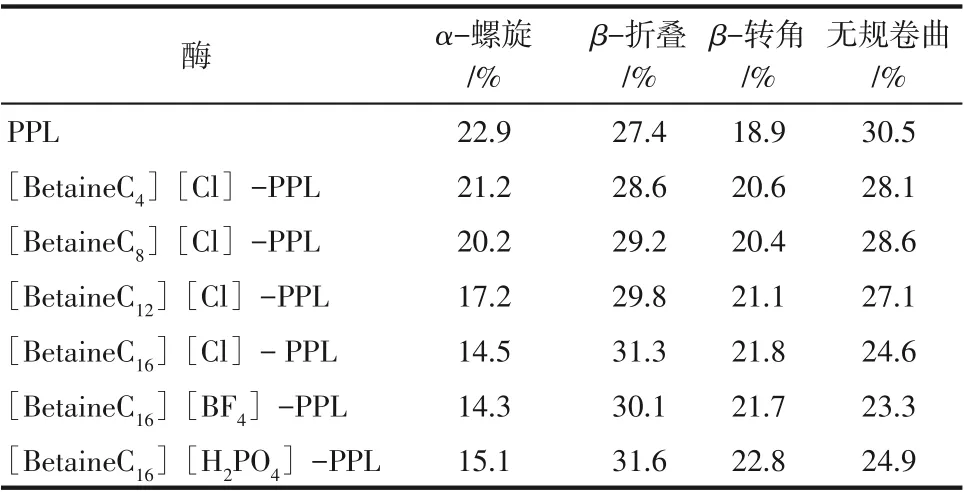
表4 原酶与修饰酶的二级结构含量
3 结论
用设计合成的不同链长与阴离子的甜菜碱离子液体对PPL进行化学修饰,修饰酶的酶活、热稳定性、有机溶剂耐受性、对映体选择性等酶学性能同时得到了不同程度的提升。不同链长的甜菜碱离子液体的修饰度不同,链长越长,修饰度越低。酶活测定结果显示,修饰酶的酶活随着修饰剂侧链长度的增加而增大,且修饰度的差异给酶活带来的影响并不明显。原酶与修饰酶的动力学参数表明,所有修饰酶的Km比原酶低,且链长越长的离子液体修饰的PPL与底物的亲和力越好,可能是因为甜菜碱离子液体的引入使得脂肪酶活性中心上的盖子结构更容易打开,从而表现出较高的活性。通过α-苯乙醇转酯化反应发现,[BetaineC16][H2PO4]-PPL 的选择性提高最为明显,是原酶的3.0 倍。光谱学结构表征表明甜菜碱类离子液体的引入导致了PPL的构象发生了变化,α-螺旋含量的降低与β-折叠含量上升使修饰后的PPL具有更高的酶活与更稳定的构象,初步解释了酶活和稳定性变化的原因。
符号说明
A,AR,AS —— 总初始底物浓度、R-初始底物浓度、S-初始底物浓度
B,BR,BS —— 总底物剩余浓度、R-底物剩余浓度、S-底物剩余浓度
C总,CR,CS —— 总转化率、(R)-α-苯乙醇的转化率、(S)-α-苯乙醇的转化率
eeR,eeS ——R-对映体过剩值、S-对映体过剩值
E—— 对映体选择率
Km —— 酶反应速度达到最大反应速度一半时底物浓度的大小
R,S——R-对映体、S-对映体
Vmax —— 最大反应速率
——中核工程创新驱动改革,奋力打造核工程产业链“链长”

