响应面法优化Mn-Ce/HZSM-5催化氧化三氯乙烯
常甜,王宇,赵作桐,胡锦超,沈振兴
(1 陕西科技大学环境科学与工程学院,陕西 西安 710021;2 西安交通大学能源与动力工程学院,陕西西安 710049;3 省部共建煤炭高效利用与绿色化工国家重点实验室(宁夏大学),宁夏 银川 750021;4 中国科学院地球环境研究所黄土与第四纪地质国家重点实验室,陕西 西安 710049)
三氯乙烯(trichloroethylene,TCE)是含氯挥发性有机化合物(chlorinated volatile organic compounds,CVOCs)的典型代表,作为一种优良溶剂,常被应用于金属脱脂剂和衣服干洗剂等[1-2]。TCE对人体具有致癌性且严重污染生态环境,因此其排放控制迫在眉睫[3-4]。CVOCs 治理技术分为回收技术和销毁技术,回收技术主要包括吸附、吸收、冷凝和膜分离等,销毁技术主要有热焚烧、生物降解、催化氧化、低温等离子体和光催化等[5],其中吸附、吸收因吸附容量小、再生性差等问题,不适用于工业中大规模CVOCs 的去除。热焚烧是减少工业过程中CVOCs 排放的常规方法,然而该法需要高温条件且易形成多氯芳香族化合物造成二次污染[6]。生物降解法不适用于去除复杂的CVOCs 气体,且去除效果受环境影响较大。低温等离子体技术因放电不稳定、易产生副产物等弊端不易实现工业化应用。相较于上述处理技术,催化氧化法具有高效、能耗低和副产物少等优点[7-8],是最有发展前景的CVOCs污染控制技术。
目前,设计合成高效稳定的催化剂,以实现CVOCs 的有效去除仍是亟待解决的问题[4]。CVOCs催化燃烧的研究大多集中于三类催化剂,即贵金属催化剂、固体酸催化剂和过渡金属氧化物催化剂[9]。金属催化剂在CVOCs去除方面表现出高催化活性,但容易因氯中毒而失活。固体酸催化剂(如分子筛)可作为CVOCs 减排的替代催化剂,但是会产生多氯化合物等副产物,且催化活性相对较低,因此其应用受限。将过渡金属氧化物与分子筛相结合可以为上述问题提供崭新的解决思路[10-11]。在过去的几十年中,锰基催化剂作为一种环境友好型材料,因独特的物理化学性质被用于CVOCs 的高效去除[12-13]。铈基催化剂由于其特殊的氧化还原性和高储氧能力备受人们关注[14]。分子筛因高比表面积和稳定性被广泛用于CVOC 治理[15]。中国科学院兰州化学物理研究所唐志诚团队[16-17]在Ru/MnCe基催化氧化CVOCs 方面开展了诸多研究工作,发现Mn-Ce 形貌、结构对二氯苯催化燃烧活性具有重要影响。中国科学院城市环境研究所贾宏鹏团队[18]通过调控Mn-Ce催化剂的制备方法提高锰铈间相互作用,发现Mn-Ce 催化剂在氯苯等CVOCs 的催化燃烧方面表现出优异的性能。然而,目前针对CVOCs 的催化剂稳定性较差,不利于催化剂的进一步实际应用。
此外,由于催化剂的反应活性易受各种工艺参数如流量、反应温度和相对湿度(relative humidity,RH)等的影响,探究多种关键因素对CVOC 催化氧化过程的影响规律对于提高CVOCs 去除率至关重要,有助于加深对CVOCs 催化氧化反应过程的认识。响应面法(response surface methodology,RSM)是一种基于实验设计(DoE)研究多个输入变量和输出响应之间非线性关系的统计方法,可以模拟、优化和预测复杂系统的反应性能以及评估输入变量的显著性和不同输入变量之间的相关性[19]。RSM 广泛应用于生物、化工、医药、食品和环境等领域,在催化氧化法处理环境问题的研究中,有学者[20-21]通过RSM对催化氧化废水以及环己酮、苯及苯系物等废气的工艺条件进行优化,以期寻找最佳操作点,也有学者[22-23]基于RSM设计和优化催化剂的合成条件,以期提高催化剂的催化活性,进而提高降解效率。目前,对于CVOCs 催化氧化过程中的影响因素探究多使用单因素实验法,比较费时费力。RSM 为探究不同因素对催化氧化过程的影响规律提供了一种有效手段。
本文首先制备了一系列高效稳定的Mn-Ce/HZSM-5催化剂,通过催化剂表征分析催化剂理化性质与催化氧化TCE 活性之间的关系。然后采用响应面法研究不同工艺参数(气体流量、温度和RH)及各因素之间的交互作用对TCE 催化氧化的影响规律,并以TCE去除率和CO2选择性为响应目标对TCE 催化氧化过程进行优化。最后,探讨了TCE催化氧化的反应机制。本研究结果有助于推动含氯挥发性有机物催化氧化去除技术的发展。
1 实验材料和方法
1.1 催化剂制备与表征
1.1.1 制备
本文采用沉积-沉淀法制备Mn-Ce/HZSM-5 催化剂。首先将不同摩尔比的硝酸锰和硝酸铈溶于去离子水中并搅拌至溶解。然后,将HZSM-5加入到上述溶液中得到混合物。随后将高锰酸钾加入到上述混合溶液中并不断搅拌,再向其中逐滴加入碳酸钠。之后,将所得溶液在60℃水浴中搅拌4h,多次水洗、过滤后置于70℃下干燥过夜,在500℃下煅烧3h得到Mn-Ce/HZSM-5催化剂,过筛至40~60目备用。所得催化剂中锰质量分数固定为5%,记作MnCex,其中x指Ce/Mn 摩尔比。同样地,用上述方法制得MnOx/HZSM-5和CeO2/HZSM-5催化剂,分别记作MnOx和CeO2。
1.1.2 表征
X 射线衍射(XRD)分析采用荷兰PANalytical X’pert 型X 射线衍射仪,使用Cu-Kα辐射源(λ=1.5406Å,1Å=0.1nm),扫描范围2θ为10°~80°,扫描速率为4°/min。电感耦合等离子体发射光谱(ICP)分析采用日本岛津Shimadzu E 9000 型电感耦合等离子体发射光谱仪,定量分析催化剂的元素含量。N2物理吸附-脱附测试采用北京彼奥德电子技术有限公司SSA-4200 分析仪,在77K 下测定得出催化剂的比表面积、总孔容和平均孔径。测试前,将所有样品在300℃下抽真空预处理6h。扫描电子显微镜(SEM)分析采用德国Gemini 500型扫描电镜,得出催化剂的表面形貌特征。氢气程序升温还原(H2-TPR)采用美国Micromeritics AutoChem 2910型化学吸附仪。通过H2-TPR分析测定催化剂的氧化还原性,将0.05g 催化剂在300℃的高纯Ar流中进行预处理,保持1h 后冷却至60℃。然后以10℃/min 通入6% H2/Ar,从50℃加热至800℃进行测定。X 射线光电子能谱(XPS)分析采用美国赛默飞世尔科技公司EscaLab XI+型X 射线光电子能谱仪,以C1s 的结合能(284.8eV)为校准结合能,测得催化剂中元素种类及价态、组分半定量分析以及组分间相互作用等。
1.2 催化剂活性测试
图1为本研究的实验装置图,采用内径20mm、长100mm 的管式固定床催化反应器,为了防止局部温度过高,内部填充混合均匀的催化剂(0.1g)和碳化硅(1g),在大气压下测定催化剂的催化性能。通过温控炉以5℃/min 的升温速率从室温升至500℃。TCE初始浓度设定为1.76g/m3,通过将纯净空气通入液体TCE(置于冰水浴中)鼓泡产生。总流量由质量流量控制器(EL-flow,Bronkhorst,Netherlands)调控并设定为0.2~1L/min。测试前对催化剂进行预处理,在纯净空气流中对催化剂进行加热,以10℃/min 从室温加热至200℃,以去除杂质。通过傅里叶红外光谱仪(FTIR,Vertex 70,Bruker,Germany)分析气体成分,光程为20cm,分辨率为4cm-1,在稳定条件下测定10 次取平均值。
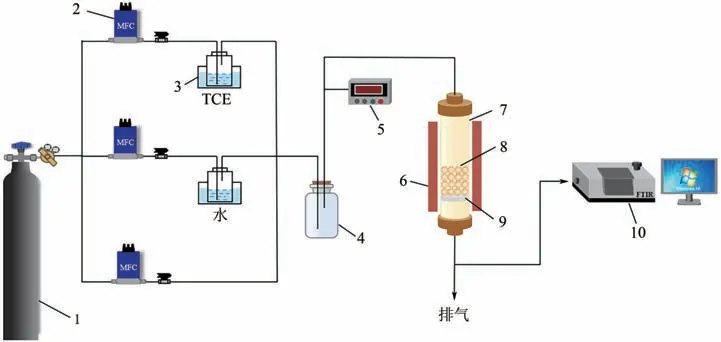
图1 实验装置示意图
TCE 去除率(ηTCE)和CO2选择性(SCO2)通过式(1)和式(2)计算。
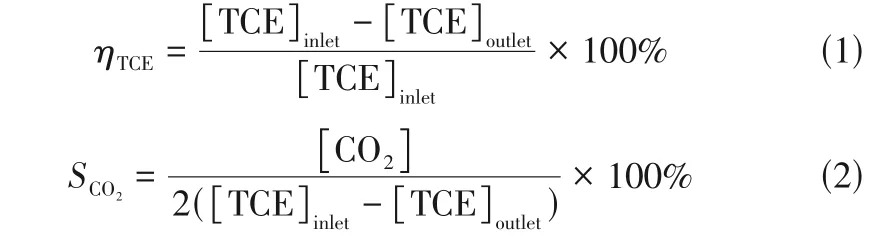
式中,[TCE]inlet和[TCE]outlet分别表示反应器入口和出口的TCE浓度,g/m3;[CO2]表示反应中生成的CO2浓度,g/m3。
1.3 响应面分析
运用Design-Expert 软件对TCE 催化氧化过程进行实验设计。采用三因素五水平的中心复合设计(CCD)实验方案,中心点试验重复6 次,总共需20 次试验。CCD 矩阵设计旨在评估三个自变量[温度(X1)、气体流量(X2)和RH(X3)]对TCE去除率(Y1)和CO2选择性(Y2)的影响。自变量编码值及实际值如表1所示。采用二次多项式方程拟合模型如式(3)。

表1 CCD分析的自变量和水平

在上述方程中,Y是预测响应值;k是变量数;ε是残差值;β0是常数;βi是线性系数;βii是二次系数;βij是交互系数;Xi和Xj是自变量,方差分析(ANOVA)用于评估模型的准确性,决定系数(R2)、校 正 决 定 系 数(RAdj·2)、预 测 决 定 系 数(RPre·2)、F值、p值和失拟项用于评估回归模型和各因素的统计显著性和拟合度,绝对精度用于评估回归模型的信噪比,变异系数(C.V.)用于评估回归模型的再现性。
2 结果与讨论
2.1 催化剂活性评价
Mn-Ce/HZSM-5 催化剂对TCE 分解的催化性能结果如图2 所示。气体流量和RH 分别固定为0.5L/min 和0。Mn-Ce/HZSM-5 催化剂的反应活性优于MnOx/HZSM-5 和CeO2/HZSM-5,且随着Ce/Mn摩尔比从0.4增至1.2,催化剂反应活性呈先增后减的趋势,Ce/Mn摩尔比为0.8时,催化剂活性最好,这表明催化剂组分是影响催化氧化TCE 性能的重要因素之一。500℃时,MnCe0.8催化性对TCE 去除率最高为97.6%,CO2选择性高达96.7%。

图2 不同催化剂催化氧化TCE随温度变化图
2.2 催化剂表征与分析
2.2.1 Mn-Ce/HZSM-5孔道、晶体结构及形貌
图3(a)是不同负载量Mn-Ce/HZSM-5 催化剂的XRD谱图,从图3(a)中可以看出所有样品均能检测到HZSM-5(JCPDS 79-2401)的衍射峰,说明负载Mn 和Ce 后,HZSM-5 载体的结构保持不变。如图3(b)所示,相比于HZSM-5 样品,CeO2/HZSM-5样品位于47.4°的衍射峰强度增强,通过与标准CeO2(PDF-34-0394)比对,表明该样品中存在CeO2纳米颗粒。另外,在所有Mn-Ce/HZSM-5 催化剂的XRD 谱图中并未发现MnOx和CeO2的衍射峰,说明MnOx和CeO2纳米粒子均匀地分散在HZSM-5载体表面。MnCe0.8/HZSM-5催化剂的电子能谱分析[EDX,图4(e)]也表明Mn和Ce在HZSM-5载体表面分散均匀。相比于MnOx/HZSM-5和CeO2/HZSM-5,所有Mn-Ce/HZSM-5 催化剂的峰强度均减弱,这说明Mn和Ce在催化剂上可能存在相互作用。正如文献中所报道,Mn和Ce之间的相互作用可以增强活性组分分散度并抑制结晶[24-25]。
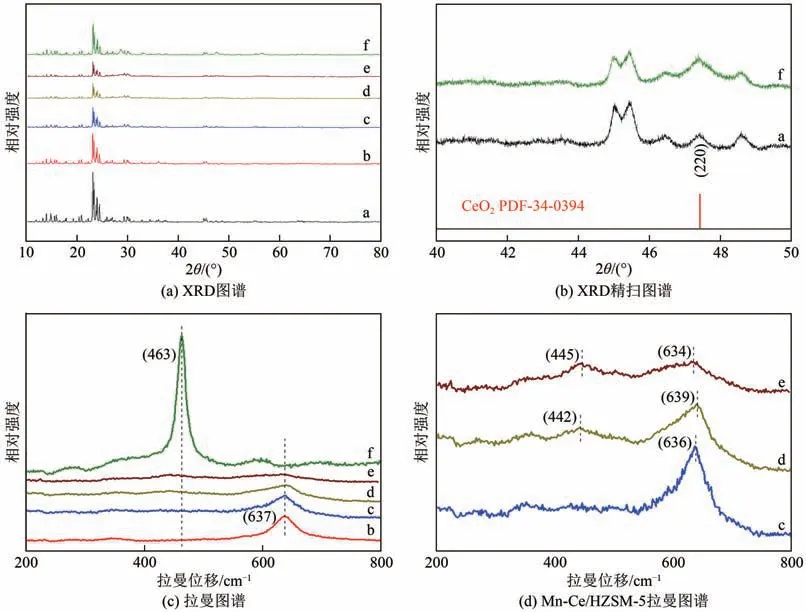
图3 Mn-Ce/HZSM-5的XRD和拉曼图谱
通过拉曼分析可以进一步测定催化剂晶体结构,图3(c)和(d)为催化剂的拉曼光谱图。由图3(c)可以看出,CeO2/HZSM-5谱图中主峰位于463cm-1,归属于CeO2立方萤石结构的对称伸缩振动特征峰(F2g)[26]。在MnOx/HZSM-5 谱 图 中 发 现 一 个 以637cm-1为中心的峰,对应MnO6八面体的Mn—O键[27]。相比于CeO2/HZSM-5,随着Mn含量的增加,Mn-Ce/HZSM-5 的F2g峰强度逐渐降低直至消失,且向低波数方向偏移且峰形宽化,这可能是由于Mn 取代Ce4+生成了固溶体,导致催化剂晶格变形并形成表面氧空位,这一现象进一步证实了Mn和Ce 之间存在相互作用[27]。相比于MnOx/HZSM-5,MnCe0.4和MnCe1.2的Mn—O 键峰向低波数偏移,这可能由氧空位形成和锰氧化物结构变形导致[28]。而MnCe0.8的Mn—O 键峰略微向高波数段偏移,文献表明这可能与晶粒尺寸变化相关,是由于声子限制效应引起的[29-30]。
图4为催化剂的SEM和TEM图像。从图4中可以观察到,与HZSM-5 相比,由于MnOx和CeO2颗粒的聚集,导致负载Mn和Ce后HZSM-5载体表面相对粗糙,但基本保留了HZSM-5的整体形态。从高分辨率透射电镜(HRTEM)图像[图4(d)]得出,在Mn-Ce/HZSM-5 中晶格间距分别为0.271nm、0.309nm 和0.312nm,分别对应于Mn2O3(JCPDS41-1442) 的(222)晶 面、MnO2(JCPDS 44-141) 的(310)晶面和CeO2(PDF-34-0394)的(111)晶面。
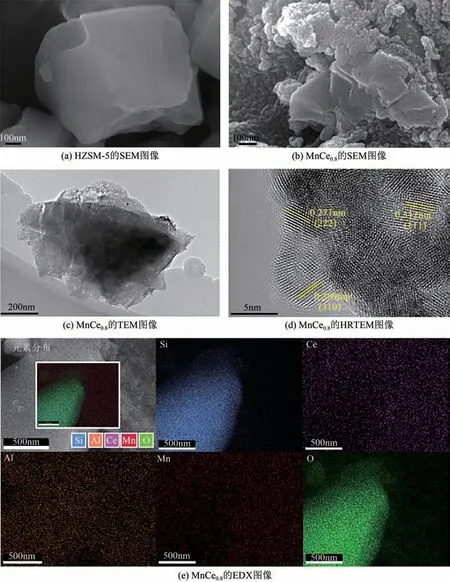
图4 不同催化剂的SEM、TEM、HRTEM和EDX图像
表2列出了不同负载量Mn-Ce/HZSM-5催化剂的理化性质,从表2 中可以得出,与HZSM-5 相比,Mn和Ce的添加降低了其比表面积,并增大了平均孔径。与MnOx/HZSM-5 相比,Ce 的加入使得催化剂的平均比表面积、总孔容和平均孔径略有减小。MnOx的最大比表面积为252.50m2/g,总孔容为0.26cm3/g,平均孔径为4.20nm。随着Ce的加入,催化剂平均比表面积从252.50m2/g减小到211.66m2/g,这说明Mn 或Ce 的氧化物堵塞了部分孔道结构[31]。另外,ICP 结果表明催化剂中实际Ce/Mn 值接近于理论计算值,与理论值偏差在2.5%之内。
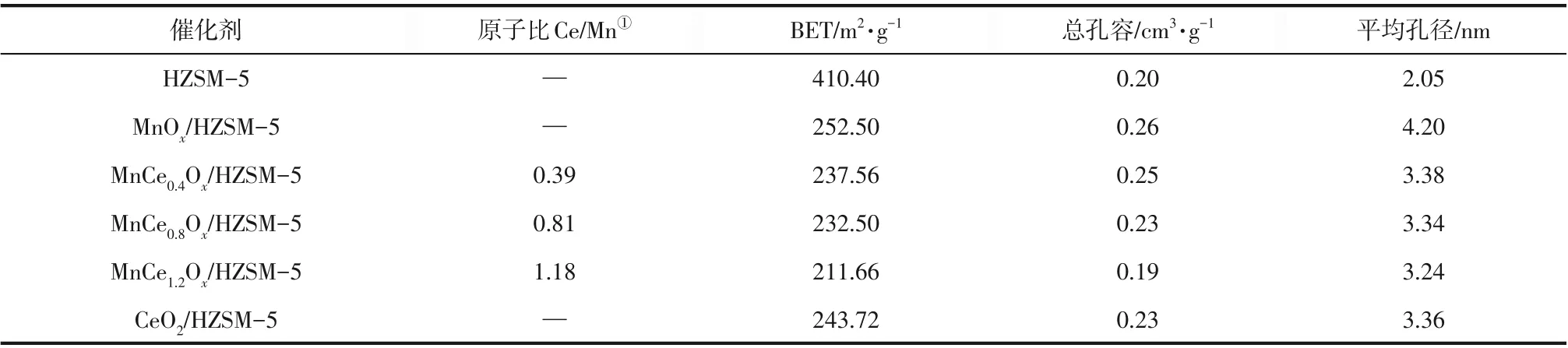
表2 Mn-Ce/HZSM-5的理化性质
2.2.2 XPS分析
图5(a)~(c)为Mn-Ce/HZSM-5 催化剂的XPS 谱图。由图5可以观察到,在Mn 2p XPS谱图[图5(a)]中有两个位于635~647eV 和648~660eV 的特征峰,分别归属于Mn 2p3/2和Mn 2p1/2。Mn 2p3/2在640.9eV、642.1eV 和643.7eV 处的三个特征峰分别对应Mn2+、Mn3+和Mn4+[31]。根据峰面积计算Mn-Ce/HZSM-5 催化剂表面元素不同价态相对含量,结果如表3 所示。相比于其他催化剂,MnCe0.8中Mn4+相对含量最高。据报道,高价态的锰氧化物有利于挥发性有机化合物的氧化[32]。Ce 3d XPS 谱图[图5(b)]检测出十个特征峰分别为:v0(880.9eV)、v1(882.8eV)、v2(884.9eV)、 v3(888.2eV)、 v4(898eV)、u0(899eV)、 u1(900.9eV)、 u2(903.5eV)、u3(907.36eV) 和u4(916.6eV)。根据早前的研究[33],分别用u和v表示Ce 3d5/2和Ce 3d3/2的特征峰,v0、v2、u0和u2峰归属于Ce3+,v1、v3、v4、u1、u3和u4归属于Ce4+。
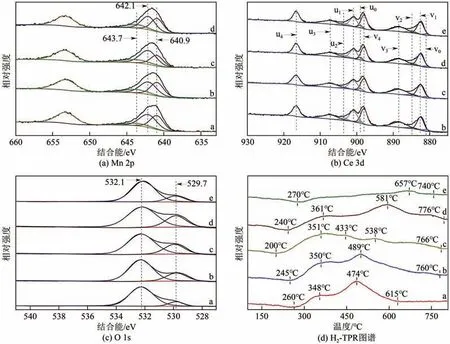
图5 Mn-Ce/HZSM-5的XPS谱图和H2-TPR图谱
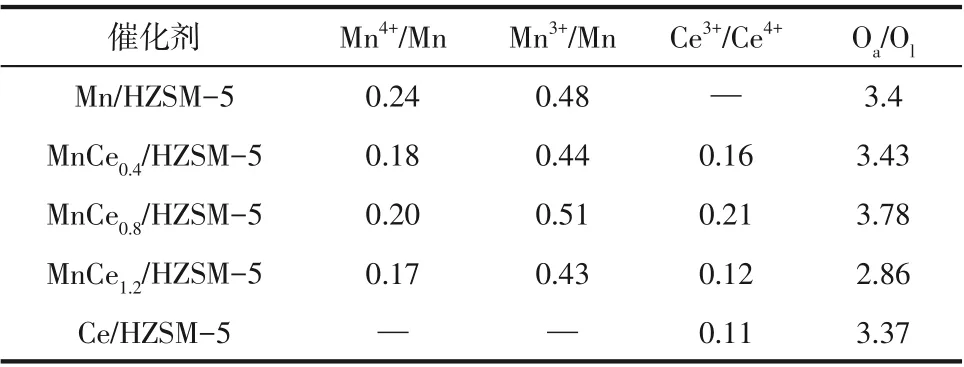
表3 Mn-Ce/HZSM-5的XPS结果
从O 1s XPS 谱图[图5(c)]中可看出,O 1s 光谱在529.7eV 和532.1eV 处出现两个特征峰,前者归属于晶格氧(Ol),后者归属于吸附氧(Oa)[31]。从表3 可知,Oa/Ol比值按照MnCe0.8>MnCe0.4>MnCe1.2>CeO2>MnOx的顺序依次降低。众所周知,催化剂表面吸附氧有助于提高氧迁移率,在VOCs氧化反应中起重要作用[34]。因此,TCE氧化过程中,催化剂表面吸附氧有助于加强TCE催化氧化过程。
2.2.3 催化剂的氧化还原性
图5(d)是不同负载量Mn-Ce/HZSM-5催化剂的H2-TPR 表征结果。从图5(d)中可以看出,MnOx在260~615℃存在两个宽峰,归因于MnO2/Mn2O3还原为Mn3O4进而还原为MnO[35]。CeO2在270~740℃的还原峰归因于表面氧和体相氧的转移[36]。所有Mn-Ce/HZSM-5 催化剂在200~760℃均呈现出两个宽峰,且起始还原温度均低于MnOx和CeO2,这可能是因为Mn-Ce 固溶体的形成促进了晶格氧释放到催化剂表面,提高了催化剂的还原性[25]。与其他催化剂相比,MnCe0.8具有最低的起始还原温度(200℃),这表明MnCe0.8具有更好的表面氧迁移率,有助于促进TCE的氧化。
基于上述分析,MnCe0.8催化剂表现出最优异的催化性能,这与H2-TPR 和XPS 的结果一致。所有Mn-Ce/HZSM-5 催化剂的形貌和微晶结构均没有明显变化,且比表面积相似。其较大的比表面积使得TCE 在催化剂表面的停留时间变长,有利于TCE 分解。H2-TPR 分析结果表明,MnCe0.8起始还原温度最低,说明MnCe0.8表面活性氧更易活化,这与催化剂的氧化还原能力密切相关,从而影响催化性能。XPS分析结果表明,MnCe0.8催化剂具有最高的(Mn4++Mn3+)/Mn、Ce3+/Ce4+和Oa/Ol原子比,这说明MnCe0.8催化剂具有较多高迁移率的表面氧物种以促进TCE的催化氧化。
2.3 响应面试验结果
2.3.1 回归模型和数据分析
本研究使用CCD 对MnCe0.8催化氧化TCE 过程进行优化。基于表4的试验结果,通过数据拟合得到二次多元回归方程如式(4)、式(5)。

方差分析用于检验所得二次方程回归模型的显著性和拟合度,对表4 中数据进行多元回归方程分析,结果如表5 和表6 所示。从表中可以看出:①所得模型的p值均小于0.0001,表明回归模型显著且可靠性较高;②TCE去除率和CO2选择性的回归模型的F值表明所得回归模型是显著的。根据自变量的F值及其交互作用,得出温度是影响TCE去除率和CO2选择性的最关键因素,其次是气体流量和RH;③TCE 去除率和CO2选择性的R2值分别为0.9946和0.9940,表明模型可解释99%以上的实验结果,且实验结果与回归模型相关性良好;④模型的RAdj.2值趋近于RPre.2值,相差小于0.2,变异系数小于10%,进一步证实该模型显著;⑤TCE去除率和CO2选择性的绝对精度分别为58.64和30.32(高于临界值4),失拟项p值均大于0.005,表明噪声的影响可忽略不计,模型稳定性较好。如图6 所示,在响应模型的预测精确性分析中,实验点与预测点紧密随机地分布于图6中对角线及两侧,说明预测值与实验值吻合,进一步表明该回归模型具有较高的拟合度。

图6 预测及实验结果分析图
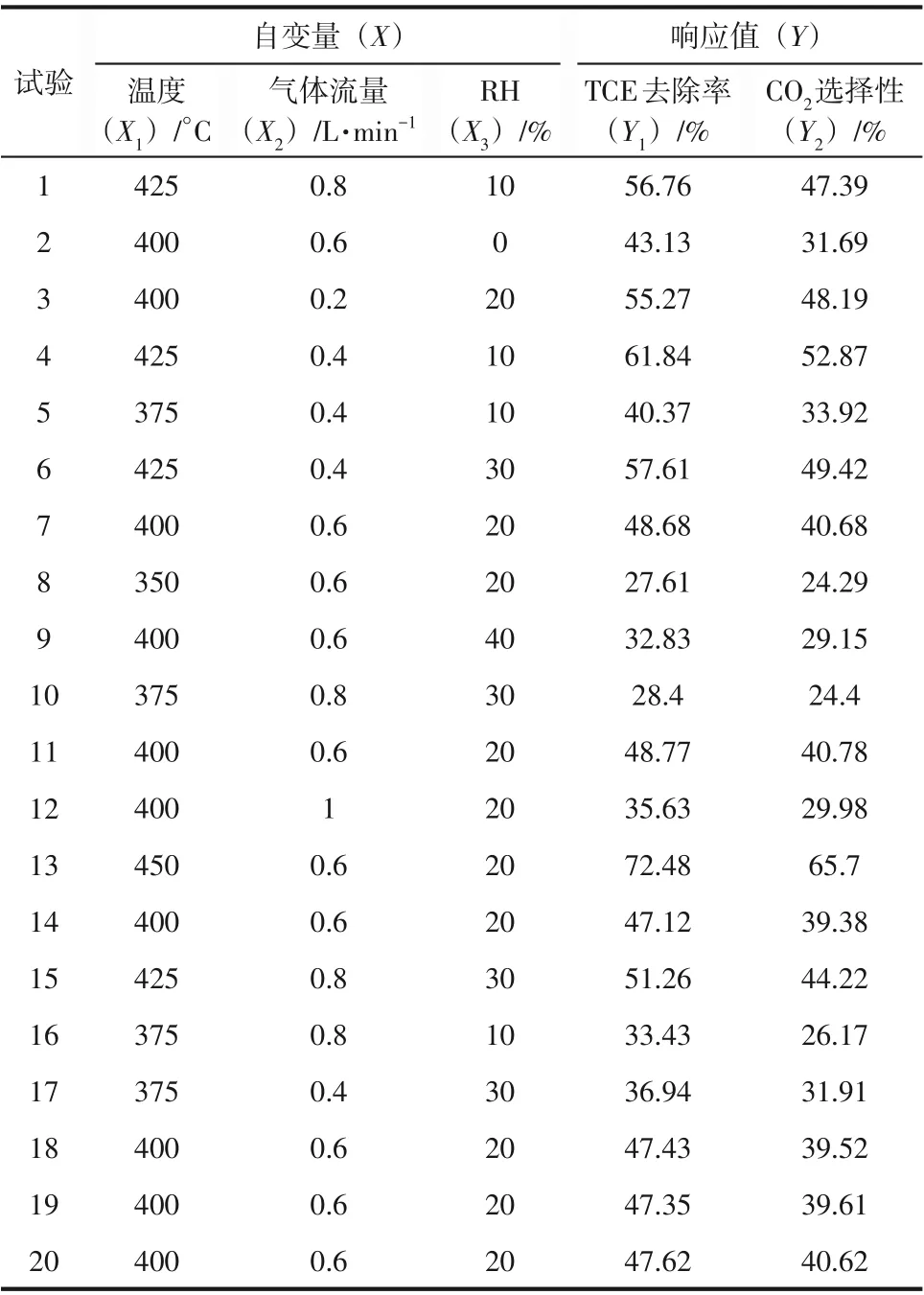
表4 CCD试验设计与结果
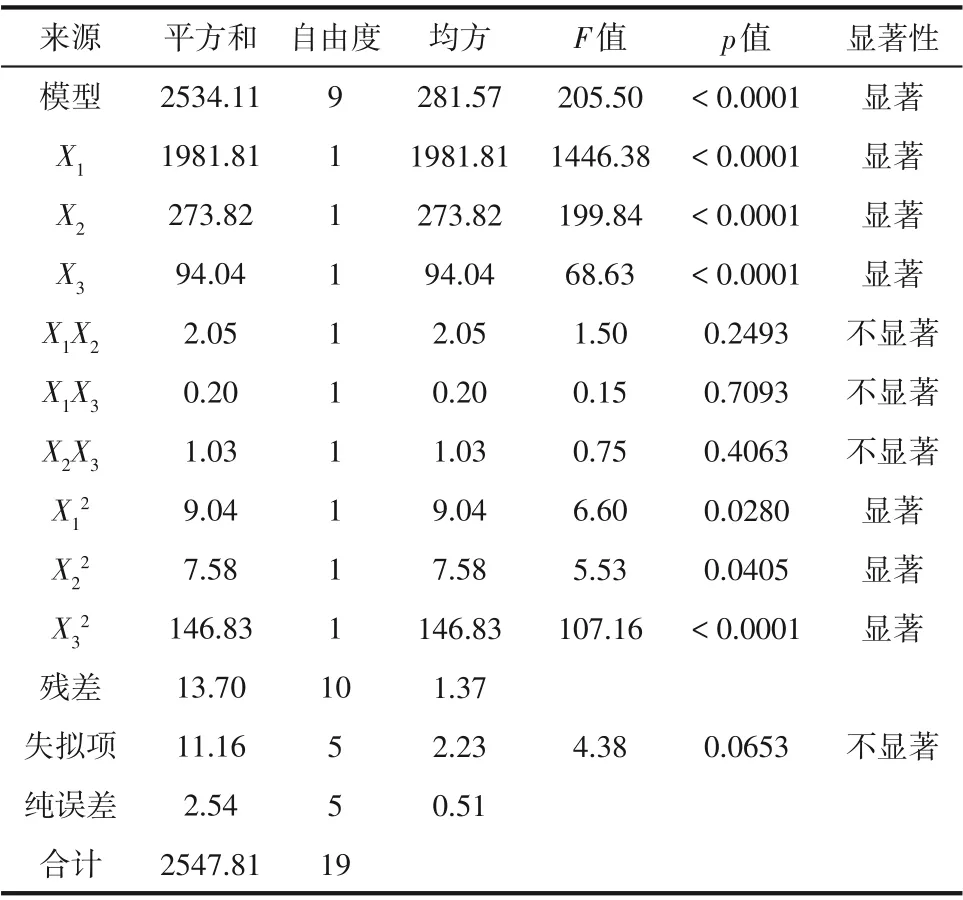
表5 TCE去除率二次模型的ANOVA结果

表6 CO2选择性二次模型的ANOVA结果
2.3.2 气体流量和温度的影响
当RH为20%时,气体流量和温度对TCE去除率和CO2选择性的交互作用如图7 所示。二维等高线图中较大的横向梯度证明了温度对TCE 去除率和CO2选择性起主要作用。X1X2对TCE 去除率和CO2选择性的p值较高,分别为0.25 和0.18,这表明气体流量和温度之间交互作用较弱。低气体流量和高温有利于提高TCE去除率和CO2选择性。当温度为450℃时,气体流量从0.2L/min增加到1L/min,TCE 去除率从76.62%降低到62.84%,CO2选择性从69.67%降低到58.65%。当气体流量固定为0.6L/min,温度从350℃增加到450℃,TCE 去除率从27.61%增加到72.48%,CO2选择性从24.29%增加到65.7%。由此可以得出,较高温度可以为活化催化剂提供更多的能量进而提高催化剂活性,低气体流量可以延长TCE 在催化剂表面活性位点的停留时间,从而增加气体污染物与活性物种(如O)反应,进一步促进TCE催化氧化[37-38]。

图7 气体流量和温度对TCE去除率和CO2选择性的影响
2.3.3 温度和RH的影响
当气体流量为0.6L/min 时,温度和RH 对TCE去除率和CO2选择性的交互作用如图8 所示。在给定温度下,TCE 去除率和CO2选择性随着RH 增加呈先增后减的趋势。较高的RH说明气流中存在较多的水蒸气,可以加快催化剂表面OH形成,有利于TCE 的氧化进程[39]。但是过高的水蒸气可以与TCE分子竞争催化剂表面的活性位点,导致TCE催化氧化效率降低。X1X3对TCE 去除率和CO2选择性的p值分别为0.71 和0.39,表明温度和RH 的交互作用不显著。
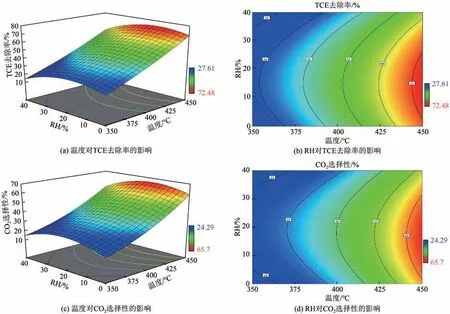
图8 温度和RH对TCE去除率和CO2选择性的影响
2.3.4 气体流量和RH的影响
图9为400℃时气体流量和RH对TCE去除率和CO2选择性的交互作用结果。气体流量从0.2L/min增加至1L/min,TCE 去除率和CO2选择性随之降低,不受RH 变化的影响,说明气体流量与RH 的交互作用不显著,X2X3对TCE 去除率和CO2选择性的p值较高,分别为0.4 和0.87,可以进一步证明上述结论。
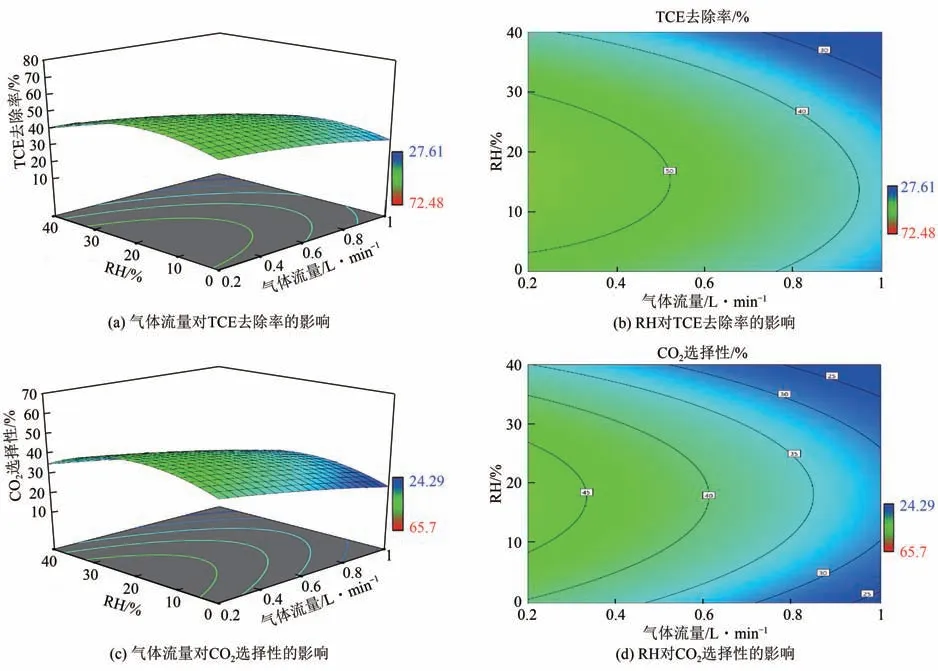
图9 气体流量和RH对TCE去除率和CO2选择性的影响
2.3.5 模型优化与验证
不同因素对TCE催化氧化的影响规律不同,因此有必要对TCE催化氧化过程参数进行优化,进而获得最大TCE去除率和CO2选择性。优化后的最佳工艺参数为:温度为450℃、气体流量为0.2L/min、RH 为16%,在此条件下获得最大TCE 去除率和CO2选择性分别为77.1%和70%。在此条件下重复5 次实验以验证所得回归模型的可靠性。结果表明,TCE去除率和CO2选择性的实验值与预测值的误差分别为1.3%和2.4%,证实利用RSM 优化TCE催化氧化的工艺参数是科学、合理、有效的。
2.4 催化剂稳定性测试
为了进一步分析MnCe0.8催化剂的稳定性,在气体流量为0.2L/min、温度为450℃、RH为16%的最优条件下进行42h 长时间测定,结果如图10 所示。在整个测试阶段,TCE去除率和CO2选择性始终保持在77%和70%,催化活性没有明显变化,这表明MnCe0.8是一种稳定且很有应用前景的TCE减排催化剂。
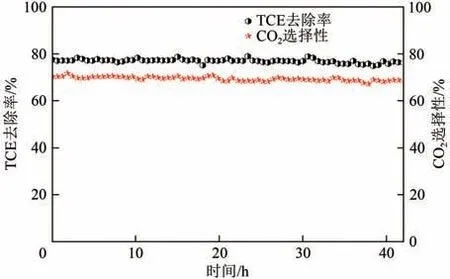
图10 MnCe0.8的稳定性测试图
2.5 TCE催化氧化机制
图11为TCE催化氧化的FTIR 图和机理图,从图11 可以看出,TCE 催化氧化反应中主要的产物有CO、CO2和H2O。MnCe0.8催化氧化TCE的反应机理主要包括以下两步:首先TCE 通过活性位点吸附在催化剂表面,然后进一步分解,被催化剂表面活性氧氧化成CO2、CO和H2O。催化剂表面的活性氧物种通常被认为是影响VOCs 的关键因素。一般用Mars-Van Krevelen(MVK)机理来解释锰基催化剂上的VOCs 氧化过程[40-41]。在TCE 催化氧化过程中,吸附在催化剂表面的TCE 分子在氧化过程中会消耗表面活性氧物种,由气相氧补充产生的氧空位。在整个催化反应中,氧物种的供应作为速控步骤,由催化剂表面金属活性位点的交替氧化和还原驱动。CeO2是储存、释放O2的良好储库,研究发现CeO2-MnO2催化剂中Ce3+可以通过Ce4+/Ce3+的氧化还原循环促进氧空位的形成[42-44]。氧空位是气相氧的吸附-解吸中心。Mn-Ce/HZSM-5 催化剂中Mn氧化物和Ce氧化物之间的相互作用可以促进氧迁移率,并通过氧空位和活性金属位点上化学吸附氧和晶格氧物种的转变,进而加速活性氧的形成。这些过程加速了TCE 和中间体的深度氧化,通过催化剂表面的活性氧作用转变为最终产物CO2和H2O。

图11 TCE催化氧化的FTIR谱图和反应机理示意图
3 结论
本文通过沉积-沉淀法制备一系列不同Ce/Mn摩尔比的Mn-Ce/HZSM-5催化剂。与MnOx/HZSM-5和CeO2/HZSM-5相比,Mn-Ce/HZSM-5催化剂的反应活性显著提高,其中MnCe0.8/HZSM-5 催化剂表现出最优异的催化性能,主要归因于其丰富的表面活性氧和较高的还原性。
TCE去除率和CO2选择性随着气体流量的降低和温度的升高而增加,随着RH 的增加先增后减。此外,温度是促进TCE 催化氧化过程的最重要因素,其次是气体流量和RH。在最佳工艺条件(气体流量为0.2L/min、温度为450℃、RH 为20%)下,TCE 去除率和CO2选择性最大分别为77%和70%。本研究证实了响应面分析法在TCE催化氧化过程优化中表现出较高的可靠性和稳定性,为含氯挥发性有机污染物控制提供了有效的解决思路。

