NDRG1 干扰载体的构建及稳定过表达NDRG1 人脑微血管内皮细胞的建立
阮婷玉, 史唯地, 马 勋, 王 静, 康立超, 杜冬冬, 殷月兰
(1. 石河子大学动物科技学院预防兽医实验室, 新疆 石河子 832003;2. 新疆农垦科学院分析测试中心, 新疆 石河子 832000;3. 江苏省人兽共患病学重点实验室, 江苏 扬州 225009)
单 核 细 胞 增 生 李 斯 特 菌 (Listeria monocytogenes, Lm)是引起全球严重的食源性感染和公共卫生问题的一种食源性病原体, 可引起人类李斯特菌病[1]。单增李斯特菌毒力岛4(Listeria monocytogenespathogenicity island-4, LIPI-4) 为2016 年新发现的与中枢神经系统和母婴感染相关的Lm 特异性毒力基因簇[2]。N-myc 下游调节基因1(N-myc downstream regulated gene 1, NDRG1)又称分化相关基因1[3], 多年来该基因在人类和动物中相继被发现。NDRG1 是一种胞质蛋白, 主要在上皮细胞中表达, 但其细胞定位取决于细胞类型[4]。国 内 外 研 究[5-9]发 现:NDRG1 作 为 一 种 高度保守的蛋白质, 广泛存在于各种正常组织和肿瘤中, 并参与胚胎发育、脂质合成、髓鞘合成、细胞增殖分化、肿瘤细胞迁移、炎性肿瘤微环境的调控、应激反应和维持外周轴突的功能完整等多种过程。NDRG1 在癌症中的研究较多, 但在炎性疾病发生发展中作用的研究较少。目前关于LIPI-4 的研究主要集中于基因序列分析[10]、流行病学调查[11-12]和生 物学特性[13]等, 关于LIPI-4 在Lm 致中枢神经系统感染中分子机制的研究较少。本研究构建NDRG1 shRNA 干扰载体、过表达载体和建立 稳 定 过 表 达NDRG1 的hCMECs, 为 后 续NDRG1 在LIPI-4 介导的Lm 侵袭和穿越血脑屏障诱导中枢炎症中的分子机制研究提供细胞模型。
1 材料与方法
1.1 细胞、菌株、质粒、主要试剂和仪器人脑微血管 内 皮 细 胞 (human cerebralis microvascular endothelial cells, hCMECs) 购自北纳创联生物研究院。大肠杆菌(Escherichia coli, E. coli)DH5α购自北京全式金生物技术有限公司。pMD19-T(Simple)购自北京宝日医(TaKaRa)生物有限公司, 真核表达载体pcDNA3.1 由石河子大学动物科技学院胡广东副教授馈赠, 表达载体pGPU6-GFP购自上海吉玛制药技术有限公司。细胞外基质(extracellular matrix, ECM)、 胎 牛 血 清(fetal bovine serum, FBS) 和 内 皮 细 胞 生 长 因 子(endothelial cell growth factor, ECGF) 购 自 美国Sciencell公司, 限制性内切酶BamH Ⅰ、Hind Ⅲ和反转录试剂盒购自宝日医生物技术(北京) 有限公司, 琼脂糖凝胶电泳回收试剂盒、质粒小提试剂盒和无内毒素质粒大提试剂盒购自北京天根公司, NDRG1 兔多克隆抗体(AF7551)和GAPDH 兔单克隆抗体(AF1186)购自上海碧云天生物技术有限公司, 辣根酶标记山羊抗兔IgG (H+L) 和DAB 显色试剂盒购自北京中杉金桥生物技术有限公 司, Lipofectamine 2000 Transfection Reagent 和Opti-MEM 购自美国赛默飞世尔科技公司, 新霉素(G418)购自北京博奥拓达科技有限公司。实时荧光 定 量PCR (real-time fluorescence quantitative PCR, RT-qPCR) 仪 和 普 通PCR 仪 购 自 德 国Sensoquest 公司, 微量核酸蛋白测定仪和CO2培养箱购自美国Thermo Fisher 科技有限公司, SDSPAGE 凝胶电泳仪和蛋白转印系统购自英国Cleaver 公司, 倒置荧光显微镜购自德国Leica公司。
1.2 NDRG1 shRNA 的设计和合成参照GenBank 登录NDRG1 全开放阅读框(登录号为CR456842.1), 通 过shRNA 靶 序 列 设 计 网 站https://rnaidesigner. invitrogen. com, 筛选8 条靶序列, 加入9 nt TTCAAGAGA 序列形成了含茎环的发夹结构, 并且以6个T碱基作为RNA pol Ⅲ的转录终止子。分别命名为shRNA-NDRG1-236、shRNANDRG1-242、 shRNA-NDRG1-251、 shRNANDRG1-613、 shRNA-NDRG1-239、 shRNANDRG1-564、 shRNA-NDRG1-802、 shRNANDRG1-1041 和shRNA-NDRG1-NC (表1), 引物委托上海吉玛公司合成。
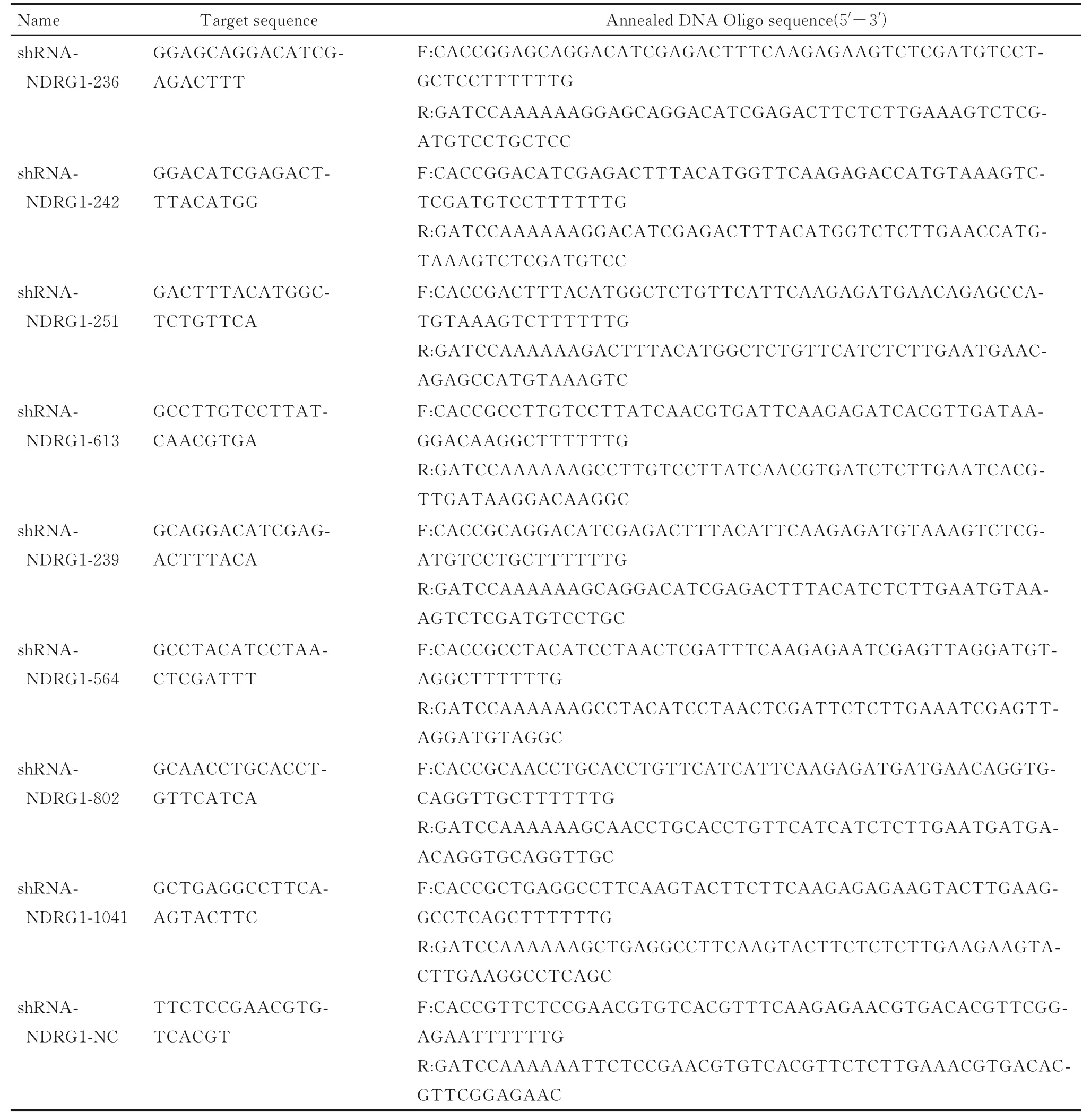
表1 NDRG1 基因shRNA 载体靶序列和退火DNA Oligo 序列Tab. 1 Target sequences of shRNA vector of NDRG1 gene and annealed DNA Oligo sequences
1.3 NDRG1 shRNA 干扰载体构建和转染效率观察采取水浴方式对设计合成的8 个shRNA 的DNA 双链进行退火, 50 μL 退火体系:正义链和反义链(100 μ mol·L-1)各5 μL, 退火缓冲液(10×TE Buffer)5 μL, ddH2O 35 μL。选择BamH Ⅰ和BbsⅠ对pGPU6-GFP 空质粒进行双酶切, 经凝胶电泳检测后纯化回收相关片段, 采用T4 连接酶将回收产物与含互补黏性末端的DNA 双链连接, 转化至DH5α 中, 在Kana 抗性平板上筛选阳性克隆送至生工生物工程(上海) 股份有限公司测序鉴定。将复苏后的第3 代hCMECs 以1×105mL-1的密度接种至12 孔细胞培养板, 细胞密度达到80%时进行转染, 转染体系为每孔1.5 μg 质粒+3.0 μL Lipofectamine 2000。转染后4~6 h 更换为无抗生素的完全培养基, 转染后24 h 在荧光倒置显微镜下观察转染效率, 以表达绿色荧光蛋白(green fluorescence protein, GFP) 的阳性克隆百分率作为转染效率。
1.4 NDRG1 过表达引物设计、合成和载体构建
参照GenBank 登录NDRG1 全开放阅读框(登录号为CR456842.1), 采用Primer 5.0 软件设计特异性引物:上游引物5'-CCCAAGCTTGGGATGTCTCGGGAGATGCAGGAT-3', 下游引物5'-CGGGATCCCGTTAACAGGAGACCTCCATGGACTTG-3', 并对引物的5'端添加酶切位点(下划线部分为酶切位点)及保护性碱基(斜体部分为保护性碱基), 引物委托生工生物工程(上海)股份有限公司合成。以hCMECs 的cDNA 为模板扩增NDRG1 CDS 片段, 将其与pMD19-T 连接并测序[由生工生物工程(上海)股份有限公司完成]。将测序结果正确的重组质粒与pcDNA3.1 质粒分别采用BamH Ⅰ和Hind Ⅲ双酶切后纯化回收相关片段, 经T4 连接酶连接后转化至DH5α 中, 在Amp 抗性平板上筛选阳性克隆菌株进行质粒提取、双酶切检测和测序。
1.5 细胞总RNA 提取、质检和反转录及RT-qPCR法检测hCEMCs 中NDRG1 mRNA 表达水平将构建成功的8 个shRNA 干扰载体和过表达载体分别转染hCEMCs 后, 48 h 提取细胞总RNA。以转染空载体的hCEMCs 作为对照组, 采用RT-qPCR法验证干扰和过表达后hCEMCs 中NDRG1 mRNA表达水平。分别对干扰载体转染后48 h 及过表达载体转染后筛选纯化的细胞株采用TRIzol 试剂提取细胞中总RNA, 提取后采用超微量分光光度计(Nanodrop 2000) 和琼脂糖凝胶电泳进行RNA 质检。采用反转录试剂盒(RR047A) 制备cDNA。以NDRG1 基因为目的基因(上游引物5'-ACACCTACCGCCAGCACATT-3';下游引物5'-GGTCGCTCAATCTCCAGGTC-3'), 以GAPDH 基因作为内参基因(上游引物5'-TGCCTCCTGCACCACCAACT-3';下游引物5'-CGCCTGCTTCACCACCTTC-3'), 采 用 RT-qPCR 法 检 测hCEMCs 中目的基因mRNA 表达水平。RT-qPCR反 应 体 系:Perfect Start®Green qPCR SuperMix 10 μL, PCR上游和下游引物(10 μmol·L-1)各0.4 μL, cDNA 模板1 μL, 无核酸酶水加至20 μL。反应条件:94 ℃、30 s;94 ℃、5 s, 60 ℃、15 s, 72 ℃、10 s;共45 个循环。采用2-△△Ct法计算目的基因mRNA 表达水平。
1.6 蛋白提取和Western blotting 法检测hCEMCs中NDRG1 蛋白表达水平采用Western blotting 法验证干扰和过表达后hCEMC 中NDRG1 蛋白表达水平。分别对干扰载体转染后96 h 及过表达载体转染后经G418 筛选纯化后的细胞进行蛋白质提取。收集细胞后按照蛋白裂解液说明书进行操作, 提取细胞蛋白样品并进行BCA 蛋白定量。每孔加入15 μg 蛋白, 进行SDS-PAGE 电泳后将条带转至PVDF 膜上。5%脱脂奶粉封闭1 h。按照1∶1 000比例加入抗NDRG1 和GAPDH 抗体, 4 ℃静置过夜孵育。TBST 洗膜5 min×3 次, 按1∶2 500 比例加入HRP 山羊抗免IgG, 室温摇床孵育1 h 后采用TBST 洗膜5 min×3 次。采用DAB 进行显色。
1.7 NDRG1 稳定过表达细胞筛选采用脂质体转染和新霉素筛选的方式获得稳定过表达NDRG1的细胞。将复苏后第3 代hCMECs 以1×104mL-1接种至24 孔细胞培养板中, 待细胞汇合至90%时进行G418 浓度梯度筛选, 每孔中加入含不同浓度G418 (0.1、 0.2、 0.3、 0.4、 0.5、 0.6、 0.7、0.8、0.9 和1.0 g·L-1)的 培 养 基, 每 个 梯 度行3 个重复孔, 每2~3 d 更换1 次筛选培养液;以14 d 内能够杀死所有细胞的最小G418 浓度为最佳浓度。按照“1.3”中的操作步骤对过表达载体进行转染。另准备1 孔hCMECs 作为筛选用阴性对照(对照组)。在转染后48 h 对转染细胞进行G418 筛选, 待阴性对照细胞全部死亡后, 将G148 浓度减半继续培养至14 d。14 d 后将出现的阳性克隆细胞采用滤纸片法消化至24 孔细胞培养板中扩大培养。将筛选得到的阳性克隆细胞在96 孔细胞培养板中稀释, 选择只有1 个细胞生长的孔继续扩大培养。采用RT-qPCR 和Western blotting 法检测筛选后阳性克隆hCMECs 中NDRG1 mRNA 和蛋白表达水平。
2 结 果
2.1 pGPU6-GFP 载体的双酶切产物和鉴定对含有GFP 的载体pGPU6-GFP 采用限制性内切酶进行酶切鉴定(图1), 电泳检测结果显示载体片段大小约为5 117 bp, 与预期结果一致, 可行后续实验。
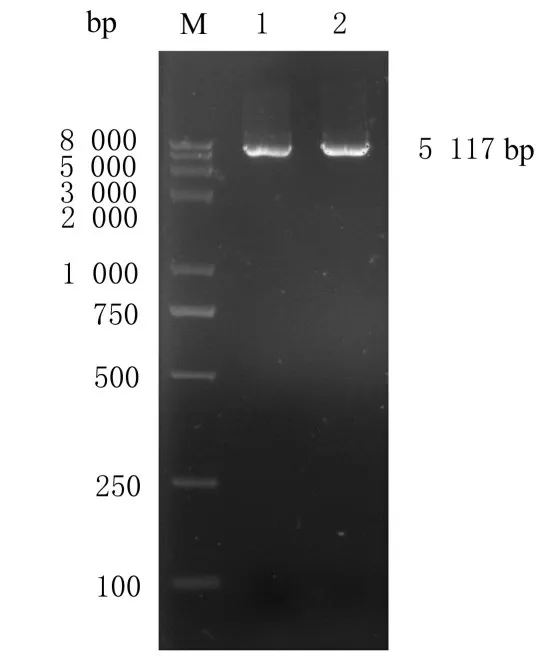
图1 pGPU6-GFP 载体双酶切产物鉴定电泳图Fig.1 Identification electrophoregram of products of pGPU6-GFP vector digested by double enzyme
2.2 NDRG1 干扰载体转染效率采用Lipofectamine 2000 转染试剂将构建的8 个shRNA干扰载体转染hCMECs, 转染后24 h 采用荧光倒置显微镜观察转染效率。表达GFP 的阳性克隆细胞百分率约为70%, 转染后的hCMECs 增殖情况良好, 表明NDRG1 基因shRNA 干扰载体转染成功并稳定表达。见图2。
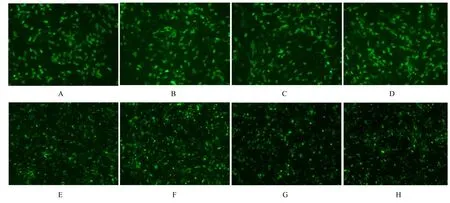
图2 荧光显微镜观察shRNA 干扰载体转染后hCMECs 中GFP 表达情况Fig. 2 Expression of GFP in hCMECs after transfected with shRNA interference vectors obseved under fluorescence microscope
2.3 NDRG1 shRNA 转染后hCEMCs 中NDRG1 mRNA 和蛋白表达水平RT-qPCR 法检测结果显示:8 个shRNA 干扰载体中有3 个具有较好的干扰效果(图3A), 分别为shRNA-236、shRNA-242 和shRNA-613。转染后hCEMCs 中NDRG1 mRNA 表达水平分别约为对照的26%、21%和13%。转染后96 h 时对上述3 个载体转染后hCEMCs 中NDRG1 蛋白表达水平进行Western blotting 法检测, 结果显示:在相对分子质量为48 000 附近检测到与预计相对分子质量相符的对应特异性蛋白条带, 且蛋白表达水平与RT-qPCR 法检测结果一致(图3B)。
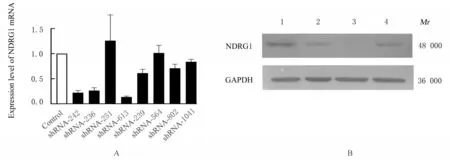
图3 不同载体转染后hCMECs 中NDRG1 mRNA 表达水平(A)和NDRG1 蛋白表达电泳图(B)Fig. 3 Expression levels of NDRG1 mRNA (A) and electrophoregram of expressions of NDRG1 protein (B) in hCMECs after transfected with different vectors
2.4 pcDNA3.1-NDRG1 过表达载体构建以hCMECs 的cDNA 为模板, 通过PCR 扩增获得NDRG1 CDS 片段(图4A), 电泳结果目的片段大小与预期(1 185 bp)相符。采用BamH Ⅰ和Hind Ⅲ对pcDNA3.1 载体进行酶切, 电泳鉴定结果显示线性化载体条带大小(5 428 bp) 与预期结果相符(图4B)。将NDRG1 CDS 扩增片段连接测序载体pMD19T, 测序正确后回收目的片段与线性化的pcDNA3.1 载体连接和转化, 经过Amp 抗性筛选后提取重组质粒, 采用BamH Ⅰ和Hind Ⅲ对重组质粒进行双酶切, 重组质粒双酶切后可见1 185 与5 428 bp 的2 个条带(图4C), 与预期结果一致, 经测序验证表明pcDNA3.1-NDRG1 过表达载体构建成功。
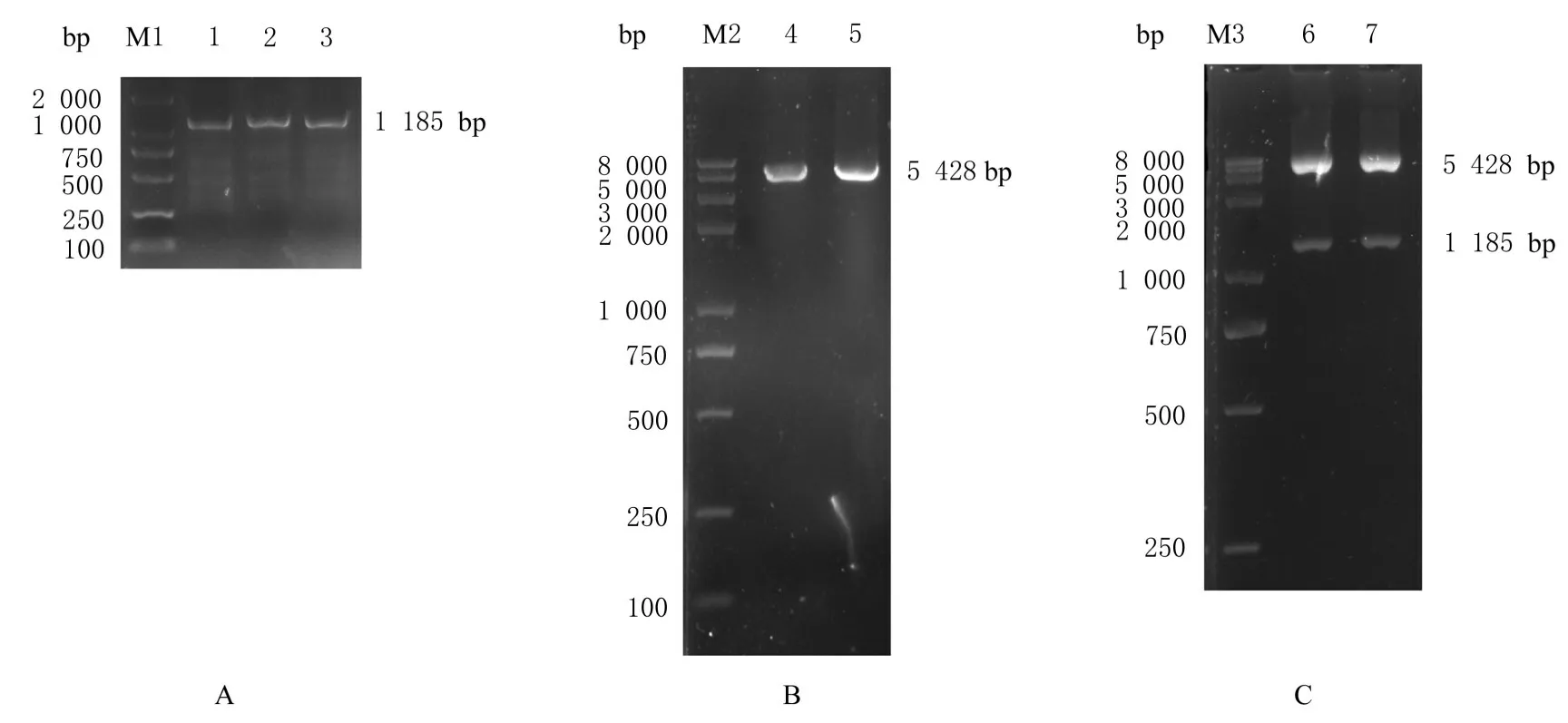
图4 NDRG1 CDS PCR 产物(A)、pcDNA3.1 线性化鉴定(B)和pcDNA3.1-NDRG1 重组质粒酶切(C)电泳图Fig. 4 Electropherograms of NDRG1 CDS PCR product (A), pcDNA3.1 linearization identification (B), and enzyme digestion of pcDNA3.1-NDRG1 recombinant plasmid (C)
2.5 过表达NDRG1 的hCMECs 的建立RTqPCR 法检测结果显示:与对照比较, 筛选后的hCMECs 中NDRG1 mRNA 表达水平上调约25.96 倍;Western blotting 法检测结果显示:在相对分子质量48 000 附近检测到清晰单一条带, 与预计相对分子质量相符, 且蛋白表达趋势与RT-qPCR电泳结果一致(图5), 镜下观察细胞形态无明显改变(图6), 表明稳定过表达NDRG1 的hCMECs 建立成功。
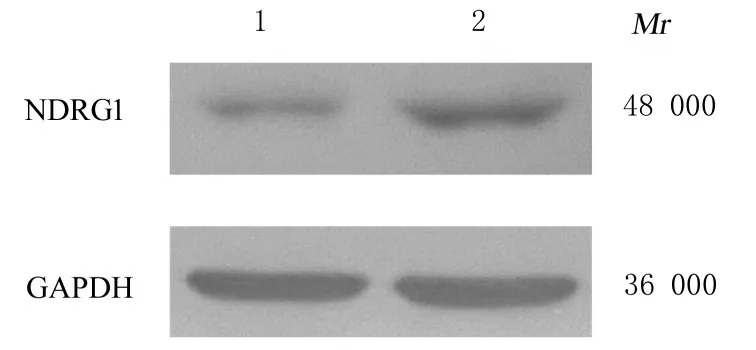
图5 hCMECs 中NDRG1 蛋白表达电泳图Fig. 5 Electrophoregram of expression of NDRG1 protein in hCMECs
图6 过表达NDRG1 的阳性克隆hCMECs 形态表现Fig. 6 Morphology of positive clone hCMECs overexpressing NDRG1
3 讨 论
病原菌与宿主细胞的相互作用极其复杂, 病原菌感染细胞后会导致细胞大量基因的表达发生改变, 研究参与这一过程的宿主细胞的基因有助于探讨病原菌的致病机制, 为疾病的防控提供理论基础。Lm 是引起人兽共患李斯特菌病的胞内寄生菌, 可穿越宿主血脑屏障、肠道屏障和胎盘屏障, 引起细菌性脑膜炎、肠胃炎和流产等疾病[14-15]。近年来人类李斯特菌病的致死率在全球多个地区达到20%~30%[16-17], 可见其危害性。为了研究LIPI-4介导的Lm 穿越血脑屏障诱导中枢炎症中的分子机制, 本课题组[14]前期完成了LIPI-4 介导的Lm 在体外的毒力研究, 并通过转录组测序技术筛选到宿主细胞的差异表达基因之一——NDRG1。NDRG1作为一种已知的多发性肿瘤转移抑制因子, 但是其在炎性疾病中的研究较少, 尤其在Lm 引起的中枢炎症中的作用未见报道。
研究[18]显示:NDRG1 在人体多种组织中广泛表达, 提示NDRG1 可能参与各种组织和细胞的生长过程。NDRG1 作为一种应激反应蛋白[19-21], 在机体中可对多种刺激产生反应, 并且通过多种信号通路和分子机制介导其活性发挥调节作用[22-23]。此外NDRG1 参与多种生理活动和功能调节, 包括肿瘤进展和细胞应激反应, 因此NDRG1 在疾病发生发展过程中发挥重要作用。JIN 等[24]发现:在热灭活的大肠杆菌和金黄色葡萄球菌处理的牛乳腺上皮MAC-T 细胞模型中NDRG1 表达上调。为了进一步探索NDRG1在自然环境中的表达, JIN 等[24]检测了NDRG1 在乳房炎和正常牛乳腺组织中的基因表达, 结果显示:NDRG1 参与了牛乳房炎时乳腺的免疫应答。研究[25-26]显示:在炎症状态下的牛乳腺上皮细胞和乳房组织中NDRG1 高表达, 并且NDRG1 通过影响肿瘤坏死因子α、白细胞介素6和转化生长因子β 的表达, 抑制磷酸化蛋白激酶B(phosphorylated protein kinase B, p-AKT)下游效应分子哺乳动物雷帕霉素靶蛋白(mammalian target of repamycin, mTOR)的激活;并且NDRG1通过负调控p-AKT 和p-MTOR 信号分子的表达, 抑制β-酪蛋白的合成和细胞增殖。
目 前RNA 干 扰 技 术 很 多[26], 其 中shRNA 干扰载体具有高度特异性, 操作简单, 稳定性、转染效率和干扰效率较高, 重复性好。shRNA 一旦整合进入细胞基因组, 能够使靶基因长时间稳定敲减。GFP 为常用的报告基因, 发射的绿色荧光稳定, 且灵敏度高、易于检测, 因此可以帮助评估载体的转染效率。基于上述研究基础, 本研究采用pGPU6-GFP 载体, 成功构建了针对人源NDRG1的shRNA 干扰载体并在hCMEC 中检测转染效率和干扰效率, 筛选出了干扰效果最好的shRNA 干扰载体, 为后续深入研究NDRG1 基因的功能提供有利条件。
本研究成功构建针对人源NDRG1 的shRNA干扰载体并验证干扰效果, 构建pcDNA3.1-NDRG1 真核表达载体并建立了稳定过表达NDRG1 的hCMECs, 为 后 续NDRG1 在LIPI-4 介导的Lm 感染hCMECs 中的功能验证提供依据。

