ECMO 联合IABP 治疗心源性休克过程中膜肺水肿导致低氧血症1 例报告及文献复习
顾 明, 田加坤, 赵亚男, 孙 键, 张京晓, 宋德彪
(1. 吉林大学第二医院急诊与重症医学科, 吉林 长春 130041;2. 吉林大学中日联谊医院神经内二科, 吉林 长春 130033)
心源性休克是一种高度急性、潜在复杂性和血流动力学多样性的终末器官低灌流状态[1]。根据1995—2013 年收集的数据, 有4%~12%的急性心肌梗死患者发生心源性休克[2-3]。急性心肌梗死早期血管再通联合主动脉球囊反搏(intra-aortic balloon pump, IABP)会使住院患者病死率明显降低[4-5]。单纯采用静脉-动脉体外膜氧合(venoarterial extracorporeal membrane oxygenation, VAECMO)较单纯采用IABP 可进一步改善心源性休克患者预后[6-7]。在急性心肌梗死患者中, 与仅采用VA-ECMO 的患者比较, 采用IABP 联合VAECMO 的 患 者 病 死 率 降 低 了18.5%[8]。 VAECMO 引流静脉血, 减低回心血量进而减轻右心前负荷, 但逆向血流灌注会导致左心室后负荷增加, 在严重左心功能障碍的患者中, 此时左心室收缩力下降可能不能将足够的血液泵出, 左心室舒张末期压力升高、左心室血流瘀滞, 引起其他不良后果[9]。而IABP 可 降 低 左 心 室 后 负 荷[10], 研 究[11]显示:采用VA-ECMO 和左心室减压设备可明显降低病死率, 因此ECMO 联合IABP 可提高急性心肌梗死后的心源性休克及重度左心室功能不全患者的 生存率[12]。现报道1 例ECMO 联合IABP 支持下伴发低氧血症病例, 该病例低氧血症始动因素为膜肺水肿, 目前国内外对“膜肺水肿”报道极少, 本文作者结合其临床表现、影像学和血气分析等特征及治疗方式等临床资料以及国内外相关文献进行回顾性分析, 以提高临床工作者对ECMO 联合IABP使用过程中心源性休克患者伴发低氧血症的认识。
1 临床资料
1.1 一般资料患者, 男性, 48 岁, 因阵发性心前区疼痛9 h, 加重4 h, 于2021 年10 月23 日急诊收入吉林大学第二医院心血管内科。患者于入院前9 h 无明显诱因出现心前区疼痛, 压榨性疼痛, 疼痛持续1~2 min 后可缓解, 未就医。入院前4 h无明显诱因再次出现心前区疼痛, 自述疼痛程度较之前加重, 活动时疼痛剧烈, 放散至后背, 疼痛持续, 休息后未缓解, 无头晕和头痛, 无恶心及呕吐等不适, 上述症状反复发作, 遂就诊于中国人民解放军第208 医院, 行相关检查明确诊断为“急性心肌梗死”, 给予口服“阿司匹林肠溶片300 mg 和波立维300 mg”后转入吉林大学第二医院急诊科以“急性心肌梗死”收入院。既往:高血压病史3 年, 血压最高达180/120 mmHg, 平素规律口服硝苯地平, 自述血压控制尚可;否认糖尿病史。吸烟20 余年, 每天约20 支。查体:患者神志清。血压110/70 mmHg, 脉搏117 min-1, 呼吸23 min-1, 经皮动脉血氧饱和度(percutaneous arterial oxygen saturation, SpO2) 为95%。双肺呼吸音粗, 双肺可闻及明显干、湿啰音。心尖搏动位于第五肋间左锁骨中线内0.5 cm 处, 叩诊心浊音界无扩大, 心音减弱, 节律规整, 心率117 min-1, 未闻及心脏杂音。腹部查体未见异常。四肢末端略湿冷。
1.2 化验和检查肌钙蛋白2.6 μg·L-1, 肌红蛋白55 μg·L-1, 肌酸激酶1 142 U·L-1, 肌酸激酶同工酶56.0 U·L-1, 乳酸脱氢酶1 530 U·L-1。心电图提示:窦性心律, 心电轴不偏, 不正常心电图, Ⅰ、aVL 和V1-V6 ST 段抬高。
1.3 造影和治疗住院后1 h 行冠脉造影, 见前降支近段闭塞, 远端TIMI 血流0 级。回旋支近中段可见70%~80%狭窄, 远段可见70%~80%狭窄, 远端TIMI 血流Ⅲ级。给予前降支支架植入, 因术后血压低安装IABP(1∶1 反搏), 术后返回心内科监护室, 并给予无创呼吸机治疗。术后第2 天(入院第2 天)患者排便后突发心力衰竭, 立即给予呋塞米、地塞米松和吗啡, 症状不缓解并出现大汗, 四肢湿冷及口唇发绀, 心电监护显示:血压96/60 mmHg, 心率140 min-1, SpPO278%, 给予无创机械通气无缓解, 转入重症监护病房(Intensive Care Unit, ICU) 行 紧 急ECMO 治疗, 转 速3 200 r·min-1, 血 流 量3.0 L·min-1, 气流量3.0 L·min-1, 水箱温度37.1 ℃。经综合处置后生命体征趋于平稳, 血 压126/70 mmHg, 脉搏86 min-1, SpO298%, 呼吸15 min-1。
1.4 低氧血症处理和辅助检查ECMO 支持术后第2 天, 短时间心率由82 min-1迅速上升至150~160 min-1, 血 压98/79 mmHg, 呼 吸35 min-1, SpO2下降至89%。患者自述呼吸困难。查体:呼吸窘迫, 双肺可闻及明显湿性啰音。除外患者自身因素后, 紧急检查体外生命支持系统, ECMO 泵头 转 速3 000 r·min-1, 血 流 量2.8 L·min-1, 膜 肺前和膜肺后管路内血液呈暗红色, 膜肺前氧分压22 mmHg, 膜肺后氧分压63 mmHg。IABP 运转正常。床旁心脏超声检查可见心室壁搏动弱, 左心室饱满(图1), 肺部超声提示B 线增多(图2), 提示肺水肿较之前明显加重。调整机械通气氧浓度至100%, 同时将ECMO 气流量调整至15 L·min-1, 见膜肺排气孔排出大量水滴。同时将IABP 反搏率下调至1∶2。约10 min 后血压为110/80 mmHg, 脉搏95 min-1, 呼吸19 min-1, SpO2为95%, 患者自述呼吸困难明显缓解。复查心脏超声可见左心室充盈度减轻, 肺部B 线明显减轻。ECMO 支持4 d后撤除, IABP 保留至住院第7 天撤除, 14 d 后患者出院。
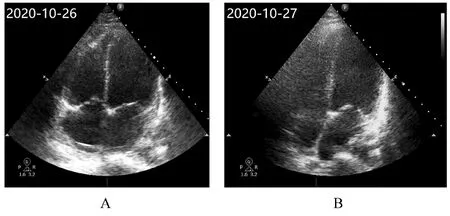
图1 心源性休克伴发低氧血症患者治疗前后心脏超声影像Fig. 1 Cardiac ultrasound images of patients with cardiogenic shock complicated with hypoxemia before and after treatment
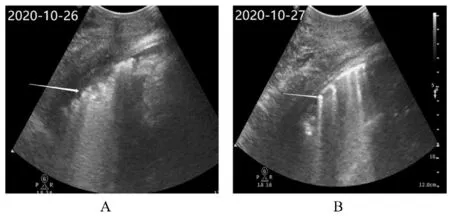
图2 心源性休克伴发低氧血症患者治疗前后肺部超声影像Fig. 2 Lung ultrasonic images of patients with cardiogenic shock complicated with hypoxemia before and after treatment
1.5 随访情况半年后患者随访复诊, 心功能正常, 生活自理。
2 讨 论
心源性休克是一种高度急性、潜在复杂性和血流动力学多样性的终末器官低灌流状态[1]。急性心肌梗死并发左心室功能障碍乃是心源性休克最常见的原因。尽管近年来体外生命支持手段发展很快, 但心源性休克发病率和死亡率仍然居高不下, 且几乎无已知的循证治疗干预措施可以明显改善患者的预后[13]。IABP 是治疗低心排血量患者常用的体外机械辅助手段[14]。IABP 一方面通过在舒张期早期向主动脉反搏大量血液, 进而增加主动脉舒张压来增加冠脉灌注;另一方面是通过将大量血液从主动脉根部挤到主动脉远端来降低升主动脉的压力, 从而减少心室后负荷[15]。VA-ECMO 在心源性休克抢救治疗中的应用也已成为当前的一种治疗方法[16]。但ECMO联合IABP的疗效并非“1+1>2”[17]。患者在ECMO 辅助下并发低氧血症, 表现为急性左心衰和肺水肿, 超声显示左心室饱满、肺超声B 线增多。分析原因:①ECMO 因素。ECMO 提供循环动力和氧合, 从而为机体提供氧气。该患者ECMO 管路膜肺前和膜肺后管路内血液呈暗红色, 采集其膜肺前和膜肺后血气分析根据氧分压及二氧化碳分压结果, 可以对膜肺功能进行评估, 结果提示患者膜肺氧合及二氧化碳清除均有障碍, 并且膜肺前及膜肺后氧分压明显降低, 提示ECMO 的氧合能力降低, 但转速和流量稳定(转速3 000 r·min-1, 流量2.8 L·min-1, 水 箱 温 度37.1 ℃, 气 流 量3 L·min-1)。检查管路内未见明显血栓提示管路通畅, ECMO 运行时间短、抗凝充分的情况下氧合器内血栓形成概率较低, 所以排除了血流因素导致的通气血流量改变。进一步对气源进行排除, 通过插拔接口发现气源供给无问题。膜肺氧合状态下降与膜肺气源导致的通气血流比改变有关, 膜肺由中空纤维构成, 中空纤维内走行气体, 纤维外走行血液。膜肺纤维壁上有微孔, 血浆中水分可以在液膜界面蒸发, 进入纤维管腔内, 向气相扩散。纤维管内蒸发液体达到饱和状态, 因膜肺与室温存在温差, 故在出口处形成冷凝水, 阻塞纤维管, 降低氧合器气体交换的效率[18-19]。这种阻塞常被称为膜肺水肿, 膜肺水肿后引起氧弥散障碍使血红蛋白不能充分携带氧气, 所以ECMO 提供非100%氧合血红蛋白, ECMO 氧供减少, 导致低氧血症。②IABP因素:膜肺水肿致ECMO 供氧减少后患者氧供不足, 机体为了增加氧供, 反射性增加心率, 进而提高心排血量(心排血量=每搏心排血量×心率), 发病时心率为150~160 min-1, 在心率极快时, 球囊放气时间短, 排气不充分, 可增加左心室后负荷, 在ECMO 的逆灌下进一步增加左心室后负荷, 引起左心室舒张末压升高, 进而引起肺水肿, 肺水肿可以引起肺弥散膜增厚导致肺部氧合能力降低, 导致心脏搏出血液氧饱和度降低, 进一步导致低氧血症。③心脏辅助的VA-ECMO 多数通过股动脉和股静脉建立通路, 为逆行性灌注。逆行灌注时, 在心排血量低时, ECMO 联合IABP 可能降低冠状动脉压(平均动脉压降低11.7%)[20], 同时冠状静脉窦血氧饱和度降低[20]。在某些特殊情况下其联合疗效与研究[17]结论一致。综合上述因素, 膜肺水肿后引起患者一系列改变, 导致患者氧合和氧供降低, 引起低氧血症。
本例患者为清醒ECMO 患者, 能够清晰表述不适症状, 自述心悸及呼吸困难, 监护提示心率快、血压低和低氧, 行床头超声检查见左心室“自显影”、膨胀, 肺超声检查见B 线明显增多, 提示肺水增多[21-22]。处理措施:①提高心脏氧供。结合超声结果, 通过无创呼吸机的正压通气可改善肺水肿[23], 提高吸入氧浓度可迅速提高心脏搏出血液的氧饱和度。增加冠脉氧供, 进而改善左心室功能。②提高ECMO 氧供。迅速排查膜肺功能下降的原因, ECMO 膜肺功能下降的原因考虑为膜肺水肿所致, 解决膜肺水肿可通过“叹息”膜肺的方法, 将气流量调到9~10 L·min-1, 持续约30 s, 吹出水分以改善氧分压;另一种方法是在排气孔连接1 个28 mmHg 的负压装置[24]。该患者通过“叹息”膜肺的方法迅速解决了膜肺冷凝水问题, 膜肺后血液迅速由暗红色转为鲜红色。③改善左心室淤滞。该患者ECMO辅助流量为2.8 L·min-1, 因为减低左心室后负荷而降低ECMO 流量将会导致氧供不足, 故在心率过快的情况下将反搏比例调整至1∶2 或更低, 使球囊充分放气, 有助于减轻心脏的后负荷, 改善左心室淤滞后患者心率下降后回调至1∶1。同时采用强心药物增加心肌收缩力。经治疗后患者自述呼吸困难明显缓解, 血压为110/80 mmHg, 脉 搏95 min-1, 呼 吸19 min-1, SpO2为95%。
心源性休克是一种复杂的、异质性的综合征, 复杂的基于团队的临床护理基础设施和高度专业化的临床医生可能改善患者预后[25]。ECMO 联合IABP 的及时应用可以为患者提供更有力的生命支持, 争取宝贵的治疗时间, 但同时也增加了并发症的发生率, 其应用管理复杂、难度大、风险高, 对医疗工作提出了更高的要求, 需要医护人员不断学习, 掌握相关并发症及其处理方式, 为患者提供更好的医疗服务。
——过敏性休克和肺水肿的抢救流程

