肾脏孤立性纤维性肿瘤并发肾盂积水1 例报告及文献复习
惠鹏祥, 杨 潇, 王 旭, 张 明, 范海涛, 于汇康, 王寅春, 赵 群, 汤高文, 李然伟
(吉林大学第二医院泌尿外科, 吉林 长春130041)
孤立性纤维性肿瘤(solitary fibrous tumor, SFT)是一种少见的间叶组织来源的成纤维细胞肿瘤。KLEMPERER 等[1]最早报道了SFT。随后STOUT 等[2]在1942 年 首 次 提 出 血 管 外 皮 瘤(hemangiopericytoma, HPC)的概念。随着研究的不断深入, 发现SFT 和HPC 在组织形态、免疫表型和生物学行为上均有重叠。世界卫生组织在2013 年将HPC 和SFT 统称为SFT。SFT 可发生在身体的任何部位, 最常见的发病部位是胸部。虽然在国内外已经报告了约212 例肾脏SFT 和(或)HPC, 但肾脏SFT 并发肾盂积水的报道罕见, 其临床表现和影像学表现与其他肾脏肿瘤相比缺乏特异性, 常通过体检偶然发现肾脏占位性病变, 经术后病理组织学特征和免疫组织化学染色确诊为肾脏SFT。手术切除是治疗肾脏SFT 的首选方法。本研究探讨1 例肾脏SFT 并发肾盂积水患者的临床特点并复习相关文献, 旨在提高临床医生对该疾病的认识。
1 临床资料
1.1 一般资料患者, 男性, 30 岁, 因体检发现左侧肾肿物并发肾盂积水3 d, 于2021 年10 月13 日入院。无肉眼血尿、腰部疼痛和腹部肿块等典型肾癌的临床表现, 亦无发热、高血压、血沉增快、高钙血症、高血糖、红细胞增多症、肝功能异常、消瘦、贫血、体质量减轻及恶病质等副肿瘤综合征表现。患者近期体质量无明显变化, 既往体健, 否认家族遗传病史和类似疾病史。体格检查:身高175 cm, 体质量77 kg, 体质量指数(body mass index, BMI)为25.1 kg·m-2。专科查体:双腰曲线对称, 双肾未触及, 双侧肾区无压痛和叩击痛, 双侧输尿管走行区无压痛, 膀胱区无隆起及压痛, 阴茎及阴囊部未见明显异常。其余各系统查体未见明显异常。
1.2 辅助检查超声检查结果显示:在左侧肾上腺区至肾门处探及1 个大小为9.6 cm×5.5 cm 的实性回声, 边界清楚, 左侧肾盂积水, 集合系统光点分离2.2 cm。进一步行双肾64 层螺旋CT 平扫+增强检查显示:左肾不规则肿块影, 呈分叶状, 边界尚清, 密度欠均匀(图1A), 增强扫描见皮髓质期软组织密度灶呈明显强化, 与肾皮质强化程度相仿, 实质期软组织强化程度低于肾实质, 低密度灶未见明显强化(图1B), 肿瘤大小为11.0 cm×7.0 cm×7.3 cm, 左侧肾盂肾盏扩张, 左肾占位性病变考虑左肾癌和透明细胞癌可能。入院后积极完善相关辅助检查:胸部CT 显示右肺中叶可见结节状高密度影, 长径约为4.5 mm;血常规:白细胞总数为10.7×109L-1, 中性粒细胞计数为7.1×109L-1, 单核细胞计数为0.8×109L-1; 肌 酐:91 μmol L-1;空 腹 血 糖:4.59 mmol·L-1;尿 常 规正常;其余检查未见异常。
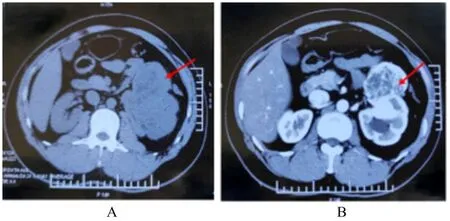
图1 肾脏SFT 并发肾盂积水患者的CT 影像Fig. 1 CT images of patient with renal SFT complicated with hydronephrosis
1.3 手术方法麻醉生效后, 常规留置F16 导尿管。患者取平卧位, 左侧垫高。常规消毒并铺巾。取上腹部正中“L”型切口, 上端至剑突下, 下端到脐至左侧腋前线, 长约20 cm, 逐层切开, 打开腹膜, 向内推开小肠, 于结肠外侧将结肠旁沟切开, 切断脾肾韧带, 显露肾脏。将结肠向内推开。显露肾蒂处, 分别游离出肾脏动静脉, 双重结扎肾脏动静脉后切断。于脂肪囊外仔细游离肾脏, 见肾脏与周围组织、腹膜、脾及腰大肌粘连较重, 游离输尿管, 将其结扎后切断。将肾脏完整游离后切除。仔细检查无活动性出血, 留置胶管引流1 枚。清点纱布和器械无误, 按解剖层次关闭切口, 敷料覆盖, 术终。手术过程顺利, 出血量约为100 mL, 输液1 500 mL。术终清点纱布和器械无误。患者无不良反应。完整切除的左肾和部分左侧输尿管组织行病理检查。
1.4 病理检查肉眼观察大体标本:肿块呈椭圆形, 肿物突向肾门区, 边界尚清楚, 部分表面似有纤维性假包膜形成, 体积为8.0 cm×5.5 cm×5.0 cm, 质地较硬, 切面灰白灰红, 质地细腻并富有弹性, 局部有囊性变, 未见坏死(图2)。
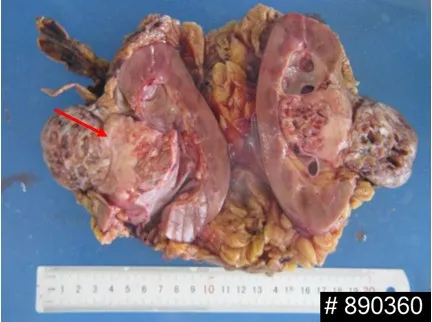
图2 左侧肾脏肿瘤大体形态表现(Bar=1.0 cm)Fig. 2 General morphology of left renal tumor(Bar=1.0 cm)
镜下检查:细胞丰富区和细胞稀疏区交替进行(图3A), 梭形细胞呈无结构性排列, 胞质少, 核染色质均匀(图3B), 无明显核异形性, 核分裂象约为1/10 HPF。细胞间富含胶原纤维, 间质薄壁血管呈鹿角状分布, 周围有梭形细胞围绕(图3C)。
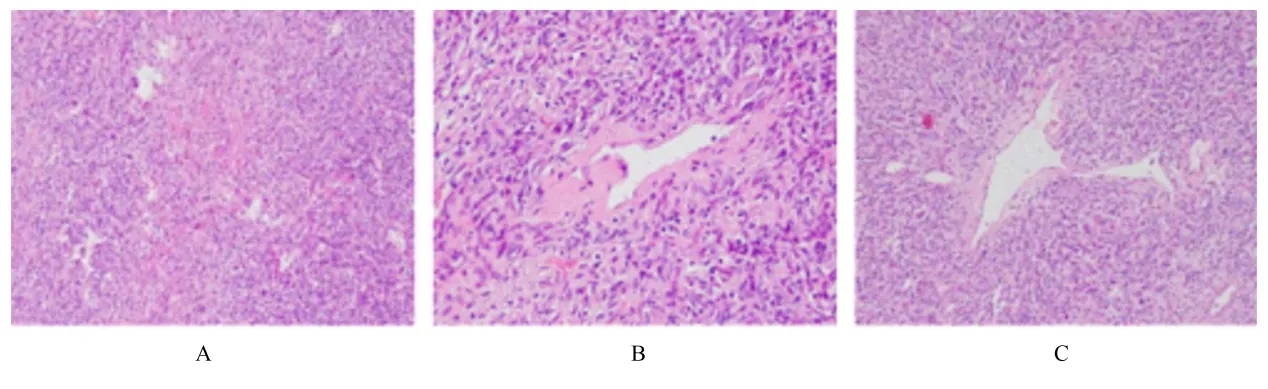
图3 HE 染色观察肾脏SFT 并发肾盂积水患者肿瘤组织病理形态表现Fig. 3 Pathomorphology of tumor tissue of patient with renal SFT complicated with hydronephrosis observed by HE staining
免疫组织化学染色检查结果:信号转导和转录激活因子6 (signal transducer and activator of transcription 6, STAT6)(+)(图4A)、CD34(+)(图4B)、Vimentin(+)、CD99(部分+)、Ki-67(阳性表达率为3%)(图4C)、TFE3(部分+)、SDHB (+)、TLE1 (部分+)、细胞角蛋白(cytokeratin, CK)(AE1/AE3)(-)、EMA(-)、CD10(-)、PAX-8(-)、S-100(-)、CAIX(-)、HMB45(-)、CK7(-)。
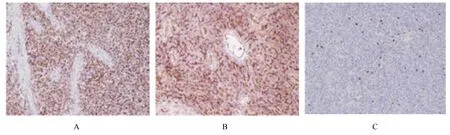
图4 肾脏SFT 并发肾盂积水患者肿瘤组织免疫组织化学染色结果(×100)Fig. 4 Results of immunohistochemical staining of tumor tissue of patient with renal SFT complicated with hydronephrosis (×100)
结合形态学特征和免疫组织化学染色检查结果支持肾脏SFT 诊断, 低危险, 肾门血管和肾周脂肪未见肿瘤, 输尿管断端未见肿瘤。术后患者恢复良好, 切口甲级愈合, 无并发症出院。
1.5 随访资料2021 年12 月6 日患者于本院门诊复查, 全腹CT 检查未见局部复发和转移的异常表现(图5)。术后3 个月电话随访患者无不适症状, 一般状态良好, 目前仍在密切随访中。
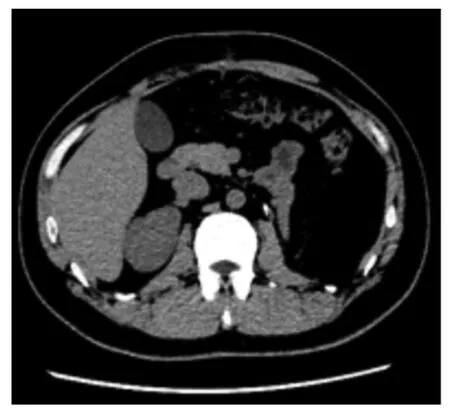
图5 肾脏SFT 并发肾盂积水患者术后CT 影像Fig. 5 Postoperative CT image of patient with renal SFT complicated with hydronephrosis
2 讨 论
SFT 是一种少见的间叶来源的成纤维细胞肿瘤, 患者发病年龄广泛, 无明显性别差异。SFT患者临床症状与发病部位有关, 胸膜是最常见的发病部位, 多表现为咳嗽、胸痛和呼吸困难;头颈部、脑膜、中枢神经系统、脊索、眼眶、上呼吸道、纵隔、肺脏、肝脏、鼻腔、副鼻窦、大唾液腺、腮腺、甲状腺、乳腺、胃肠道、腹膜后、盆腔、肾上腺、膀胱、前列腺、精索、睾丸和肾脏等胸膜外部位亦可发生SFT[3-4]。1996 年GELB 等[5]报道了首例肾脏SFT。肾脏SFT 可发生于肾包膜、肾实质和肾盂[6]。发生于肾脏者可出现肉眼血尿、腰部疼痛和腹部包块等症状, 但很少有患者出现副肿瘤综合征, 如肥厚性骨关节病(可能与血管内皮生长因子过度表达有关)和非胰岛细胞肿瘤低血糖(可能与胰岛素样生长因子Ⅱ的过度产生有关)等[7]。赵 大 华 等[8]报 道1 例 因“乏 力、出 汗、心慌、气短1 年, 以低血糖(血糖2.97 mmol·L-1)原因待查”而就诊的肾恶性SFT。肾脏SFT 的影像学无特征性表现, 多数患者通过体检在相应部位发现占位性病变, 且很难与其他肿瘤相鉴别, 确诊主要依赖形态学和免疫组织化学染色检查。该患者缺乏特异性临床表现, 未见明显阳性体征, 影像学无特征性表现, 仅表现为左肾占位性病变, 肿瘤压迫导致肾盂积水。
SFT 组织结构复杂、细胞形态学多样, 组织形态学特征性地表现为细胞丰富区和细胞稀疏区交替进行, 瘤细胞呈无结构性或无模式性生长, 细胞胞质少, 核染色质均匀, 无明显异型性, 核分裂象少见。细胞间有粗细不等的胶原纤维, 常伴有玻璃样变性。间质薄壁血管呈血窦样、裂隙样、树枝状或鹿角样相互连接成网, 周围有梭形肿瘤细胞围绕, 形成血管外皮瘤样结构[9]。免疫组织化学染色检查结果显示:细胞膜糖蛋白CD34 超过80%呈弥漫阳性表达, 但在分化差的区域CD34 阳性表达率降 低 甚 至 缺 失[10]; B 淋 巴 细 胞 瘤2 (B-cell lymphoma-2, Bcl-2) 在细胞质弥漫阳性表达;CD99 在 细 胞 膜 或 细 胞 质 呈 阳 性 表 达[11];CD34 阴性时, Bcl-2 和Vimentin 阳性表达有助于诊断。CD34、Bcl-2、CD99 和Vimentin 联合可提高SFT诊断准确率[9]。另外, SFT 肿瘤细胞结蛋白(Desmin)、CK、EMA/Actin 和S-100 表达一般呈阴性, 但CD34、bcl-2 和CD99 均缺乏特异性, 可表达于多种肿瘤。近年研究[12]显示:位于染色体12q13 区域编码神经生长因子诱导基因A 结合蛋白2(nerve growth factor induce gene A binding protein 2, NAB2)、STAT6 基因的反复体细胞融合是SFT 发生发展的重要驱动因素, 并认为该融合基因是SFT 的特异性标志物。最常见的融合变异体NAB2ex4-STAT6ex2/3 多见于较年长的患者, 好发于胸膜和肺的SFT, 常表现为良性行为;第2 种常见的融合变异NAB2ex6-STAT6ex16/17 常发生于较年轻人群, 多发生于深层软组织, 具有侵袭性的表型和临床行为[13]。NAB2-STAT6 融合基因导致STAT6 细胞核弥漫强阳性表达对于诊断SFT 和鉴别其他软组织肿瘤具有高度灵敏度和特异度[14]。该患者临床症状符合SFT 表现, 免疫组织化学染色 检 查 结 果 为STAT6 (+) 和CD34 (+)、Vimentin(+)和CD99(部分+), 因而确诊为肾脏SFT。
肾脏SFT 与肾细胞癌、肾嗜酸细胞腺瘤、肾盂癌、肾错构瘤、肾盂纤维上皮息肉、血管平滑肌脂肪瘤、纤维瘤、炎性肌纤维母细胞瘤(假瘤)、平滑肌瘤、良性纤维组织细胞瘤、良性外周神经鞘瘤(神经鞘瘤/神经纤维瘤)和肾脏混合上皮/间质瘤等肿瘤的临床表现及影像学表现缺乏特异性;其诊断和鉴别诊断主要依赖免疫组织化学染色中STAT6、CD34、Bcl-2、Vimentin 和CD99 的阳性表达结果。
肾脏SFT 并发肾盂积水患者的首选治疗方法是手术切除。术后辅助序贯轮换采用靶向药物对治疗SFT 有一定疗效, 而对靶向药物抵抗的患者对化疗有一定的反应性[7]。目前尚缺乏足够证据证明放疗的效果。
组织学表现与患者预后之间并不存在必然联系。既往研究者[15]认为恶性行为相关的组织病理学特征包括细胞核密集的细胞增多、细胞多形性、核分裂象(>4 个/10 HPF)、坏死、出血和高Ki-67 水平。但良性肿瘤发生复发和转移提示组织学和预后之间并非必然相关。SASAKI 等[16]报道1 例肾脏良性SFT 术后8 年发生肝转移和肺转移。肾脏SFT 最常见的转移部位是肺, 但有报道[17]显示肾脏是脑膜SFT 的常见转移部位。高达35%~45%的SFT 患者会发生转移扩散, 随着随访时间延长, 肿瘤发生转移和复发可能性更大[18-19]。BALDI 等[20]研 究 显 示:患 者5 年 无 转 移率为74%, 10 年无转移率低至19%。鉴于高转移率 和 复 发 原 因, DEMICCO 等[21]在2017 年 建 立 包括年龄、肿瘤大小、核分裂象和坏死的模型用以预测转移风险:年龄<55岁为0 分, 年龄≥55 岁为1 分;肿瘤直径<5 cm 为0 分, 5 cm≤肿瘤直径<10 cm 为1 分, 10 cm≤肿瘤直径<15 cm 为2 分, 肿瘤直径≥15 cm 为3 分;无核分裂象为0 分, 1≤核分裂象(个/10 HPF) ≤3 为1 分, 核分裂象(个/10 HPF)≥4 为2 分;肿瘤坏死面积<10%为0 分, 肿瘤坏死面积≥10%为1 分。总分=年龄得分+肿瘤直径得分+核分裂象得分+肿瘤坏死面积得分;总分0~3 分为低风险组, 总分4~5 分为中风险组, 总分6~7 分为高风险组。根据此模型, 本例患者评分为2 分, 属低风险组。为了研究影响局部复发和转移的因素, SALAS 等[22]采用患者年龄、肿瘤部位、核分裂象和放疗来预测个体的总生存率、局部复发和转移情况, 发现60 岁以下的患者总生存率和预后良好, 核分裂象数高的患者总体预后较差;而局部复发的影响因素包括脏器定位、放疗和患者年龄;另外单因素分析结果显示:患者年龄、核分裂象和坏死是影响肿瘤转移及复发的因素;多因素分析结果显示:核分裂数和肿瘤部位在肿瘤转移和复发率比较差异有统计学意义。基于SALAS 等[22]的研究, 该患者小于60 岁, 病变位于肾脏, 核分裂象约为1/10 HPF, 未行放疗, 因此具有较低的转移复发率, 但具有较高的局部复发率。由于SFT 组织学与肿瘤生物学行为的不完全一致性, 因此有必要对SFT 患者进行长期密切随访。
综上所述, 肾脏SFT 并发肾盂积水的发病率较低, 临床报道相对较少, 其临床表现和影像学表现缺乏特异性, 当检查发现肾脏占位性病变, 应考虑肾脏SFT 的可能。

