实时荧光定量PCR 法对ICU 患者痰液标本中鲍曼不动杆菌耐药基因的检测及其评价
马亚楠, 谭 兵, 徐 磊, 张健东
(1. 天津市第三中心医院检验科 天津市重症疾病体外生命支持重点实验室 天津市人工细胞工程技术研究中心 天津市肝胆研究所, 天津 300170;2. 天津市第三中心医院重症医学科, 天津 300170)
重症监护病房(Intensive Care Unit, ICU)是医院内病情危重患者的集中救治基地, 绝大多数患者病情严重、自身免疫功能低, 加上各种有创医疗救治措施和广谱抗菌药物的长期使用, 患者被细菌感染的风险大幅度上升。ICU 患者一旦发生医院感染, 其炎症控制非常困难, 不但延长了患者的住院时间、增加医疗费用, 更影响患者的生命安全[1]。鲍曼不动杆菌(Acinetobacter baumannii, AB)是一类革兰阴性、非发酵的条件致病菌, 生命力极强, 被公认为全球范围内医院暴发感染的新病因[2-3]。碳青霉烯类抗菌药物是治疗重症革兰阴性菌感染的一线药物[4]。近年来, 由于药物的广泛使用, 耐碳青霉烯类鲍曼不动杆菌(carbapenemresistantAcinetobacter baumannii, CRAB)的检出率已经高达70%, 为临床治疗带来巨大挑战[5]。目前认为产生碳青霉烯酶是导致细菌耐药的主要机制[6]。碳青霉烯类抗生素耐药菌株以产D 类酶, 又称苯唑西林酶(oxacillin-hydrolyzing, OXA)最常见, OXA-51 基因是鲍曼不动杆菌唯一的固有基因, 而OXA-23 基因为主要的耐药基因[7-8]。本研究采用实时荧光定量PCR (real-time fluorescence quantitative PCR, RT-qPCR) 法对ICU 患者的痰液标本进行检测分析, 评估耐药基因检测的应用价值, 为临床及时有效地选择抗生素提供依据。
1 资料与方法
1.1 标本来源、主要试剂和仪器选取天津市第三中心医院ICU 病房2019 年1 月—2021 年6 月送检的患者痰液标本, 共计285 份。本研究已获得本院伦理委员会批准。将送检标本分别进行传统培养鉴定和药敏试验及RT-qPCR 法耐药基因检测。培养所用血平板、巧克力平板和麦康凯平板购于济南百博生物技术有限公司, 全自动鉴定和药敏卡购于美国梅里埃公司, 鲍曼不动杆菌碳青霉烯类抗生素基因检测试剂盒(核酸抽提液、OXA-51 基因PCR 检测混合液、OXA-23 基因PCR 检测混合液、酶、阴性对照品和阳性对照品)购于宁波基内生物技术有限公司。VITEK MS 全自动微生物质谱检测系统和VITEK 2 Compact 全自动微生物药敏系统购于法国生 物 梅 里 埃 公 司, 罗 氏Cobas®Z480 全 自 动RT-qPCR 仪购于德国罗氏诊断有限公司。
1.2 细菌鉴定和药敏鉴定传统培养是细菌检出的金标准方法, 其过程包括细菌接种培养和细菌鉴定。将接收的合格痰标本接种于血平板、麦康凯平板和巧克力平板, 置于温箱培养;培养24 h 后从接种的平板中分离单个菌落, 并制备成0.5 麦氏浊度的菌悬液, 采用VITEK MS 全自动微生物质谱检测系统和VITEK 2 Compact 全自动微生物药敏系统进行菌种鉴定及药敏鉴定。
采用K-B 纸片法对亚胺培南和美罗培南的药敏情况进行鉴定。结果判定依据2019 版临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)指南[9]。CRAB 判定标准:亚胺培南或美罗培南至少一种碳青霉烯类抗生素耐药作为纳入标准。
1.3 耐药基因检测严格按照宁波基内生物技术有限公司“鲍曼不动杆菌耐碳青霉烯类抗生素基因检测试剂盒说明书”操作并进行核酸提取, 采用全自动RT-qPCR 仪扩增并进行耐药基因(OXA-51和OXA-23)检测分析。筛选出感染AB 的标本中OXA-51 基因阳性的标本, 根据其耐药基因OXA-23 分为OXA-23 基因阳性组和OXA-23 基因阴性组。
1.4 统计学分析采用WHONET 5.6 软件和SPSS 22.0 统计软件进行统计学分析。采用Kappa检验分析药敏鉴定法和耐药基因检测法的符合率, 符合率组间比较采用χ2检验, OXA-23 基因阳性组和OXA-23 基因阴性组标本耐药率组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 AB 和CRAB 检出率在285 份疑似AB 感染患者的痰标本中, 经传统培养方法鉴定出AB 的有151 株, AB 阳性检出率为52.98%;鉴定出CRAB的有109 株, CRAB 阳性检出率为38.25%;基因检测OXA-51 阳性为AB 的有155 株, AB 阳性检出率为54.39%; OXA-23 阳性为CRAB 的有108 株, CRAB 阳性检出率为37.89%。对碳青霉烯类药物产生耐药的AB 所占比例高达72.20%(109/151)。
2.2 CRAB 的药敏结果CRAB 对大多数药物普遍耐药, 其中耐药率较低的药物有米诺环素、头孢哌酮/舒巴坦、黏菌素和替加环素。CRAB 菌株抗生素药敏结果见图1。
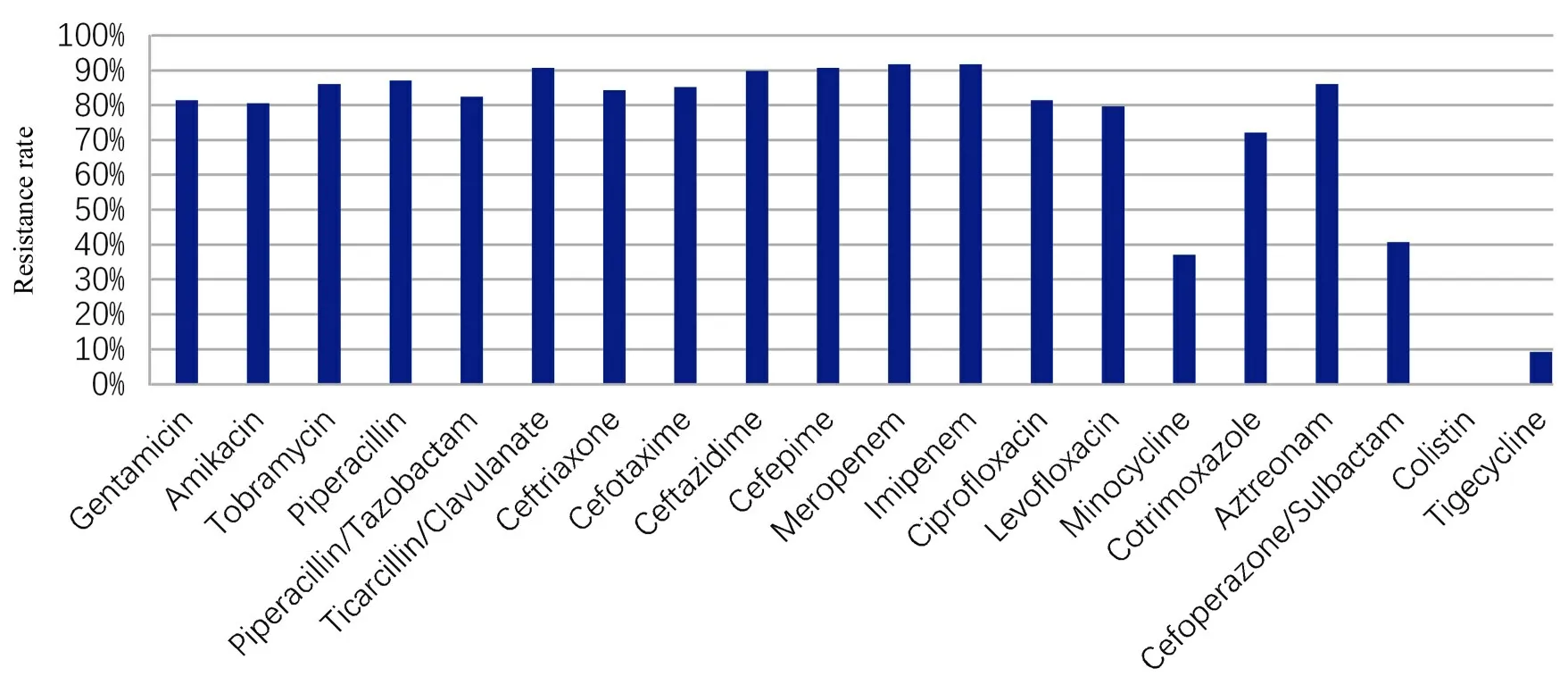
图1 CRAB 菌株抗生素药敏结果Fig.1 Antibiotic susceptibility results of CRAB strains
2.3 OXA-51 基因检测结果临床上通过检测OXA-51 基因阴阳性来判断是否为AB 感染, 如OXA-51 基因阳性则代表标本中存在AB。将传统培养鉴定方法的结果作为金标准, 评价OXA-51 基因检测结果的符合率。在传统培养鉴定为AB 感染的151 份标本中, OXA-51 基因阳性的有142 份;在鉴定结果并非AB 感染的134 份标本中, OXA-51基因阴性的有121 份。采用OXA-51 基因检测AB 的符合率为92.28%, 传统培养法和耐药基因检测法的阳性检出率比较差异无统计学意义(χ2=0.056,P>0.05);经Kappa检验分析, Kappa=0.845, 表明2 种方法的检测结果一致性较好。
2.4 耐药基因OXA-23 检测结果可通过耐药基因OXA-23 阴阳性来判断AB 是否耐药, 即是否为CRAB。故筛选出感染AB 标本中OXA-51 基因阳性的标本, 以此为研究对象, 将药敏试验结果作为金标准, 判断耐药基因OXA-23 检出CRAB 结果的符合率。在药敏试验鉴定为CRAB 的107 份标本中, 耐药基因OXA-23 阳性的有98 份;在鉴定结果AB 对碳青霉烯类药物敏感的35 份标本中, 耐药基因OXA-23 阴性的有25 份。采用OXA-23 基因检测CRAB 的符合率为86.62%。药敏鉴定法和耐药基因检测法的阳性检出率比较差异无统计学意义(χ2=0.703,P>0.05);经Kappa检验分析, Kappa=0.636, 表明2 种方法检测结果的一致性一般。尽管并非所有的CRAB 均携带OXA-23 基因, 但检测OXA-23 耐药基因方法的准确性较高。
2.5 OXA-23 基因阳性组和OXA-23 基因阴性组标本的药敏结果在108 株AB 感染OXA-23 阳性标本对米诺环素、头孢哌酮/舒巴坦、黏菌素和替加环素的耐药率较低。在34 株感染AB 的OXA-23 基因阴性标本中, 上述药物耐药率普遍较低。统计分析显示:AB 如果对碳青霉烯类药物, 如亚胺培南和美罗培南不产生耐药, 则大概率AB 对其他药物也不产生耐药现象, 即除庆大霉素外, 其他药物的耐药率均小于亚胺培南和美罗培南。见表1。

表1 OXA-23 基因检测与抗生素药敏结果的关系Tab. 1 Relationship between OXA-23 gene detection results and antibiotic susceptibility results
3 讨 论
AB 是一种普遍存在的条件致病菌, 是引起医院感染的重要病原菌之一。由于ICU 患者长期使用广谱抗菌药物和有创医疗救治措施, 其医院感染发生率是普通病房的5~10 倍, 预后也随之变差[10-11]。研究[12-13]显示:超过36%的医院获得性肺炎是由AB 感染引起的, 在重症监护病房中, 医院获得性感染的致病菌中, 由AB 引起的约占12%, 其中因AB 耐药引发的血流感染导致的死亡率高达58.2%~79.8%。AB 主要引起皮肤和软组织感染、伤口和血液感染及脑膜炎和呼吸机相关肺炎, 这是AB 引起的最常见也是最致命的感染[14]。
目前, 碳青霉烯类药物被临床广泛用于抗感染, 导致出现耐药菌, 包括多重耐药、泛耐药甚至全耐药。青霉素类和三及四代头孢菌素类抗菌药物耐药率均超过了60%, 碳青霉烯类(亚胺培南和美罗培南) 耐药率也超过了60%, 形势非常严峻[15]。近几年来, 本院ICU 病房中AB 对碳青霉烯类药物的耐药率由2014 年的63.1%升高至2020 年的80.3%。临床急需一种快速且准确的检测耐药菌的方法, 帮助医生及时诊断病情并合理选择抗生素, 从而延缓耐药菌的出现。
传统培养鉴定和药敏试验方法最大的缺点在于过程复杂、检测周期长, 一般临床上采用传统方法鉴定出CRAB 的周期约为3 d, 而RT-qPCR 法的检测周期为2~3 h。本研究结果显示:通过检测耐药基因OXA-23 鉴定CRAB 的结果与金标准方法的检测符合率为86.62%, 在保证准确性的前提下, 该方法最大的优势在于检测时间短, 这对于病情严重的患者来讲是非常可取的, 这种技术也应在临床中广泛应用。耐药基因检测和传统培养结果不一致的原因:①OXA-51 阳性标本中, AB 并非优势菌;②耐药基因的检测无法判断细菌的死亡情况;③OXA-51 基因可能存在于其他革兰阴性菌, 如粘质沙雷菌、铜绿假单胞菌和大肠埃希菌中, 但在上述细菌中OXA-51基因的检出率极低[16]。④OXA-23基因是CRAB 耐药的主要机制, AB 菌中还可能携带OXA-24 和OXA-58 基因。
本研究结果显示:CRAB 菌株对头孢哌酮/舒巴坦、米诺环素、替加环素和黏菌素的耐药率较低。这些药物将成为临床上治疗CRAB 感染的重要抗生素。头孢哌酮/舒巴坦是一类复合药剂, 头孢哌酮抗菌谱广, 但对β-内酰胺酶的稳定性较差;舒巴坦抑菌作用差, 两者复合抗菌效果成倍, 特别是对于能产生β-内酰胺酶的革兰阴性菌[17]效果更好。头孢哌酮/舒巴坦是目前临床上用于治疗AB感染的主要药物, 其抗菌效果显著, 可迅速减轻患者临床症状, 且价格较易被接受。但其长期大量使用时, 容易出现多种不良反应。米诺环素和替加环素属于四环素类抗生素。米诺环素目前仍是口服制剂, 只适用于胃肠动力恢复的患者, 且甲状腺损害严重, 有一定的局限性。替加环素属于米诺环素衍生物, 杀菌活性更强, 但会出现全身性不良事件和血栓性静脉炎等多种不良反应[18]。黏菌素对革兰阴性菌有极强的抗菌作用。研究[19]显示:黏菌素对CRAB 的耐药率非常低, 被认为是治疗CRAB感染的最后防线, 但其最大的局限性在于不良反应多, 且有很高的肾毒性和神经毒性, 且该药物价格高昂, 一般情况下不建议一线使用。临床医生用药往往不是单一用药, 每种药物均存在一定的缺陷, 如不稳定和抗菌效果差等, 为增强药物疗效并减少不良反应, 临床普遍采取联合用药的方式进行治疗。联合用药虽然可以增强药效, 但这种方式可能产生相反的结果。所以, 合理的联合用药方案(含药物种类、剂量和比例等) 还需要进行更深入的研究。
近年来医院内感染中, CRAB 的耐药率普遍达到70%左右, 呈泛耐药趋势。耐药菌的出现给医生用药带来巨大的挑战, 对于ICU 病房中病情严重的患者, 耐药菌的检测周期过长可能导致患者病情恶化, 影响生命健康安全。RT-qPCR 耐药基因检测可及时有效检测出AB 感染及其耐药性, 为医生指导临床用药提出建设性意见。目前临床医生常以头孢哌酮/舒巴坦联合替加环素作为经验性治疗CRAB 的一线药物, 但是尚无大量试验数据支持。为了控制“超级细菌”的出现, 应加强细菌耐药性检测, 制订抗菌药物使用规则, 规范临床医生用药方案, 严格依照药敏试验结果, 加强抗菌药物的合理使用, 避免临床治疗面临无药可用的境地[20]。

