基于自我报告的肿瘤化疗患儿发热性中性粒细胞减少风险预测模型的构建
李祎涵,沈南平,孙霁雯,何梦雪,阮海珊,赵康佳
(1.上海交通大学 护理学院,上海 200025;2.上海交通大学医学院附属上海儿童医学中心 护理部,上海 200127;3.上海交通大学医学院附属上海儿童医学中心 血液肿瘤科)
发热性中性粒细胞减少(febrile neutropenia,FN)的发生率为62.5%~83.0%,是儿童肿瘤最常见且预后最严重的治疗相关不良反应[1]。目前,国内外儿童领域预测FN发生的预测模型较少,亟待开发出适用于我国肿瘤患儿的FN预测模型。文献[2]表明,化疗增加了肿瘤患儿发生FN的概率,化疗后中性粒细胞呈周期性变化,但实际临床环境的常规实验室检测频率不能及时反映病情变化。借助患者自我报告工具能捕获更全面且微小的临床症状,能够呈现更详实、完整、持续的症状数据,并可用于居家评估。本研究旨在基于可及性高的临床变量与患儿自我报告类的症状性变量,建立FN发生风险的预测模型,以期能早期识别肿瘤化疗患儿FN的发生,并及早进行分层管理提供依据。
1 资料与方法
1.1 研究对象 采用前瞻性研究设计,便利抽样法选取2020年12月至2021年12月上海某儿童医院2个病区中进行化疗的肿瘤患儿为研究对象。纳入标准:(1)入院接受化疗的肿瘤住院患儿;(2)年龄7~18岁;(3)能进行自我报告;(4)患儿和家属同意参与调查。排除标准:(1)被诊断为有妨碍参与研究的精神状态;(2)有认知障碍或其他损害(如视觉障碍)者;(3)处于临终状态的患儿(生存时间≤6周)。本研究的Logistic多因素分析计划纳入12个预测因子,结合文献资料,化疗后肿瘤患儿FN的发生率约为70%[1],以及考虑10%~20%的样本流失,所需样本量至少为214,最终入组269例。
1.2 方法
1.2.1 研究工具 基于文献回顾及专家咨询结果筛选预测因子:(1)人口学资料或临床因素,包括性别、诊断、FN病史、中央静脉导管类型、抗生素的预防性使用情况、集落刺激因子的使用情况、有无输血、有无使用阿糖胞苷、首次化疗与诊断间隔时间、化疗预计持续时间、中性粒细胞减少持续天数等。(2)症状因素,采用中文版儿童报告版通用不良反应术语标准(pediatric patient-reported outcomes common terminology criteria adverse events,Ped-PRO-CTCAE)[3]评估。患儿被要求回答过去7 d内是否出现某个症状,每个症状从发生频率、严重程度以及对日常生活的影响程度进行评估[4]。本研究中的症状因素是由Ped-PRO-CTCAE(包含62种症状,130个条目)中挑选的疼痛、睡眠困难、口干、潮热等20个症状。该量表的Cronbach’s α系数为0.923。
1.2.2 FN的诊断 参考美国国立综合癌症网络的定义:发热是指口腔温度单次测量≥38.3℃或者≥38.0℃并持续1 h以上;而中性粒细胞减少指中性粒细胞<0.5×109/L或者中性粒细胞<1.0×109/L且预计在未来48 h内下降至<0.5×109/L。
1.2.3 资料收集方法 相关变量由研究者根据2020年12月至2021年12月上海儿童医学中心符合纳入标准的住院患儿完整的临床病理相关资料填写。按照临床上中性粒细胞减少的转归规律,中性粒细胞减少通常在化疗后第7天降至低谷,因此在化疗后7 d进行Ped-PRO-CTCAE的收集,由患儿独立完成。根据我院现有方案,每位患儿约接受2~10次化疗疗程,对入选患儿按1个化疗疗程计算为1个例次。本研究已通过本院伦理委员会批准(SCMCCIRB-K2021023-1)。
1.2.4 统计学处理 采用SPSS 25.0和 R Studio软件进行分析。根据既往研究[5]的经验,使用Ped-PRO-CTCAE频率、严重程度、对日常生活的影响程度3个维度的均值作为本研究的症状评分并将症状个数加入单因素分析的变量。符合正态分布的计量资料采用t检验,非正态分布的计量资料采用非参数检验中的Mann-WhitneyU检验。Cohen’sd为效应量,当d<0.2为小的效应,0.2~0.5为中等效应,d>0.5为大的效应。运用R软件绘制FN发生风险的列线图模型,内部验证采用bootstrap抽样,采用ROC曲线下面积对该模型对FN发生与否的区分能力进行评价。模型的区分度评价使用一致性指数(C-index)。采用Hosmer-Lemeshow 检验和校正曲线评价模型的校准度。
2 结果
2.1 肿瘤化疗患儿发生FN的单因素分析 两组患儿在性别、癌症类型、化疗预计持续时间、粒细胞缺乏持续天数等项目上的差异均有统计学意义(均P<0.05),见表1(仅列出差异有统计学意义的项目)。

表2 症状相关因素对肿瘤化疗患儿发生FN的单因素分析(分,
2.2 肿瘤化疗患儿发生FN的多因素分析 以化疗患儿是否发生FN为因变量,将单因素分析有统计学意义的变量,且Cohen’sd>0.5的3个症状作为自变量。经共线性检验,各因素容忍度(tolerance,TOL)均>0.1,方差膨胀因子(variance inflation factor,VIF)均小于10,各因素不存在共线性,经专业知识判断各因素间无交互作用。结果显示,在α=0.05检验水平下,性别、癌症类型、中央静脉导管类型、化疗预计持续时间、疼痛评分以及手脚无力评分是肿瘤化疗患儿发生FN的独立影响因素(均P<0.05),见表3。
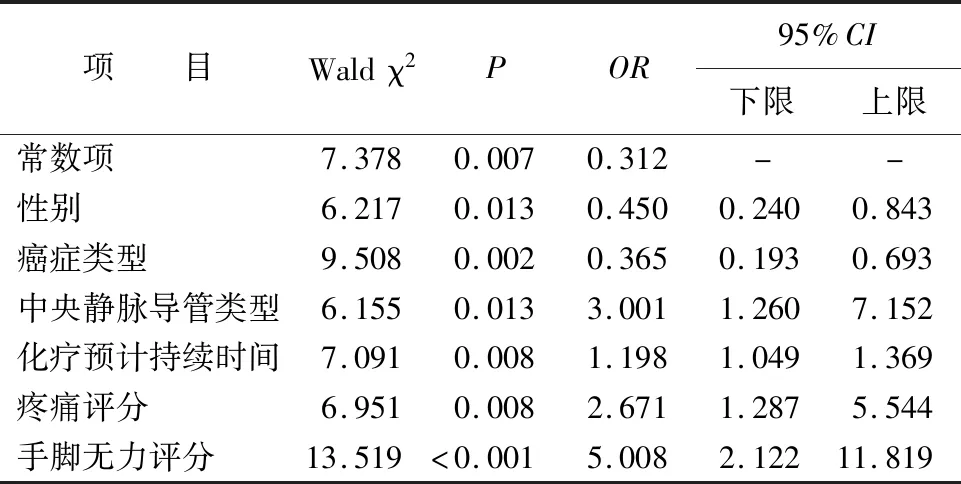
表3 肿瘤化疗患儿发生FN的多因素分析(n=269)
2.3 肿瘤化疗患儿FN风险预测模型列线图的构建及内部验证 将多因素分析得出的独立危险因素纳入R 4.0.2软件,构建列线图,见图1。根据每一个危险因素的分类或得分选择列线图相应的点,对应出该点的水平轴即为得分。总分是每个变量的分数相加得到的总和。最后,在所得总分位置向下画垂直线,其与“发生FN风险”坐标交点的数值即为肿瘤化疗患儿发生FN风险的预测概率。该模型的ROC曲线下面积为0.773(P<0.001),表明该模型的鉴别效度较好,见图2。采用Bootstrap自抽样法对列线图模型进行内部验证,得到的C-index为0.773>0.7[(95%CI(0.710,0.836)],表明该模型具有较好的区分度;Hosmer-Lemeshow检验结果显示,χ2为4.982(P=0.759),该模型预测FN发生风险与实际发生风险具有较好的一致性;且校正曲线表明预测和实际发生率的符合程度较好,拟合度较好。
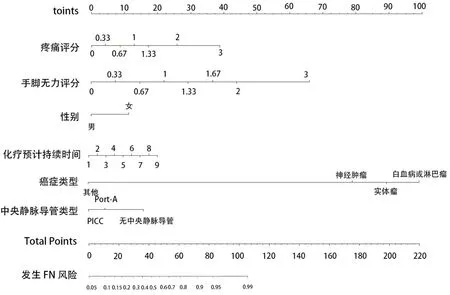
图1 肿瘤化疗患儿发生FN风险的列线图
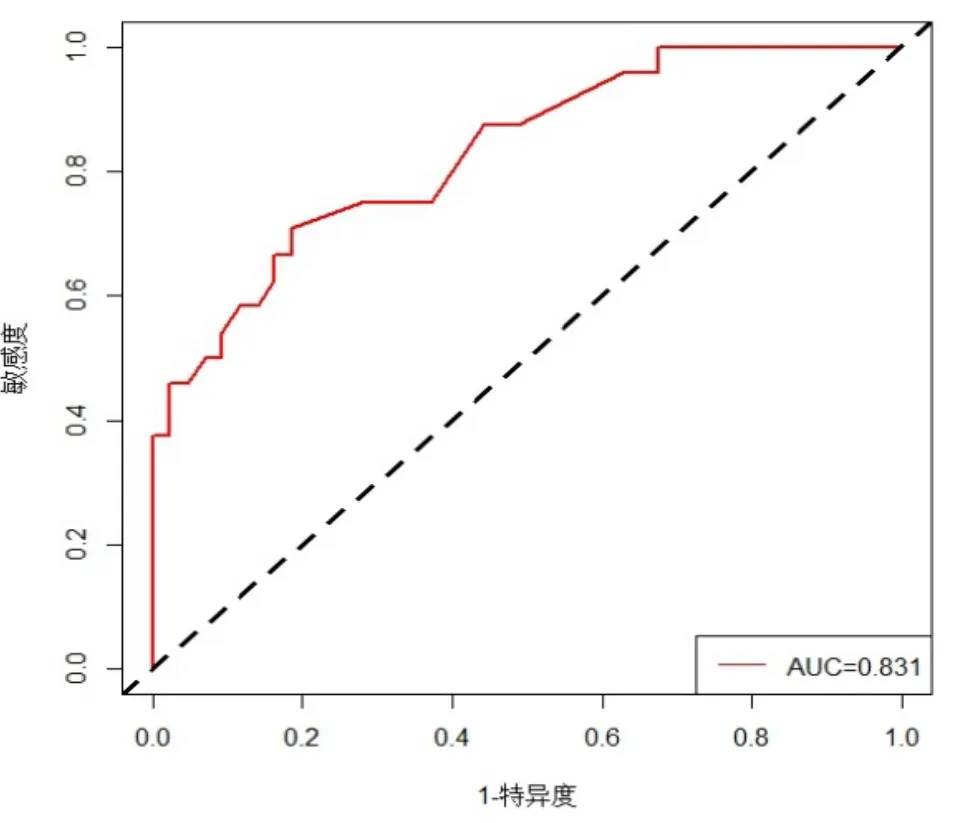
图2 构建的预测模型对肿瘤化疗患儿发生FN风险预测的ROC曲线
3 讨论
3.1 肿瘤化疗患儿发生FN的独立影响因素分析 本研究中,肿瘤化疗患儿FN的发生率高达32.3%,其中疼痛、手脚无力、性别、癌症类型、中央静脉导管类型、化疗预计持续时间是发生FN的独立影响因素。疼痛和手脚无力是发生FN重要的症状性预测因子。本研究表明,疼痛是肿瘤化疗患儿FN发生的独立影响因素。肿瘤患儿疼痛十分常见又易被忽视,目前已有研究[6]表明,肿瘤患者的疼痛可以引发一系列的病理生理改变,疼痛严重者与感染的发生具有相关性,从而增加肺部感染的发生率。本研究中,手脚无力这一症状的报告比例较高(18.6%),且与FN发生具有相关性。这提示研究者在进行儿童癌症领域的研究中应加强对这一关键症状的关注。研究[7]表明,患者出现疲乏感是病毒、细菌感染早期出现的前驱症状。由于肿瘤患儿活动量较低,对于疲劳的感受往往不明确,且儿童患者受限于表达能力,手脚无力的表述相较于疲劳更易理解且直观。性别、癌症类型、中央静脉导管类型、化疗预计持续时间这4个变量中,癌症类型、中央静脉导管类型、化疗预计持续时间与大多数国内外文献中总结的影响因素一致[8-9]。另外,有研究[10]表明,不同性别间在疼痛缓解、身体和情绪功能、不良事件等领域存在差异。本研究显示,男性患儿较女性患儿发生FN风险更高。
3.2 FN风险预测模型可为肿瘤化疗患儿护理工作提供指导 本研究发现,该模型经内部验证一致性和区分度较好。可视化的列线图可应用于预测肿瘤化疗患儿FN的发生风险,尤其是对于未使用经外周静脉置入中心静脉导管、化疗预计持续时间较长、癌症类型为白血病或淋巴瘤的男性患儿,可进一步使用患者自我报告工具量化FN发生相关的症状性影响因素,对于风险较高的患儿进行密切监测并采取积极的预防性护理措施。指南建议在FN发生风险高时使用集落刺激因子进行预防,由个体化的精准预测结果指导的集落刺激因子的合理使用,有助于避免集落刺激因子的使用过度与使用不足[11],且指南建议在出现FN后60 min内立即应用经验性广谱抗生素,患儿的早期风险预判能够实现高危患儿早期治疗[12]。通过患者自我报告的形式对症状进行量化在一定程度上弥补了在症状评估中主观、不充分的劣势,显示出传统的临床和实验室程序可能无法捕捉到的疾病早期指标的可能性[13],是临床实践中使用标准化、可比性的症状评估工具的首次尝试,有待进一步探索。
4 小结
本研究为单中心研究,建立的模型仅进行了内部验证,尚需大样本、多中心的临床研究进一步进行外部验证。且本研究为横断面调查性研究,只反映肿瘤患儿在化疗后7 d的不良反应发生情况,未来应借助症状管理应用程序,捕捉全时间段的症状,在考虑多种因素的基础上,精准报告整个化疗周期的动态变化,基于整个化疗周期不良反应的变化轨迹进行判断。从总体上来讲,该预测模型可为护理人员对肿瘤化疗患儿FN的发生风险的评估提供一定的参考。基于此,有助于未来临床实践中对有FN风险的患儿密切观察并采取更为积极的预防性护理措施,从而在更为前置的时间上降低患儿FN发生及进展,改善患儿结局。

