简易测压装置在经皮肾镜碎石术治疗上尿路结石中的应用研究
高龙,王珏,孙绍琼,吴勇,白冰,母健君,张天德,雷弋
(攀枝花市中心医院泌尿外科,四川 攀枝花 617067)
0 引言
泌尿系统结石是泌尿外科常见病之一,其治疗方式多种多样,其中经皮肾镜取石术(percutaneous nephrolithotomy PCNL)是一种常见术式[1]。近年来,PCNL不断发展,基本已经取代了传统开放性手术,几乎所有肾结石及输尿管上段结石都可以用PCNL治疗。随着碎石设备的不断进步及术者的技术不断提高,PCNL技术趋于微创化,例如减小穿刺口及穿刺通道直径等。虽然该术式对人体创伤较小,但术后仍不可避免出现全身炎症反应综合征(systemic inflammatory response syndrome SIRS)等感染性并发症[2]。虽然SIRS发生率低但致死率高。之前研究发现,术后SIRS与术中肾内压力(renal pelvic pressure RPP)持续增高密切相关。但如何简易且准确的测得术中RPP以及引起术后SIRS的RPP临界值一直是泌尿外科医师思考的问题[3,4]。尽管近年来有很多体外模型及动物实验研究表明,当肾盂内压力明显增高时会出现体液吸收甚至改变肾脏内部结构,但关于PCNL术中测压装置国内外报道较少,关于术中RPP与术后早期炎症指标变化的关系以及引起术后SIRS的RPP临界值仍无明确报道。
1 材料与方法
1.1 患者入组
选取攀枝花市中心医院泌尿外科收治的上尿路结石123例为研究对象,随机分为试验组62例和对照组61例。试验组年龄(38.2±8.8)岁,男性34例,女性28例;对照组年龄(41.3±11.2)岁,男性32例女性29例。研究对象的纳入标准:①均经泌尿系B超、KUB、肾CT等检查确诊;②术前尿培养证实无泌尿系统感染;③肾结石长径为l~3cm;④体外冲击波无法粉碎及治疗失败的结石;⑤输尿管上段第4腰椎以上、梗阻较重或长径>1.5cm的大结石;⑥输尿管上段结石息肉包裹及输尿管迂曲,体外冲击波碎石无效或输尿管镜手术失败;⑦特殊病人的肾结石,包括:小儿及肥胖病人的肾结石;萎缩肾、无积水肾、感染性肾结石;脊柱畸形无法摆俯卧位的患者可在健侧卧位碎石。研究对象的排除标准:①不愿意参加该临床试验或者不能签署知情同意书的患者;②术中过度出血(鞘中引流液为鲜红色)或合并集合系统广泛严重损伤穿孔;③未纠正的全身出血性疾病或正在使用抗凝药物,凝血功能异常的患者;④重度糖尿病、高血压者、严重心脏病和肺功能不全,无法承受手术者;⑤肾结石合并输尿管远端结石梗阻;盆腔肾易游走,穿刺困难,为相对禁忌证。剔除标准:由研究者向所有符合纳入条件的患者详细告知病情、备选治疗方案,在征得患者及家属同意后,签署相关知情同意书。具体纳入和剔除标准如下:①患者经临床评估符合PCNL手术适应证,无明确禁忌证,且同意行手术治疗者。②入组后随机分为实验组和对照组,其中实验组使用4Fr输尿管导管,对照组使用5Fr输尿管导管。③患者在术后复查发现肾或输尿管残留结石后行体外冲击波碎石或输尿管镜碎石术,并剔除本研究。
1.2 手术及测压
采用气管内全麻。患者先取截石位,输尿管镜下在导丝引导下插入剪去头端的输尿管导管(试验组安置4Fr输尿管导管,对照组安置5Fr输尿管导管),导管尖端位于肾盂,留置尿管,改俯卧位。通过压力传感器连接Mindray PM9000型监护仪之IBP通道与原逆行置入肾集合系统的输尿管导管,彩超定位确定输尿管导管末端位于肾盂,将压力传感器固定在肾盂平面。使用生理盐水排空连接管内的气体,拨转压力传感器连接部三通使压力传感器同大气相通,测压系统校零,再拨转压力传感器连接部三通使压力传感器与输尿管导管相通,IBP系统即可测量肾盂内压。通过数据线将监护仪数据输出端口同笔记本电脑连接,并运行数据采集软件,即可每秒钟采集一次数据,并将数据导入计算机数据库。
1.3 观察指标
(1)手术学评价:手术时间,穿刺通道数量,穿刺通达大小,术后留置肾造瘘管数量。(2)术后SIRS发生率:以下四个标准中的任何两个及以上:白细胞计数<4000或>12000个细胞/uL,体温>38℃或<36℃,心率>90/min,呼吸频率>20次/min或PaCO2<32mmHg。(3)感染性指标(术后即刻及第3、5天):降钙素原(PCT)、C反应蛋白(CRP)、血白细胞计数(WBC)、血中性粒细胞计数(N)。
1.4 统计学方法
相关研究数据均使用SPSS软件进行统计分析。计量资料以均数±标准差表示,计数资料以率或秩和检验,P<0.05视为差异有统计学意义。
2 结果
2.1 手术学评价
试验组手术时间明显长于对照组(45.81±19.43 vs 39.23±14.51)min,而肾盂内压明显低于对照组(16.24±4.84 vs 21.32±5.51)mmHg,且差异有统计学意义(P<0.05)。穿刺通道数和术中出血量两组差异无统计学意义(P>0.05),表1。
表1 两组手术学相关指标比较(±s)

表1 两组手术学相关指标比较(±s)
组别手术时间(min)穿刺通道数(个)肾盂内压(mmHg)术中出血量(mL)试验组45.81±19.431.22±0.2316.24±4.8456.24±11.23对照组39.23±14.511.18±0.2121.32±5.5155.34±10.34 t/chi-square2.131.275.340.46 P 0.040.210.010.64
2.2 术后SIRS发生率
试验组62例,发生SIRS者7例,发生率为11.3%,对照组61例,发生SIRS患者13例,发生率为21.3%,对照组SIRS发生率显著高于对照组,且差异有统计学意义(P<0.05)。
2.3 感染性指标
术后试验组降钙素原(PCT)、C反应蛋白(CRP)、血白细胞计数(WBC)分别为(1.12±0.21)ng/mL,(12.42±4.42)mg/L和(12.34±3.23)×109/L,显著低于对照组(1.53±0.23)ng/mL,(16.42±4.55)mg/L和(×109/L),且差异有统计学意义(P<0.05),表2。
表2 两组患者治疗后血清降钙素原(PCT)、C反应蛋白(CRP)、血白细胞计数(WBC)比较(±s)

表2 两组患者治疗后血清降钙素原(PCT)、C反应蛋白(CRP)、血白细胞计数(WBC)比较(±s)
组别降钙素原(ng/mL) C反应蛋白(mg/L)血白细胞计数(x109/L)试验组1.12±0.2112.42±4.4212.34±3.23对照组1.53±0.2316.51±4.5515.12±4.44 t/chi-square10.339.873.97 P<0.001<0.001<0.001
2.4 降钙素原(PCT)、C反应蛋白(CRP)、血白细胞计数(WBC)预测SIRS
分别以下PCT、CRP和WBC为参考,预测SIRS的敏感性分别为77.05%、73.77%和70.49%,特异性分别为78.56%、67.74%和66.89%,(表3)。ROC曲线下面积分别为0.84、0.74和0.71,图1。
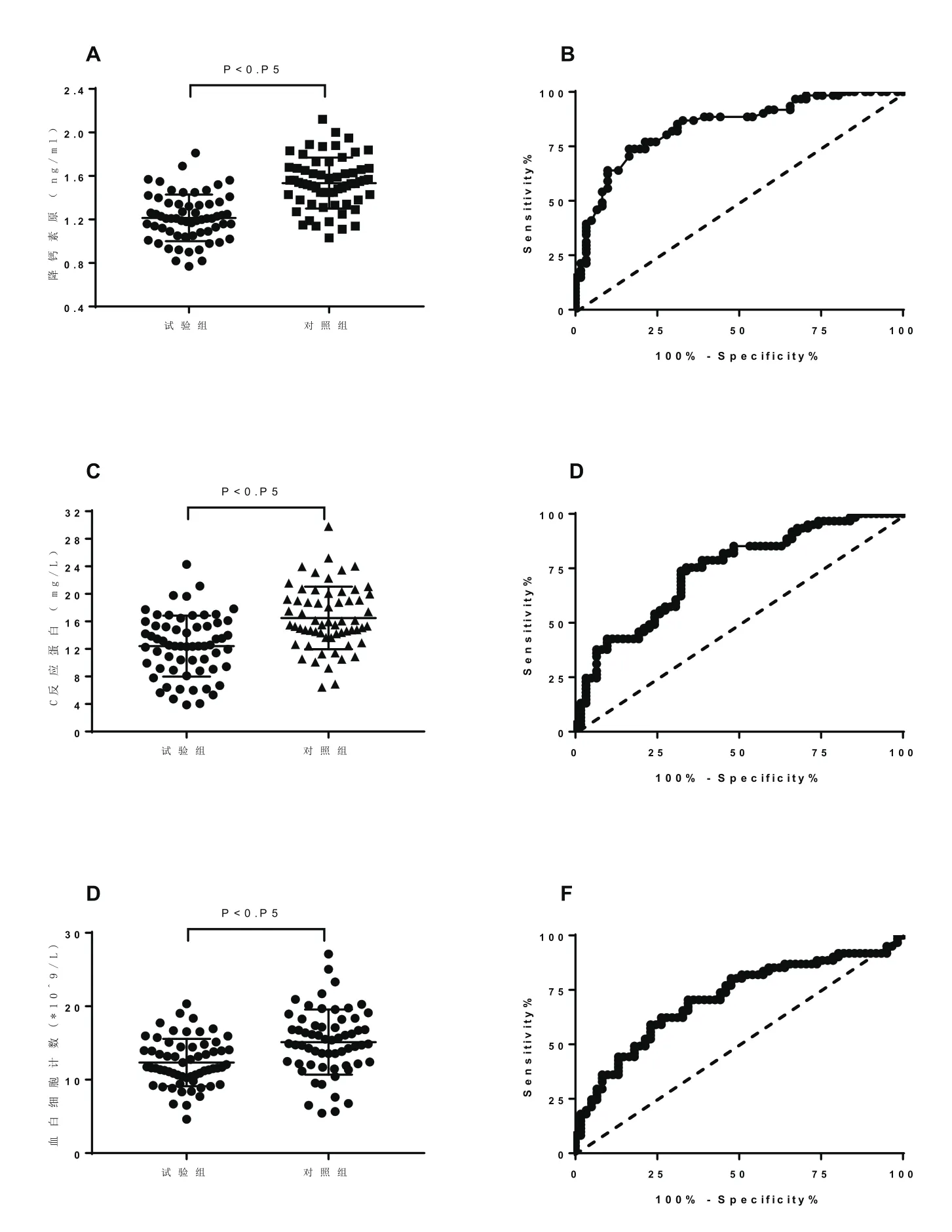
图1 降钙素原(PCT)、C反应蛋白(CRP)、血白细胞计数(WBC)预测SIRS价值

表3 降钙素原(PCT)、C反应蛋白(CRP)、血白细胞计数(WBC)预测SIRS敏感性和特异性及ROC曲线下面积AUC
3 讨论
泌尿系统结石是泌尿外科常见病之一,在泌尿外科住院病人中占据首位,近年来,我国泌尿系统结石发病率有增加趋势。一项流行病学显示,我国肾结石患病率达6.4%[5]。近年来,由于碎石设备的发展,开放性手术已基本被微创手术取代,与开放性手术相比,虽然微创手术对患者创伤较小,但仍有侵入性,术后仍有较多并发症,而并发症的出现不可避免会延长住院时间、增加住院费用。
目前对于2cm以上的肾结石首选手术方式为经皮肾镜取石术(percutaneous nephrolithotomy PCNL)[6]。随着PCNL的逐渐开展,术后早期感染性并发症不断增加引起了我们的注意。大部分学者认为,术后早期感染性并发症的出现与术中肾盂内压力密不可分。Loftus等[7]通过对猪模型中进行了模拟PCNL手术的研究发现,术中高RPP会导致细菌通过淋巴回流、肾盂内破裂的小血管进入血流,从而出现肾外器官的细菌感染率以及血培养阳性。一项评估灌注压力对PCNL术后全身炎症反应综合征(Systemic inflammatory response syndrome SIRS)影响的随机单盲临床试验[8]表明,术中持续高压灌注会明显增加术后SIRS的风险,尤其是在感染并发症发生风险较高的患者中更易出现,并且建议在PCNL术中应尽可能降低灌注压力,或使用间歇性高压灌注。PCNL术中需要灌注液的冲洗以达到廓清视野的目的,因此在操作过程中常常需要增加灌注流量(irrigation flow IF)及灌注压力(irrigation pressures IP),这就导致术中RPP剧烈波动,有研究发现,PCNL术中RPP最高可达300mmHg。一般来说,人体正常肾盂内压在1.47至4.41 mmHg之间变化,任何引起术中灌注压力升高及灌注液引流不畅的因素常常会导致不同程度的肾损伤、体液反流、尿外渗、尿源性脓毒血症、感染性休克甚至死亡等严重并发症[9]。而术中RPP过低又会降低灌注液对开放性小静脉的压迫作用,导致术中出血量增加,视野变差,进而影响手术进程,增加术后残石率[10]。因此,探究监测术中RPP的方法、明确引起术后感染性并发症的RPP临界值以及如何降低术后早期因高RPP引起的感染性并发症发生率具有重要意义。
为减少PCNL术后感染性并发症,术中监测RPP以及降低术中RPP的方法近年来成为研究热点。Alsyouf等[11]提出了一种监测术中RPP的方法,即术中将压力传感器连接至输尿管软镜,经尿道逆行性插入软镜镜体至肾盂,通过输尿管软镜辅助行PCNL。但这种方法过于复杂,且实用性较低,虽然PCNL期间的输尿管软镜可直接测量肾盂内压力,但输尿管软镜镜体较粗,在一定程度上堵塞流出道,这可能会使测得的RPP偏高。国内方面,一项新型RPP监测专利的临床应用研究引起了我们的注意。其测压设备由一个配有压力传感器和负压吸引装置的穿刺通道鞘和压力控制平台组成,可即时将RPP反馈至控制平台,并且可通过调节灌注液的冲洗速度控制RPP。但该项研究中所使用的测压装置价格较昂贵,不适宜推广,并且文章作者亦指出该项研究为回顾性描述性研究,没有严格设计空白组及实验组,未将其安全性和可行性与传统技术进行比较。目前关于术中RPP的监测尚处于探索阶段,所知关于术中监测RPP的国内研究较少且可靠性较低。综上,如何能准确、简便且灵敏的监测术中RPP仍需进一步探究。
本研究临床实践中致力寻找一种简便且可靠的监测方法。钟文等[12]对112例微创经皮肾镜取石术(minimally invasive percutaneous nephrolithotomy MPCNL)术中肾盂内压进行测量,认为术后发热与术中增高的肾盂内压密切相关,其监测方法是将压力传感器与逆行性置入肾集合系统的输尿管导管(5Fr)连接从而测得术中RPP。这种方法较为简便,但该研究设计的输尿管导管较粗,文章中并未分析输尿管导管造成的流出道相对梗阻引起的测量误差,没有明确定义引起术后感染性并发症的RPP临界值,也未说明术中RPP变化与术后感染性并发症的关系。
目前普遍认为术后SIRS是败血症的初始反应,而目前国内在PCNL中关于感染性指标的研究多集中于术前对于术后SIRS预测作用,对术后感染性指标变化趋势的研究相对较少[13]。Zahorec R等[14]人认为中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR),可以反映全身的炎症反应。Jilma等[12]人则认为机体出现炎症反应时,中性粒细胞计数会增加。在炎症消退期间,中性粒细胞会降低,因此我们将中性粒细胞计数术后5天变化趋势纳入研究,用此代表术后人体内炎症反应变化情况。
在本研究中,术前患者取截石位,输尿管镜下在导丝引导下插入剪去头端的4Fr输尿管导管,导管尖端位于肾盂。输尿管导管体外以三通连接压力感受器及生理盐水,通过输尿管导管逆行注入生理盐水造成人工肾积水,留置尿管后改俯卧位。压力感受器连接监护仪动脉血压监测通道,实时监测肾盂内压力变化,监护仪每秒收集RPP值。该监测方法中涉及到逆行性插入输尿管导管为常规术前准备,并不增加对患者的创伤,且监测装置位于体外,实时显示于监护室屏幕,可对术者术中操作起到指导作用。研究发现,试验组手术时间明显长于对照组(45.81±19.43 vs 39.23±14.51)min,而肾盂内压明显低于对照组(16.24±4.84 vs 21.32±5.51)mmHg,且差异有统计学意义(P<0.05)。穿刺通道数和术中出血量两组差异无统计学意义(P>0.05);试验组62例,发生SIRS者7例,发生率为11.3%,对照组61例,发生SIRS患者13例,发生率为21.3%,对照组SIRS发生率显著高于对照组,且差异有统计学意义(P<0.05);分别以下PCT、CRP和WBC为参考,预测SIRS的敏感性分别为77.05%、73.77%和70.49%,特异性分别为78.56%、67.74%和66.89%。ROC曲线下面积分别为0.84、0.74和0.71。因此我们认为,更细的输尿管导管(Fr4)能够明显降低肾盂内压,从而减少SIRS发生风险。但研究纳入患者例数较少,随访时间较短,统计学效能不高,需要进一步大样本研究证实。

