高效液相色谱-串联质谱法测定水产鱼类中的角黄素与叶黄素
◎ 彭名军,刘春生,毛新武,周庆琼,戚 平,林子豪,曾豪威
(广州市食品检验所,广东 广州 511400)
角黄素与叶黄素是类胡萝卜素中应用较为广泛的着色剂,具有类胡萝卜素特有抗氧化作用[1-2],广泛应用于医药、食品、饲料等方面[3]。养殖人员可能在饲料中添加角黄素与叶黄素,特别是在产蛋禽类和有色水产品(如黄骨鱼、观赏鱼)的养殖过程中添加,可改善禽类皮肤或禽蛋蛋黄的颜色和有色水产鱼类皮肤的颜色,提高其商品价值。角黄素易蓄积在人体视网膜上,长期摄入会引起视网膜的损伤[4]。1995年,联合国粮农组织和世界卫生组织联合食品添加剂专家委员会(Joint FAO/WHO Expert Committee on Food Additives,JECFA)制定了角黄素可接受的每日最大摄入量为0.03 mg·kg-1(按体重计)[5]。2006年,日本“肯定列表制度”规定禽蛋等动物源性食品中角黄素最大残留量为0.1 mg·kg-1[6]。目前我国尚未对动物性食品中角黄素和叶黄素的残留制定限量标准,但《饲料添加剂品种目录(2013)》规定,角黄素只允许在家禽养殖过程中使用,不允许在水产养殖过程中使用。天然叶黄素允许在家禽和水产养殖过程中使用。角黄素或叶黄素的检测方法主要有高效液相色谱法[7-13]、高效液相色谱质谱法[6],同时测定角黄素与叶黄素的检测方法较少。本研究采用高效液相色谱串联质谱法,对有色鱼类皮肤组织中角黄素与叶黄素的检测方法进行研究,建立一种同时测定水产鱼类中角黄素与叶黄素的测定方法。
1 材料与方法
1.1 材料与设备
角黄素标准品(CAS:514-78-3),纯度≥99.8%(上海安谱实验科技股份有限公司);叶黄素标准品(CAS:514-78-3),纯度>90%(上海源叶生物科技有限公司);乙腈(色谱纯,美国Thermo Fisher Scientific 公司);甲醇(色谱纯,美国Thermo Fisher Scientific公司);乙酸(LC/MS级,美国Thermo Fisher Scientific公司);2,6-二叔丁基对甲酚(BHT),纯度≥99.0%(上海安谱实验科技股份有限公司)。
Q Exactive™ LCMS-U3000高效液相色谱-串联质谱仪,配电喷雾离子源(美国Thermo Fisher Scientific公司);Allegra X-30R离心机(美国贝克曼公司);旋涡振荡混合器(美国Thermo Fisher Scientific公司)。
1.2 试验方法
1.2.1 溶液配制
角黄素标准溶液(0.1 mg·mL-1):准确称取2.5 mg角黄素标准品,用乙腈溶解并定容至25 mL,-20 ℃保存。
叶黄素标准溶液(0.1 mg·mL-1):准确称取2.5 mg叶黄素标准品,用乙腈溶解并定容至25 mL,-20 ℃保存。
0.1%BHT-乙腈溶液:准确称取0.1 g BHT标准品,用100 mL乙腈溶解,混匀。
角黄素、叶黄素混合中间液(10 μg·mL-1):分别准确吸取角黄素、叶黄素标准溶液各1.00 mL,用0.1%BHT-乙腈溶液定容至10 mL,混匀。
角黄素、叶黄素混合工作液:准确吸取一定体积的角黄素、叶黄素混合中间液,用0.1%BHT-乙腈溶液配制标准系列溶液,现配现用。
1.2.2 样品处理
试样制备:取一定量鱼皮组织,切碎后混合均匀,置于-20 ℃冰箱中储存。
样品提取:准确称取2.50 g样品,加入10 mL提取溶剂0.1%BHT-乙腈,涡旋振荡5 min,8 000 r·min-1转速离心5 min,上清液转移至25 mL比色管中,重复提取一次,合并提取液,用提取溶剂定容。取0.5 mL提取液至10 mL比色管,用提取溶剂定容,摇匀后过0.22 μm滤膜,上机待测。由于角黄素、叶黄素对光与温度敏感,实验保持在避光且温度不超过35 ℃的环境下进行。
1.2.3 高效液相色谱-串联质谱条件
(1)液相条件。色谱柱:Thermo Fisher Accucore aQ(150 mm×2.1 mm,2.6 μm);流动相A为0.1%乙酸水(含10%甲醇),流动相B为0.1%乙酸-甲醇;A∶B=1∶19等度洗脱;柱温:30 ℃;进样量:5 μL;流速:0.3 mL·min-1。
(2)质谱条件。采用电喷雾电离源(ESI)正离子电离模式,喷雾电压3.5 kV,鞘气流速45 L·min-1,辅助气流速15 L·min-1,离子传输管温度320 ℃,喷雾器温度350 ℃,采用PRM模式,分辨率为17500。角黄素和叶黄素质谱参数见表1。

表1 角黄素、叶黄素质谱参数表
2 结果与分析
2.1 流动相的选择
角黄素与叶黄素不溶于水,易溶于有机溶剂。本实验分别选取甲醇、乙腈为有机相,0.1%乙酸水、5 mmol乙酸铵为水相,进行两两组合试验,具体组合见表2。角黄素与叶黄素在4组流动相体系下的色谱图见图1和图2。

图1 角黄素在4组流动相体系下的色谱图

图2 叶黄素在4组流动相体系下的色谱图

表2 4种流动相组合试验表
对于角黄素,上述4种流动相的不同组合对其峰形的影响无显著差异。对于叶黄素,使用乙腈作为有机相,相对于使用甲醇时,峰形明显变宽,甚至出现3头峰的情况。使用0.1%乙酸水或5 mmol乙酸铵作为水相,对叶黄素峰形的影响无显著差异,因此选择容易配制且对色谱柱更友好的0.1%乙酸水。同时,为抑制水相中微生物的生长,在0.1%乙酸水中添加10%甲醇。为稳定流动相整体的pH值,在有机相中加入与水相相同体积的0.1%乙酸。
2.2 流动相的比例研究
本实验分别研究梯度洗脱与等度洗脱对角黄素与叶黄素峰形的影响。采用等度(水相比例分别尝试5%和10%)与梯度(水相比例为0~3 min,100% ~ 10%;3~ 10 min,10%;10~ 13 min,10%~100%)两种方式分别进行洗脱,实验结果表明,使用高比例有机相等度洗脱,化合物的峰形与梯度洗脱无差异,无其他杂质干扰,而等度洗脱化合物出峰时间早,分析时间更短,故本实验流动相的比例为0.1%乙酸水(含10%甲醇)∶0.1%乙酸甲醇=5%∶95%。
2.3 进样量的选择
进样量的大小影响化合物的最低检测浓度,同时影响化合物的峰形(见图3、图4)。

图3 角黄素在不同进样体积下的色谱图
本实验对浓度为100 μg·L-1的角黄素与叶黄素标准溶液,分别进样 1 μL、2 μL、5 μL、8 μL 和 10 μL,比较研究化合物色谱峰的峰形。结果表明,角黄素与叶黄素的色谱峰均随着进样体积的增大而变宽,特别是叶黄素进样体积为8 μL时,其峰宽是进样体积为5 μL时的2倍,如图4。因此,综合考虑化合物色谱峰峰形,选择较高进样体积以降低仪器对化合物的最低检测浓度的影响,本实验选择进样量为5 μL。

图4 叶黄素在不同进样体积下的色谱图
2.4 基质效应研究
选取罗非鱼、红鱼、金鲳鱼等3种水产鱼类的提取液作为空白基质,分别用纯乙腈溶剂、空白基质原液、空白基质原液的10倍、20倍、50倍、100倍稀释液,配制 10 μg·L-1、20 μg·L-1、50 μg·L-1、80 μg·L-1、100 μg·L-1的角黄素与叶黄素系列溶剂标准溶液和基质标准溶液,分别绘制溶剂标准曲线和基质标准曲线。通过分别比较不同水产鱼类基质、同一水产鱼类不同稀释倍数基质的标准曲线斜率与溶剂标准曲线斜率的比值,分别研究不同水产鱼类基质的基质效应差异和同一水产鱼类不同稀释倍数基质的基质效应变化规律,确定能够消除基质效应的最优稀释倍数。
基质效应(Matrix effect)计算公式为

式中:X为基质效应;bs为溶剂标准曲线斜率;bm为基质标准曲线斜率。
实验结果如图5和图6所示,角黄素与叶黄素在3种水产鱼类提取液基质原液中均表现出较强的基质抑制效应,2种化合物离子响应抑制率在-98%~-37%。随着基质原液稀释倍数的增加,基质抑制效应明显减弱,在20倍稀释倍数时减弱趋势变小,渐趋平稳,基质效应基本保持在-25%~+20%。因此,为减少基质效应对检测结果的影响,本实验样品提取液稀释倍数为稀释20倍。

图5 角黄素在3种水产鱼中的基质效应图
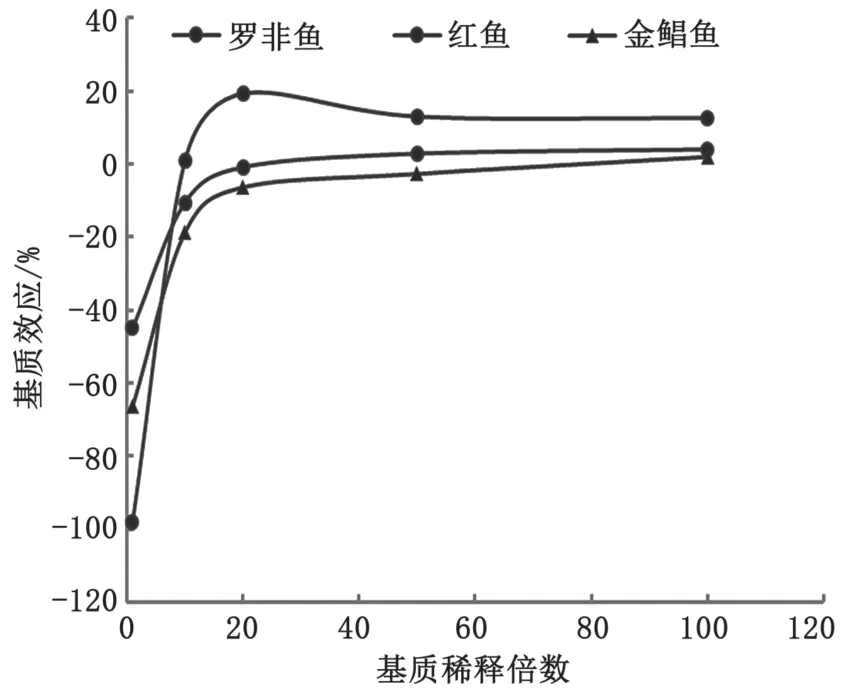
图6 叶黄素在3种水产鱼中的基质效应图
2.5 方法验证
2.5.1 线性范围、曲线方程、检出限及定量限
用 100 mg·L-1标 准 储 备 液 配 制 10 mg·L-1的 角黄素与叶黄素混合标准溶液,分别吸取0.010 mL、0.020 mL、0.050 mL、0.080 mL和0.100 mL混合标准溶液,用乙腈定容至10 mL,配成浓度为10 μg·L-1、20 μg·L-1、50 μg·L-1、80 μg·L-1和 100 μg·L-1标 准 系列,以峰面积为纵坐标,浓度为横坐标绘制标准曲线。用不同基质空白溶液配制浓度为10 μg·L-1的基质标准溶液,测定该浓度下信噪比(S/N),通过换算,计算S/N=3和S/N=10时对应的浓度,即为方法检出限(LOD)和定量限(LOQ)[14]。实验结果显示,在浓度0~100 μg·L-1,角黄素与叶黄素的校正曲线相关系数r均≥0.996,线性良好。角黄素在3种水产鱼基质的方法检出限在0.03~0.09 mg·kg-1,定量限在0.09~0.30 mg·kg-1。叶黄素在3种水产鱼基质的方法检出限在0.07~0.10 mg·kg-1,定量限在0.22~0.51 mg·kg-1。线性范围、曲线方程、检出限及定量限详见表3。

表3 角黄素和叶黄素线性范围、线性方程、相关系数、检出限和定量限表
2.5.2 方法的准确度与精密度试验
采用加标回收试验,在空白罗非鱼、红鱼、黄骨鱼样品中,加入角黄素与叶黄素混合标准溶液至2 mg·kg-1、10 mg·kg-1、20 mg·kg-1的 3 个水平,每个水平样品重复处理测定6次,计算回收率与相对标准偏差(RSD),考察方法准确度与日内精密度。连续3天进行重复加标回收实验,计算日间的相对标准偏差(RSD),考察方法日间精密度。由表4可知,方法的平均回收率为85.5%~117.7%,日内精密度为0.8%~6.2%,日间精密度为2.1%~11.3%。方法的准确度与精密度试验结果均符合《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)[15]对回收率与精密度的要求,方法具有稳定可靠性。

表4 3种水产鱼加标回收率和日内、日间精密度表(n=6)
2.6 实际样品测定
采用本实验对线下实体商超和线上购物平台采购的黄骨鱼、金昌鱼、大小黄鱼等21个水产鱼类样品中的角黄素与叶黄素进行测定。结果显示,21个水产鱼样品中均未检出角黄素。4个黄骨鱼样品中检出叶黄素,含量在2.09~2.44 mg·kg-1。从检测情况看,在水产养殖中违规使用角黄素的风险较低。
3 结论
本实验建立高效液相色谱-串联质谱法测定水产鱼类中角黄素与叶黄素的含量。Thermo Fisher Accucore aQ色谱柱能够对角黄素与叶黄素进行分离,以0.1%BHT-乙腈溶液为提取液,采用0.1%乙酸水溶液和0.1%乙酸甲醇溶液作为流动相,以1∶19的比例等度洗脱,在质谱(ESI+)正离子模式下以平行反应监测(PRM)模式检测。在0~100 μg·L-1,角黄素、叶黄素的浓度与色谱峰面积分别呈良好线性关系,相关系数分别为0.996与0.997。方法的准确度与精密度试验结果均符合《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)对回收率与精密度的要求,为水产鱼类中角黄素与叶黄素的检测提供了准确、稳定、可靠的检测方法。

