电针“太冲”“曲池”对自发性高血压大鼠下丘脑室旁核P2X7受体及PI3K/AKT通路相关蛋白因子表达的影响
刘 鑫,孙 娇,岳炳南,李晓璐,刘清国
(北京中医药大学,北京 100029)
自发性高血压(Essential hypertension,EH)通常简称为高血压,是心血管疾病发病率和死亡率的主要危险因素,现代研究表明血压升高和交感神经活动亢进是高血压的主要特征之一[1]。研究表明向正常血压大鼠下丘脑室旁核(PVN)中微量注射促炎细胞因子白介素1β(Interleukin-1β,IL-1β)或肿瘤坏死因子(Tumornecrosis factor-α,TNF-α)可以引起血压和大鼠交感神经活性增加[2]。神经炎症主要以小胶质细胞激活导致促炎细胞因子增加为特征。小胶质细胞上有着一系列P2X嘌呤家族的受体,其中P2X7受体可以通过影响PI3K/AKT信号通路介导小胶质细胞激活,诱导炎症因子IL-1β、TNF-α等的释放[3]。研究发现电针可以调节小胶质细胞中P2X7受体的表达[4-5],还可以影响胰岛素抵抗模型大鼠下丘脑的PI3K、AKT2信蛋白表达[6],影响PI3K/AKT通路来调节细胞生长增殖,抑制高血压心肌肥厚[7]。但电针对高血压中枢调节研究内容较少,机制尚不明确,因此本研究通过观察电针“太冲”“曲池”对自发性高血压大鼠(SHR)模型下丘脑室旁核P2X7受体表达及PI3K/AKT信号通路相关因子的影响,探究电针对血压的中枢调控机制。
1 材料与方法
1.1 实验动物与分组
SPF级自发性高血压大鼠(SHR)40只,Wistar-Kyoto(WKY)大鼠10只,雄性,9周龄,体质量(220±30)g。所有大鼠均饲养于北京中医药大学动物室,室温控制在20~25℃,相对湿度50%~55%,每日自由进食及饮水[实验动物、饲料和垫料均购自“北京维通利华实验动物养殖中心”,许可证号:SCXK(京)2016-0006]。适应性喂养1周后将WKY大鼠10只作为空白对照组(W)。SHR大鼠用完全随机数字表法分为模型组(M)、假手术组(J)、电针组(Z)和抑制剂+电针组(B),每组10只。所有实验操作均按照世界卫生组织“涉及动物生物医学研究国际指导原则”进行,并经北京中医药大学动物保护与使用委员会批准,批准号:BUCM-4-2020122802-4126。
1.2 主要仪器与试剂
汉医牌针灸针(北京汉医医疗器械);韩氏穴位神经刺激仪:LH200H(联创科技集团南京济生医疗科技有限公司);XH200型恒温式无创血压测量仪(北京众实科技有限公司);DW-2000 脑立体定位仪(成都泰盟科技有限公司);套管系统(深圳市瑞沃德生命科技有限公司);微量注射泵(深圳市瑞沃德生命科技有限公司);高速冷冻离心机(北京翔意信科数码科技有限司);Leica UC7超薄切片机(德国徕卡公司);电泳仪、电转仪(北京六一仪器厂);Beckman Coulter生化分析仪(Au5800,美国Beckman Coulter Co.);ELISA 定量检测试剂盒(慧佳生物科技有限公司);P2X7受体抑制剂A438079(28209-1-AP),人工脑脊液(北京爱必反生物科技有限公司,CZ0516)。
1.3 干预方法
1.3.1 PVN双极套管置入术 适应性喂养结束后,假手术组、抑制剂+电针组大鼠均进行PVN双极套管植入术操作。术前6 h禁食不禁水,根据大鼠体质量腹腔注射相应剂量的3%的戊巴比妥钠(30 mg戊巴比妥钠/kg)麻醉大鼠,确定麻醉成功后,将大鼠头部固定于脑立体定位仪使用颅钻打孔,根据既往研究[8-9]确定大鼠PVN的坐标位置为:前囟点后1.8 mm,矢状缝两侧0.4 mm,距颅顶7.9 mm。然后将双极套管植入PVN,套管至颅顶后下降7.9 mm,并拧上导管帽。最后于固定孔中植入螺丝,利用牙科水泥固定套管与螺丝,局部再次消毒,尽可能缝合创面,并予以青霉素注射。将大鼠放置于恒温37 ℃的电热毯维持,待大鼠苏醒后放回笼子饲养,术后5 d连续给予腹腔注射青霉素抗炎(40万 U/kg)预防感染。所有手术均在麻醉及无菌条件下进行。
1.3.2 给药 分别在假手术组、抑制剂+电针组用微量注射器注射人工脑脊液(pH=7.4)、P2X7受体抑制剂A438079(10 μmol),一侧PVN每次给药剂量为100 nL。每间隔12 h给药干预,连续给药14 d。空白组、模型组与电针组:不做任何极套管植入术及给药处理。
1.3.3 针刺干预 电针组、抑制剂+电针组:将大鼠抓取固定后,取双侧“太冲”“曲池”穴,定位:于后肢足背1、2趾骨间凹陷处取“太冲”穴;于前肢桡骨近端的关节外侧前方的凹陷中取“曲池”穴,参照《实验针灸学》教材(林文柱、王佩编)。针具选用中研太和牌一次性0.25 mm×13 mm毫针,直刺 “太冲”“曲池”穴1~2 mm。针刺时让大鼠完全钻入鼠套内固定,以便于操作。得气后,同侧“太冲”“曲池”分别连接韩式电针仪的正负极,刺激强度为电流强度1 mA,频率2 Hz,留针20 min,每日1次,干预14 d。空白组、模型组和假手术组:每天抓取1次,钻入鼠套内固定20 min,不做任何针刺干预,持续至针刺第14天。所有抓取、固定和针刺操作均由同一人完成。
1.4 指标检测方法
1.4.1 血压监测 在室温(22±2)℃条件下,将清醒状态下的大鼠于36 ℃下预热(用温控器调节温度恒定)约15 min,用无创血压仪测量大鼠安静、清醒状态尾压,连续测量3次,取其均值,避免噪音等外界环境刺激对血压的影响。于针刺的第0天(即针刺前1 d)及针刺第2、4、6、8、10、12、14天,每天上午8点至12点固定时间段测量血压值,以减少误差。正式测压前训练若干次,每天测血压训练1次,连续3 d。注意:测压过程动作要轻柔,不能激惹大鼠,以免引起血压波动。加温时间不能过长,要固定在15 min;网套尺寸要合适,避免大鼠挣脱;尾套尺寸要合适,以免影响血压;室温要恒定,避免过高或过低对血压造成影响。
1.4.2 取材 大鼠成功麻醉后,每组分别取4只先用200 mL生理盐水由心脏灌注,待流出液体澄清后再用200 mL 4% 多聚甲醛灌注,取全脑组织并放入4%多聚甲醛溶液中固定48 h,然后取下丘脑制备石蜡切片(厚5 μm);剩余6只腹主动脉取血后处死,断头,取下丘脑PVN放置于PE管内,快速放入液氮速冻,并于-80 ℃保存。
1.4.3 PVN免疫组化 采用免疫组化法检测大鼠下丘脑PVN中P2X7受体表达情况,将石蜡切片常规脱蜡、入水,枸橼酸缓冲液微波修复,使用PBS液充分覆盖涂片漂洗后,依次使用PBS配置0.5%Triton、3%BSA进行破膜15~20 min及封闭30 min;加入适量P2X7R一抗4 ℃孵育24~48 h,再次漂洗后加入荧光二抗,37 ℃避光孵育1 h;使用核酸染料DAPI或Hoechst,37 ℃避光孵育5 min;漂洗后用磷酸甘油溶液封片。奥林巴斯全自动切片扫描显微镜(SV120)采集图片,计算抗原表达的平均光密度,每个部位测5个视野,取平均值定量分析。
1.4.4 Western blot检测 利用Western-Blot法验证PI3K/AKT通路相关因子PI3K、AKT蛋白表达情况。操作方法:在液氮中速冻的靶脑区组织中,加入RIPA蛋白裂解液裂解组织和提取靶脑区PI3K、AKT蛋白,用Bradford法测定蛋白浓度,调蛋白浓度各组一致,加入上样缓冲液待测。配胶,等量样品上样,在80 V电压下SDS-聚丙烯酰胺凝胶电泳1 h,然后将蛋白电转到PVDF膜上电泳,封闭,10×TBST洗涤,一抗孵育,10×TBST洗涤,二抗孵育,滴加发光液曝光显影。用图像分析系统对Western blot结果进行灰度扫描,以对照组的面积灰度值为1.0与实验各组进行比较和定量分析,所得的值即代表某种目标的相对含量。
1.4.5 ELISA 检测 腹主动脉采血法取各实验组大鼠动脉血,取血浆4 ℃离心20 min,取上清,采用酶联免疫吸附法(ELISA)测定IL-1β、IL-10含量。详细方法根据ELISA检测试剂盒说明书操作,通过酶标仪读取数据。
1.5 统计学处理
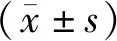
2 结果
2.1 各组大鼠治疗前后收缩压比较
如表1,治疗前后与空白组比较,其余各组大鼠收缩压均显著升高,差异具有统计学意义(P<0.01);治疗14 d后与模型组比较,电针组和抑制剂+电针组收缩压显著降低,差异具有统计学意义(P<0.01),假手术组收缩压变化差异无统计学意义(P>0.05);与电针组比较,治疗14 d后,抑制剂+电针组收缩压降低更明显,差异具有统计学意义(P<0.01)。
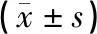
表1 各组大鼠电针治疗前后收缩压比较
2.2 各组大鼠下丘脑PVN中P2X7受体表达情况比较
治疗14 d后,与空白组比较,模型组和假手术组下丘脑PVN中P2X7受体表达量显著升高,差异具有统计学意义(P<0.01);与模型组比较,电针组和抑制剂+电针组下丘脑PVN中P2X7受体表达量显著降低,差异具有统计学意义(P<0.01),假手术组下丘脑PVN中P2X7受体表达量变化无统计学意义(P>0.05);与电针组比较,抑制剂+电针组下丘脑PVN中P2X7受体表达量无统计学意义(P>0.05)。见图1和表2。
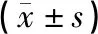
表2 各组大鼠下丘脑室旁核P2X7受体的平均光密度值比较
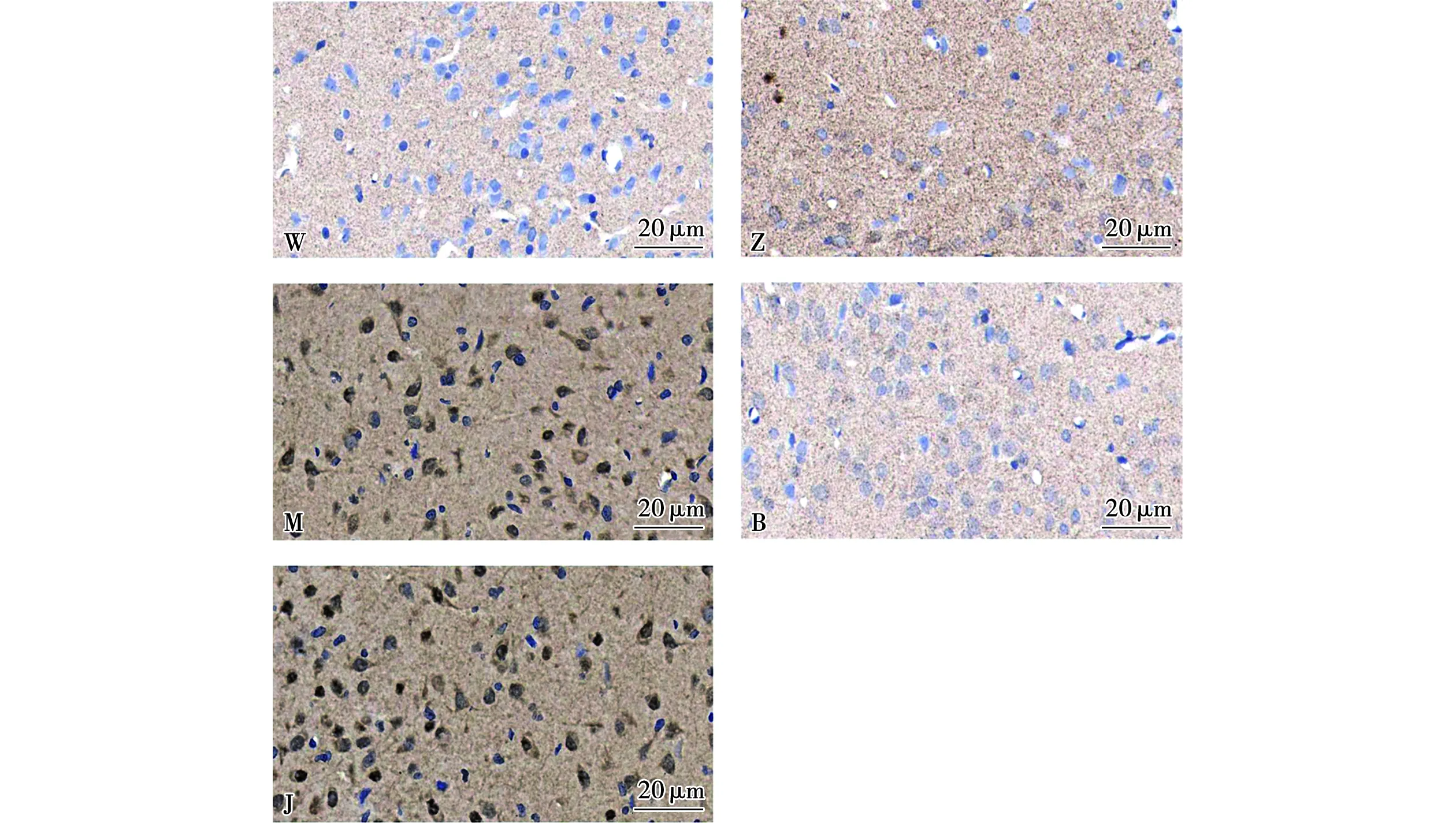
图1 各组大鼠下丘脑PVN中P2X7受体表达(免疫组织化学染色法,400×)
2.3 各组大鼠下丘脑PVN中PI3K、AKT蛋白表达情况比较
治疗14 d后,与空白组比较,模型组下丘脑PVN中PI3K蛋白相对表达量显著升高(P<0.01),假手术组下丘脑PVN中PI3K蛋白相对表达量升高,差异具有统计学意义(P<0.05);与模型组比较,电针组和抑制剂+电针组下丘脑PVN中PI3K蛋白相对表达量显著降低,差异具有统计学意义(P<0.01),假手术组下丘脑PVN中PI3K蛋白相对表达量变化差异无统计学意义(P>0.05);与电针组比较,抑制剂+电针组下丘脑PVN中PI3K蛋白相对表达量降低更明显,差异具有统计学意义(P<0.05)。治疗14 d后,与空白组比较,模型组和假手术组下丘脑PVN中AKT蛋白相对表达量升高,差异具有统计学意义(P<0.05);与模型组比较,电针组和抑制剂+电针组下丘脑PVN中AKT蛋白相对表达量显著降低,差异具有统计学意义(P<0.01),假手术组下丘脑PVN中AKT蛋白相对表达量变化差异无统计学意义(P>0.05);与电针组比较,抑制剂+电针组下丘脑PVN中AKT蛋白相对表达量降低更明显,差异具有统计学意义(P<0.05)。见图2和表3。
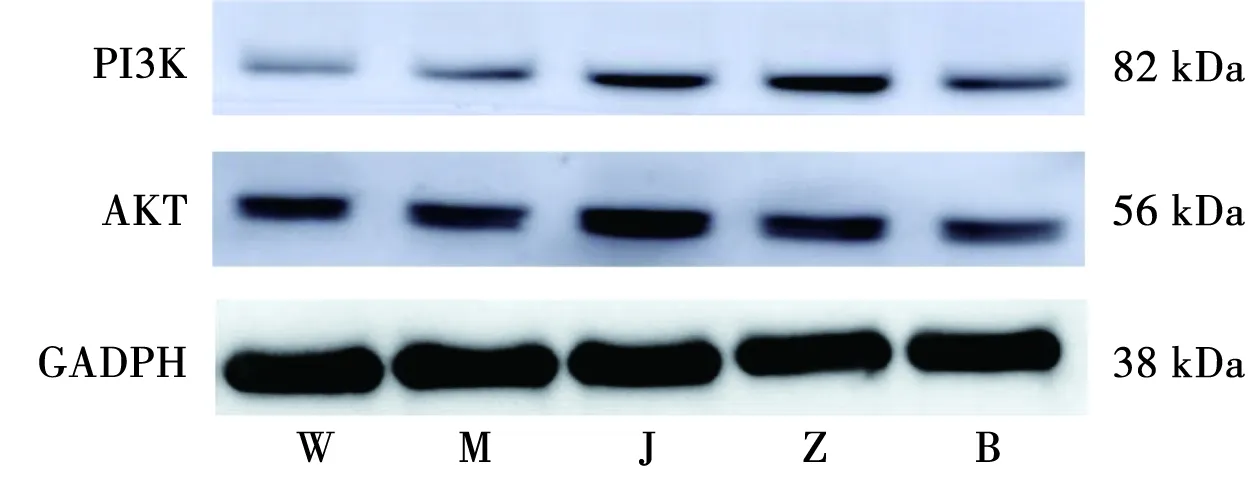
图2 各组大鼠下丘脑PVN中PI3K、AKT蛋白表达情况
表3 各组大鼠下丘脑PVN中PI3K、AKT蛋白表达情况比较
2.4 各组大鼠血清中IL-1β、IL-10浓度变化
治疗14 d后与空白组比较,模型组血清IL-1β浓度显著升高,差异具有统计学意义(P<0.01),假手术组血清IL-1β浓度升高,差异具有统计学意义(P<0.05);与模型组比较,电针组和抑制剂+电针组血清IL-1β浓度显著降低,差异具有统计学意义(P<0.01),假手术组血清IL-1β浓度变化差异无统计学意义(P>0.05);与电针组比较,抑制剂+电针组血清IL-1β浓度下降更明显,差异具有统计学意义(P<0.01)。治疗14 d后与空白组比较,模型组和假手术组血清IL-10显著下降,差异具有统计学意义(P<0.01);与模型组比较,电针组和抑制剂+电针组血清IL-10浓度显著升高,差异具有统计学意义(P<0.01),假手术组血清IL-10浓度变化差异无统计学意义(P>0.05);与电针组比较,抑制剂+电针组血清IL-10浓度升高更明显,差异具有统计学意义(P<0.01)。见表4。
表4 各组大鼠血清中IL-1β、IL-10浓度比较
3 讨论
高血压的发生涉及包括中枢神经系统(Central nervous system,CNS)在内的不同器官系统的复杂整合。中枢神经系统特别是下丘脑与高血压的发病机制密切相关[10]。下丘脑的室旁核(Paraventricular nuc-leus,PVN)作为神经内分泌和自主神经这两大系统的整合部位,在调节机体呼吸、血压和心血管活动等方面起了非常重要的作用,是控制血压的关键枢纽[11]。下丘脑室旁核炎性细胞因子(Inflammatory cytokines in paraventricular nucleus,PIC)对交感神经兴奋性有重要调节作用。研究发现[12],高血压时中枢神经系统PIC显著高于基础水平,并在高血压的发生发展中具有重要作用。研究报道将TNF-α和IL-1β注入穹窿下器可显著激活外周交感神经活动[13],正常大鼠中枢给予TNF-α后,可通过升高外周血液中去甲肾上腺素(Noradrenaline,NE)水平而增强交感神经活动。SHR大鼠室旁核炎症因子TNF-α、IL-1β和IL-6表达增高,抗炎细胞因子IL-10表达降低,经双侧室旁核连续4周输注TNF-α阻滞剂后发现血压降低并改善心肌肥大[14]。小胶质细胞的激活可导致促炎性因子的释放,小胶质细胞上的P2X7受体可通过PI3K/AKT信号通路诱导神经元凋亡,并参与神经炎症,促进炎性因子的释放[15-16]。研究表明电针可提高大鼠血浆中Ghrelin、NO浓度,从而激活PI3K/AKT/eNOS信号转导通路,达到降压和保护血管内皮的效果[17]。
中医学并无高血压病名,高血压根据其症状特点多归纳于“头痛”“眩晕”“肝风”“肝阳上亢”等范畴。《素问·至真要大论》记载:“诸风掉眩,皆属于肝”,为中医治疗高血压提供了理论依据。而针刺治疗高血压以降压效果稳定且无明显副作用为优势,得到广泛的推广和关注。大量实验研究表明[18-20],针刺可以改善SHR大鼠的心、脑和肾等靶器官损伤情况。方志坚等临床观察针刺治疗88例急症高血压患者,其降压效果显著,并降低患者神经功能缺损率[21]。太冲穴为肝经原穴,功擅平肝潜阳、行气解郁,是治疗高血压的要穴,曲池穴为大肠经合穴,功擅清热止痛、调和气血和舒经通络。研究表明[22],针刺治疗高血压使用频次前二的腧穴依次为太冲和曲池。因此本实验选用电针SHR大鼠双侧太冲、曲池的干预方法,研究其相关的降压机制。
本研究中笔者选用自发性高血压大鼠为模型作为研究对象,以下丘脑PVN为切入点,运用将P2X7受体抑制剂注入下丘脑PVN并结合电针为干预手段,探讨电针调控血压的中枢降压机制。由实验数据可知,干预前后与模型组比较,假手术组相收缩压并无明显变化,并且干预后检测各项生化指标比较均无统计学意义,说明PVN双极套管置入术对本研究并无影响。干预后与模型组比较,电针组和抑制剂+电针组大鼠的收缩压、下丘脑PVN中P2X7受体以及PI3K、AKT蛋白表达量和血清中IL-1β含量显著降低,血清中IL-10含量显著升高,说明电针可以通过降低P2X7受体以及PI3K/AKT通路相关蛋白因子的表达来实现降压的目的,同时血清中促炎因子IL-1β含量降低、抗炎因子IL-10含量升高,改善了因高血压导致的神经炎性症状。干预后与电针组比较,抑制剂+电针组降压效果更明显,各项生化指标相应良性变化更明显,尽管下丘脑PVN中P2X7受体表达量变化无统计学意义,但从其表达量不难看出具有下降的趋势,因此在靶向抑制P2X7受体的情况下,更能进一步说明电针可以通过良性调控P2X7受体以及PI3K/AKT通路上相关蛋白因子的表达的途径来降低血压并改善炎性症状。
综上所述,笔者可以推断电针可以通过良性调控下丘脑PVN中P2X7受体以及PI3K/AKT通路上PI3K、AKT蛋白和IL-1β、IL-10的表达来实现降压的目的,这可能是电针治疗高血压的中枢降压机制之一。