18F-FDG PET/CT 诊断大动脉炎1例
孙雨,樊冰,张迪,姜萍(山东中医药大学附属医院风湿病科,山东 济南 250014)
病例女,33岁,因反复发热伴咳嗽2 月余就诊,2020 年11 月患者无诱因出现持续发热伴干嗽、乏力,体温波动在37.0℃~38.2℃,无寒战,外院胸部CT 示:①右肺中叶局限性炎症,双肺纤维灶;②双侧胸膜增厚;血常规、降钙素原、PPD试验、痰抗酸杆菌、腹部彩超等检查均为(-),诊断为“肺炎”,先后予美洛西林钠、左氧氟沙星、法罗培南等抗感染,疗效不佳。既往体健,无风湿病家族史及特殊接触史,以“发热原因待查”收入院。
入院查体:体温37.6℃,脉搏76 次/分,呼吸19 次/分,血压106/55 mmHg。贫血貌,双肺呼吸音粗,未闻及干湿啰音,双侧桡动脉搏动强度一致,心脏及其他查体未见明显异常。
实验室检查及治疗:血常规:中性粒细胞绝对值7.27×109/L、红细胞计数3.11×1012/L、血红蛋白78 g/L、血小板计数626×109/L、C 反应蛋白77.3 mg/L、血沉135 mm/h;呼吸道感染:乙型流感病毒IgM 抗体阳性,降钙素原、巨细胞病毒、EB病毒、G 试验、GM 试验、优生系列、感染系列、血培养、痰培养、布氏杆菌、PPD 试验均阴性;抗核抗体、抗中性粒细胞胞浆抗体、免疫球蛋白G4 亚型阴性;椎动脉、颈动脉、锁骨下动脉彩超,心脏彩超未见异常;鼻咽、胸部CT:鼻咽未见明显异常改变,符合支气管炎表现,双肺炎症,少量心包积液;肝肾功、大小便、甲状腺、淋巴结彩超及肿瘤等相关检查无明显异常;骨髓细胞学检查、骨髓活检及PCR 测序无明显异常。治疗上先后经验性给予莫西沙星注射液、磷酸奥司他韦胶囊、注射用亚胺培南西司他丁钠抗感染,患者仍持续发热,出现双上肢血压不对称,压差>10 mmHg。
采用美国GE 公司生产的Discovery STE 正电子发射计算机断层成像仪(PET/CT),显影剂是GE trance 生产的18 氟脱氧葡萄糖(18F-FDG),放化纯度>95%,使用剂量8.32 mCi,患者检查前禁食8 h,血糖5.2 mmol/L,静脉注射18F-FDG后,在安静、温暖的环境中休息50 min,排空膀胱后平卧于检查床上。
扫描范围自颅脑至股骨上段,CT 扫描管电压、管电流、层厚分别为120 kV、4.0 mm,1.0螺距,0.5 s 的转速;PET 扫描:采用VUC Point 重建技术进行图像重建,并从图像上获取检查部位的横断面、矢状面和冠状断面的图像。PET/CT 全身显像示:升主动脉、主动脉弓及部分胸主动脉管壁略显增厚并18F-FDG 代谢增高(图1~6),考虑大动脉炎可能性大;心包积液;右肺中叶纤维灶;肝脾体积增大;18F-FDG PET/CT 全身检查(颅脑至股骨上段)无其他明显异常发现。
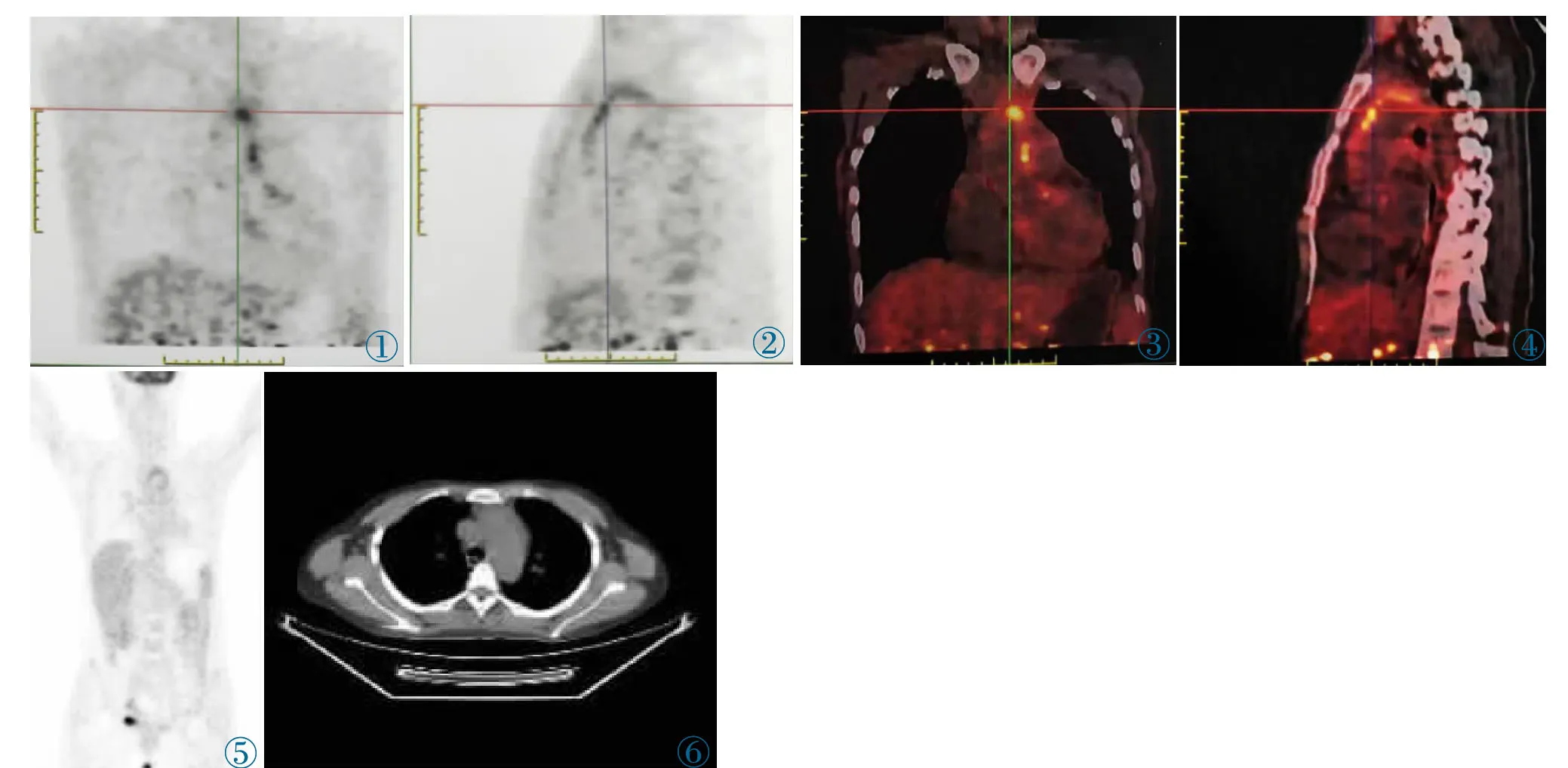
图1 主动脉及弓部放射性分布不均匀增高。图2 主动脉、主动脉弓及部分胸主动脉管壁放射性分布弥漫性不均匀升高。图3,4 融合图像,SUVmax 4.0。图5 全身PET MIP 示升主动脉、主动脉弓、部分胸主动脉弥漫性不均匀摄取FDG,心肌、肝脾轻中度生理性摄取,肝脏SUVmax 2.9。图6 主动脉弓部管壁增厚。
结合患者年龄、双上肢压差>10 mmHg 及PET/CT 结果明确诊断为大动脉炎。予激素联合环磷酰胺治疗后,病情缓解,每3 周随访一次,激素减量并加用中药、吗替麦考酚酯分散片,随访至2022 年1 月11日,病情稳定。
讨论大动脉炎(Takayasu’s arteritist,TA)是指主动脉及其主要分支的慢性进行性非特异性炎性疾病,病变多见于主动脉弓及其分支[1],归类为系统性血管炎中的大血管炎(LVV)。TA 好发于40 岁以下女性,病因尚不明确,可能与感染引起的免疫损伤有关。TA 早期临床表现无特异性,在局部症状或体征出现前可有发热、乏力、肌痛、关节炎、恶心、体重减轻及结节红斑等症状。实验室检查亦无特异性,如红细胞沉降率、C 反应蛋白等炎症指标异常。TA 早期活动时,血管尚未狭窄,常规影像学检查难以发现及甄别病灶,但主动脉或其分支已有显著炎性改变。另外,TA 无相关特异性生物学标志物,以致TA 早期诊断非常困难。TA 常用的诊断标准为1990 年ACR 制定的TA 的分类标准[2],常用的活动度评分标准为1994 年美国国立卫生研究院(NIH)评分,但相关研究[3]指出,1990 年ACR 分类标准在灵敏度、特异度、准确度和诊断效能方面较低。
诊断TA 常用的血管超声、CT 血管造影(CTA)、磁共振血管造影(MRA)有赖于血管结构改变,对早期TA 敏感性差。18F-FDG PET/CT 结合PET 功能代谢显像和CT 解剖结构成像的优点,应用的显影剂18F-FDG 为代谢的示踪物,是一种炎性显像剂,在炎症细胞中的摄取机制与恶性肿瘤类似,能够显示代谢异常的病灶并精确定位,全面反应血管炎性反应分布[4],故18F-FDG PET/CT 在TA 的诊疗中充分发挥了优势。
18F-FDG PET/CT 有助于TA 早期诊断,在形态学改变前即可检测出早期血管炎症。Myles等[5]进行的一项18 例疑似TA 患者的28次18F-FDG PET 检查提示,在TA 活动性血管炎的初始评估中,灵感度分别达到92%、特异度100%、阴性和阳性预测值分别为85%和100%,有利于TA 早期诊断及检测活动性疾病(即使在慢性变化中)并监测治疗的有效性。Fan等[6]纳入22 例TA 患者的研究,其中5 例为不符合ACR标准及Ishikawa 标准,但经专家整合分析资料后诊为TA 并符合NIH 活动标准的患者,均表现为18F-FDG 高摄取。张萍等[7]纳入的15 例TA 患者,其中5 例不符合ACR 诊断标准,其PET/CT 显像中的FDG 分布部位、ESR、CRP 水平与符合ACR 诊断标准的10 例TA 无明显差异,但符合ACR 诊断标准的10 例患者的PET/CT 图像显示相关主动脉及其主要分支明显狭窄。Elena等[8]发现PET/CT 可用于评估TA 患者局部炎症和血管重塑,即使动脉管壁厚度<4 mm,18F-FDG 仍显著摄取,示踪剂摄取增高的程度与动脉管壁的厚度相关,与全身炎症或NIH 标准无关。但值得注意的是,动脉移植物周围会有显著18F-FDG 摄取,故血管搭桥或支架术后是一个潜在的混杂因素,不能反应血管炎症状态及病情活动进展[9-10]。另外,使用糖皮质激素和免疫抑制剂可能降低18F-FDG PET的诊断准确性[11],所以为确保诊断效能,在激素或免疫抑制剂应用前或停用后再行18F-FDG PET 检查。
18F-FDG PET/CT 有助于评估疾病活动度,预测疾病活动性。近年来,PET/CT 在TA 病人疾病活动性评估中的应用越来越多[8,12-13],对轻度炎症的敏感性更高[12]。Tezuka等[11]报道18F-FDG PET/CT SUVmax 活动期明显高于非活动期,复发期高于稳定期,在受试者工作特征(ROC)曲线比较中,SUVmax优于CRP 和ESR。PET/CT 使用PET 血管活动评分(PETVAS)在TA 临床评估中,优于SUVmax、CRP 和ESR,被推荐为评估疾病活动性的方法[14]。Karapolat等[15]评估的22 例患者18F-FDG PET/CT 结果与TA 的临床疾病状态基本一致,其中1 例临床稳定但PET/CT 显示高活动性的患者在4 周后病情恶化。Kwon等[16]指出18F-FDG PET/CT 的血管摄取与临床非活动性TA 患者的未来复发有关。此外,PET/CT 能够显示病变程度范围,检测到的血管区域数量更多,对主动脉分支受累范围的检测价值更高,在全面评估疾病程度方面亦具有优势[17]。
18F-FDG PET/CT 敏感性高,在TA 早期诊断、评估和预测疾病活动性具有积极意义。TA 病理主要表现为血管壁全层炎症细胞浸润,动脉管壁新生血管形成,但是目前少有充分利用18F-FDG PET/CT 的解剖成像,以定量评估血管壁的水肿、厚度和狭窄程度的研究,故PET/CT 有望成为定量评估血管炎症及狭窄程度的手段。目前PET/CT 检查费用仍偏高,尚不能作为常规检查、复查手段,既往相关研究所纳入的样本量有限,期待随着临床应用研究的深入,大样本前瞻性研究能够顺利开展,并有望将PET/CT 纳入TA 临床诊疗指南。

