液相色谱-串联质谱技术在临床检验中的应用研究进展
易可可,谢 洁,江 游,黄泽建,龚晓云,翟 睿,乔晓婷,刘梅英,戴新华,方 向,时国庆
(1.北京科技大学化学与生物工程学院,北京 100083;2.中国计量科学研究院前沿计量科学中心,质谱仪器工程技术研究中心,北京 100029)
对临床实验室收集的患者血液、体液等样品进行各项指标检测,可以提供对疾病预防、诊断、治疗方案和预后判断的重要依据。传统的检测方法(如基于抗原抗体结合的免疫测定(IA))是常规临床检测方法之一[1],但临床实践中发现,IA法会出现选择性差或假阳性结果[2]。液相色谱-串联质谱(LC-MS/MS)技术凭借高灵敏度和高选择性的优点,可提供更准确的分析结果,在临床检验中发挥着重要作用。
质谱的电离模式通常可分为硬电离[3]和软电离[4-5],其中硬电离模式目前仅限于分析具有挥发性和热稳定的化合物[6],不适用于分析临床样本;软电离允许样品分子在电离过程中保持完整形态[7],有利于检测临床小分子分析物,电喷雾电离是临床质谱最常见的电离模式。完整的样品分子进入串联质谱后,在一级质谱中选择特定化合物的母离子,在碰撞池中将母离子碰撞裂解,随后采用二级质谱的MRM或SRM模式获得对应的离子对信息[8-9]。相比于其他方法如紫外分光光度法、荧光光谱法和免疫测定法等,串联质谱具有更高的选择性、准确性、分辨率、灵敏度等优势[10-11],可通过MRM/SRM模式实现对多种分析物的同时准确定量[12]。
基于液相色谱分离的LC-MS/MS是目前临床实验室中最常用的检测方法[13-15]。由于临床检验的样本通常是基质复杂的生物液体或固体,不适于直接通过质谱分析,须对样品进行预处理和色谱分离。其中,预处理过程中样品制备不仅会影响色谱的分离效果,还会影响分析物信号强度。有时需要根据所采用LC-MS/MS系统的检出限浓缩或稀释样品,并通过优化液相色谱条件将目标物与干扰成分分离[11, 16-17]。
本文基于LC-MS/MS在临床检验中的应用研究进展进行综述,拟讨论LC-MS/MS在新生儿筛查[18]、维生素D检测[19]、内分泌激素检测[20]、血药浓度监测[21]、蛋白定量分析[22]等应用中存在的独特优势和局限性,并讨论目前临床实验室在LC-MS/MS应用中可能面临的挑战,并对其发展趋势和应用前景进行展望。
1 LC-MS/MS在临床检验的应用研究进展
目前,LC-MS/MS在临床中可检测项目多达500余项,主要的检测项目列于表1。该技术使多种疾病在早期得以被准确、快速、高灵敏地诊断。

表1 临床质谱检测项目Table 1 Detectable items of MS in clinical application
1.1 新生儿遗传代谢疾病筛查
先天性代谢缺陷(IEM)是一类罕见的遗传疾病,其成因复杂,且多属于进行性疾病,病情恶化后可导致新生儿严重的损伤甚至残疾,因此早期筛查、诊断和治疗具有重要意义。LC-MS/MS技术能够快速、准确地对新生儿筛查中的多种疾病标志物进行定性、定量分析[57-58]。该技术可通过收集干血斑(DBS)制备样本,对婴儿伤害小且简单[59]。通常直接用含有一定量同位素内标的提取液从干血斑中提取目标物,然后直接进行LC-MS/MS分析,预处理简便、省时,2 min内即可完成1个样本的检测,具备极高的检测效率和通量。随着方法的不断开发,单个样本中可同时检测的分析物种类不断增加。目前,市售的试剂盒可以同时分析单个样品中的30多种标志物,如山东英盛的新生儿遗传代谢病筛查试剂盒,可检测13种氨基酸、31种肉碱和琥珀酰丙酮,列于表2。此外,将高效液相色谱替换为超高效液相色谱,与串联质谱联用,不仅扩大了疾病诊断的范围,还能进一步提高仪器的灵敏度,一些标志物的检出限可达1 ng/mL[25,29],为临床实验室提供了更强大的分离各种疾病标志物的能力[60]。
LC-MS/MS技术自20世纪被用于新生儿筛查,至今已经发展成熟,其缺点在于设备昂贵、对实验室条件和技术人员的要求较高,且需要实验室具有一定水平的质量控制能力。此外,由于新生儿筛查临床样本中各分析物的浓度受疾病和新生儿母亲营养水平影响较大,因此各分析物具有较宽的参考范围。IEM患儿出生后,短时间内一些代谢物可能保持在正常水平,但随年龄增长后出现变化,有时仅依靠LC-MS/MS的定量结果不足以构成诊断的充分条件。目前,第二代测序技术作为LC-MS/MS的二级诊断方式或二者组合的形式被广泛使用,这种组合策略可降低LC-MS/MS的误诊风险[61]。
1.2 维生素D
维生素D(VD)的缺乏会导致少儿佝偻病和成年人的软骨病,是一个世界性的健康问题,对VD的浓度水平检测具有诊断意义[62]。VD在肝脏中转化为25-羟基维生素D(25(OH)D),其中25-羟基维生素D3(25(OH)D3)是主要的存在形式,同时也存在少量25-羟基维生素D2(25(OH)D2)。由于25(OH)D总含量高于其他任何VD代谢物且相对稳定,临床通过检测25(OH)D作为评价人体VD营养水平的可靠指标,将25(OH)D低于20 ng/mL (50 nmol/L)定义为VD缺乏[69]。目前,血清样品中25(OH)D的检测主要采用基于抗原与抗体特异性结合的IA法或LC-MS/MS法,IA法成本低廉,预处理过程易于自动化和高通量检测,但其主要缺点是抗体与25(OH)D代谢物之间存在交叉反应,并且检测容易受到温度、基质、抗体状态等条件影响[70]。此外,该方法仅能得到25(OH)D总含量,无法分别定量25(OH)D2和25(OH)D3。LC-MS/MS技术不仅能区分微量复杂样本中25(OH)D2和25(OH)D3,同时具有很高的灵敏度,这是由于通过色谱分离或同位素标记法来筛选候选的生物标记物,解决了同分异构体干扰的问题[63],因此,LC-MS/MS被国际公认为测定25(OH)D的“金标准”[64]。

表2 氨基酸、肉碱和琥珀酰丙酮的LC-MS/MS测定试剂盒Table 2 LC-MS/MS kit for determination of amino acids, carnitine and succinyl acetone
然而,在临床实践中发现,VD存在少量差向异构体的类似物,差向异构体在一些人群如婴儿体内的含量足以影响诊断结果,需要进行长时间的色谱分离才能得到满意的分离效果。此外,由于25(OH)D为甾体类化合物,除C、H、O外只含有较少的其他原子,因此电离效率较低,且电离后表现出较差的、非特征性的碎裂特性[65],限制了VD临床检测的灵敏度。一些研究[66-67]使用样品衍生化或在流动相中添加盐来提高灵敏度,但衍生化步骤繁琐、耗时且不便于大规模分析应用。Tai等[68]开发了一种基于LC-MS/MS的测定人血清中25(OH)D的参考测量测序程序,采用LLE预处理样品,不经过衍生化,分析时长为45 min,25(OH)D的检出限为0.375 nmol/L。Liebisch等[69]改进了该方法后,使分析时间缩短至4 min。Kassim等[70]开发了一种基于衍生化的检测血清中12种VD代谢物的LC-MS/MS方法,分析时间长达34 min,但检出限可达fmol水平。Wan等[71]基于衍生化开发了检测VD代谢物的新方法,同时采用液液萃取-固相萃取(LLE-SPE)联用的预处理方法,与单独的SPE相比,降低了2~4倍的离子抑制,分析时间为13 min,定量限为0.005~0.02 nmol/L。Mena-Bravo等[72]基于二维液相色谱(2DLC)提出了SPE-2DLC-MS/MS方法,用于人血清中VD代谢物的绝对定量分析,2DLC可以分离25(OH)D3和差向异构体,检出限范围在0.023~0.225 nmol/L,RSD小于11.6%。最近,Kassim等[34]报道了在不使用衍生化的情况下,25(OH)D2和25(OH)D3的检出限分别达到0.012和0.037 nmol/L,由于采用了在线SPE方法,进一步纯化提取物需要较长时间,总分析时长为35 min。因此,开发更短时间和少量样本即可同时分析VD及其代谢物的新方法,将有助于VD缺乏相关疾病的临床诊断。通过LC-MS/MS同时检测维生素D和其代谢物的相关信息列于表3。
1.3 内分泌激素
人体内某种激素浓度发生变化可能会对其他激素产生影响,因此,同时测量多种内源性激素在临床和生理学研究中具有重要意义[73]。但许多激素具有相似的分子结构,且激素含量较低,样品受性别、年龄等因素影响较大[74-76],准确定量分析内分泌激素是目前临床最具挑战性的问题之一。以临床中常见的肾上腺皮质癌为例,其病理特征是在男性和绝经后女性体内过量分泌雌激素,而且患者的17-羟基孕酮、雄烯二酮和硫酸脱氢表雄酮等多种激素也在生理周期内异常上升[77],须在1次检测中同时筛选多种激素才能分析诊断,常规检测涉及激素种类有限,难以满足要求。采用LC-MS/MS法能同时检测这些激素含量,通过色谱分离,使具有相似化学结构的类固醇得到优异的纯化效果,同时缩短了分析时间,能快速得到高重现性的结果,这对揭示内分泌失调等疾病的发病机理,疾病诊断或预防的标志物以及相关治疗方案具有巨大潜力[78]。
目前,LC-MS/MS已用于测量几乎所有类别的内分泌激素[79],Enver等[80]采用LC-MS/MS建立了婴儿肾上腺激素含量的参考范围,可检测14种内分泌激素。Handelsman等[81]通过LC-MS/MS测量10 904份血清样本,认为男性雄激素水平受到年龄、身高和体重等因素的影响,男性的睾酮及其2种生物活性代谢物双氢睾酮和雌二醇等内分泌激素水平呈现从35岁逐渐下降,80岁后下降更显著的年龄特征。然而,LC-MS/MS在检测内分泌激素方面存在一些缺点。首先,检测样本时会受到基质效应和离子抑制等现象的影响,如来自不同人群的血液样本基质成分不同,显示出不同的离子抑制效果,同时,由于样本基质复杂,可能会发生同量异位素干扰导致定量误差,造成误诊。其次,雌激素离子化效率低,虽然通过衍生化引入带电部分能提高离子化效率,但许多雌激素衍生物会产生非特异性产物离子[20]。近年来,有报道[82]采用LC-MS/MS法测定人血清中包含雌激素在内的类固醇,通过在流动相中添加氟化铵盐来替代衍生化,但该方法仅限于检测孕妇体内几种高表达的内源性雌激素,尚不适用于检测低含量的类固醇化合物。此外,LC-MS/MS在内分泌激素检测的应用时间相对较短,实验室内部方法的开发具有一定难度,实验室建立的各分析物参考范围仍需要经过实践检验,实现标准化以尽量减少实验室内和实验室间的差异问题[83]。
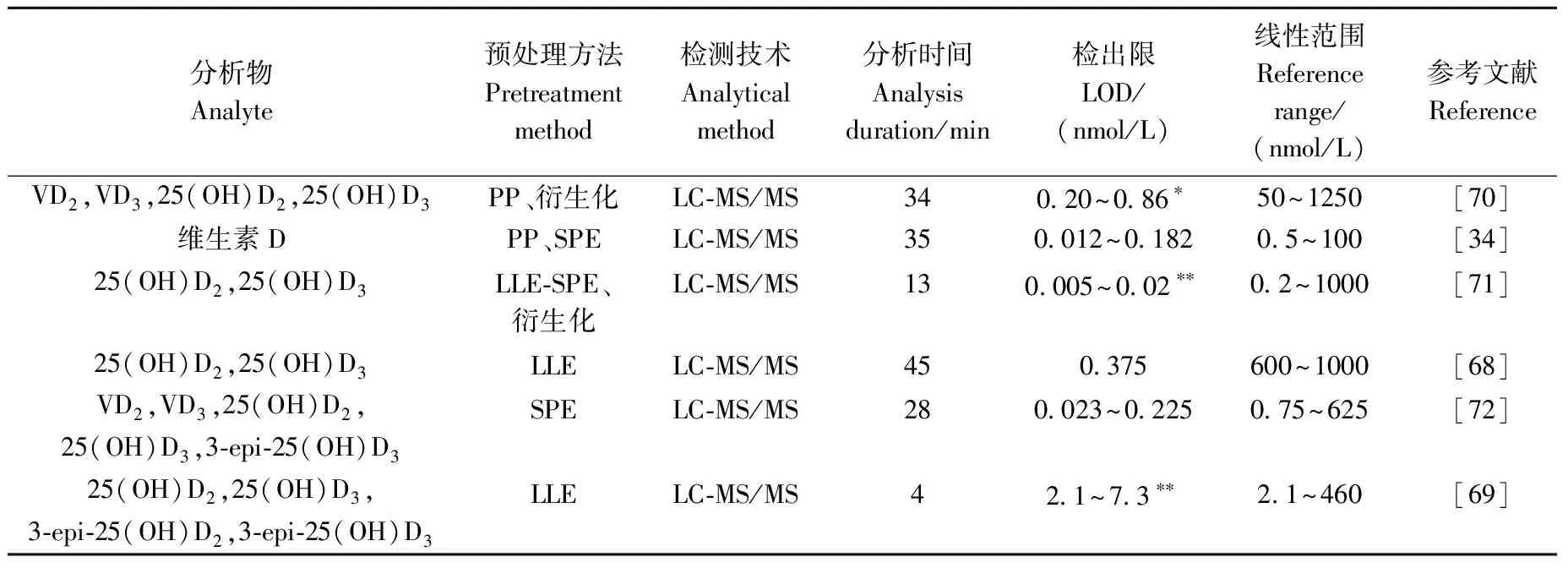
表3 维生素D的LC-MS/MS分析Table 3 LC-MS/MS analysis of vitamin D
1.4 血药浓度监测
血药浓度监测包括治疗药物检测(TDM)、疼痛药物管理[84-85]和毒理学检测[86]等,其中TDM是血药浓度监测在临床中最常见的应用。在临床实践中,由于免疫抑制药物的治疗窗口狭窄且患者个体差异较大,须准确测量血液中的免疫抑制药物浓度来确定给药窗口,以制定个性化给药方案,从而避免药物副作用。LC-MS/MS方法可在单个血样常规分析中对任意免疫抑制剂的组合方案进行准确定量,是目前实现TDM的最佳选择[87]。
TDM中常用的免疫抑制剂包括他克莫司(TAC)、西罗莫司(SIR)、依维莫司(EvE)和环孢素A(CsA)等,药物中约75%~95%的成分会与红细胞结合,所以目前TDM的临床实践主要基于全血样本,其他非常规临床材料(如组织、细胞、尿液和其他体液的基质)也可用于TDM,但应用较少。此外,由于全血样本储存时间短,将全血制备成DBS为临床提供了一种简单的样本基质替代方案,Sadilkova等[88]研究表明,通过LC-MS/MS在DBS和全血中进行免疫抑制剂测量的结果具有良好的相关性。
在样本前处理阶段,由于全血样本中血细胞和蛋白质含量较高,大分子蛋白质和细胞会堵塞色谱柱,无法直接注入色谱柱进行分离。此外,全血样本中药物浓度通常较低,且存在大量干扰物质,导致基质干扰严重,因此,为提高方法的灵敏度,有必要去除干扰物质来净化样品,并通过浓缩分析物来增强信号。蛋白质沉淀(PP)、液液萃取(LLE)和固相萃取(SPE)是常用于TDM的样品预处理方法,PP使用有机溶剂如甲醇、乙腈、丙酮或这些溶剂的混合物沉淀全血中的蛋白质,将硫酸锌添加到全血样本中进行溶血可以辅助沉淀蛋白质。LLE通常使用甲醇、乙腈和叔丁基甲醚或它们的混合物萃取样品,但蒸发和复溶步骤可能会导致分析物的损失。SPE无需蒸发和复溶步骤,减少了分析时间,但成本较高。临床实验室需要根据具体分析目标优化合适的预处理方案或组合方案,具体报道列于表4。

表4 免疫抑制剂的LC-MS/MS定量分析Table 4 Quantification of immunosuppressantare by LC-MS/MS
Juliana等[89]采用LC-MS/MS同时分析了全血样本中4种免疫抑制药物的235种组合方案,以探究器官移植后患者的最佳免疫抑制剂给药量,体现了LC-MS/MS在临床中为患者提供准确的个性化诊疗方案的巨大优势。然而,LC-MS/MS存在设备较昂贵、只能在具备条件的实验室使用等缺点。未来,随着质谱仪更加自动化、小型化,使TDM从实验室分析走向现场快速分析成为可能。
1.5 肽类和蛋白质定量分析
蛋白质是生命过程的关键角色,定量检测蛋白质对于疾病的预防、诊断和治疗至关重要。目前,质谱已成为蛋白质定量分析必不可少的工具,其应用包括肿瘤标志物检测[95]、蛋白质或肽类药物定量[96]和靶向蛋白质组学分析[97-98],Sabbagh等[99]对蛋白质定量分析适用方法进行了概述。
基于质谱的蛋白质定量分析要求检测结果具有高灵敏度、高稳定性、高通量以及良好的重复性,挑战性较高。首先,由于蛋白质在体外条件下易被降解,对样本基质的稳定性具有更严格的要求,预处理方法时长须小于6 h[100]。其次,不同蛋白质在血清或血浆样本中丰度具有较大差异,须通过液相分离、使用SPE富集、适配体亲和富集或使用包括修饰的磁性纳米材料等技术富集含量较低的蛋白质。此外,不同于临床其他分析物,蛋白质属于大分子化合物,实验室常用的三重四极杆质谱无法直接定量分析其天然存在形式,需使用胰蛋白酶进行消化处理生成特征肽段,然后将这些特征肽段作为目标分析物,并严格优化包括孵育时间、反应温度以及蛋白酶用量在内的消化条件,以确保特征肽段与目标蛋白质的物质的量比例接近。可通过不同类型的质谱仪实现肽类和蛋白质的定量分析,包括基质辅助激光解吸-飞行时间质谱(MALDI-TOF MS)、离子阱质谱、单四极杆质谱、四极杆-飞行时间串联质谱、三重四极杆质谱以及高分辨质谱。大多数情况下使用三重四极杆的SRM/MRM模式即可实现对多个目标物的高度并行分析[101]。
目前,基于质谱的蛋白质定量分析方法日趋成熟,然而也存在不足:长时间的色谱分离和有限的通量限制了该方法进一步发展;样品制备中胰蛋白酶消化和低丰度蛋白质的富集,大大延长了分析时间;大多数易于定量的蛋白质尚未建立各自的参考范围[102],由于蛋白质丰度的变化可能受多种非疾病因素影响,因此定量结果还需要其他技术印证。
2 结论与展望
基于LC-MS/MS的定量分析方法在临床检验中变得越来越重要,目前,已建立了LC-MS/MS对氨基酸、肉碱、VD、一些内分泌激素和蛋白质等分析物定量检测的参考测量程序,并提供了可溯源至国际单位制的标准物质,随着标准化规模的扩大,LC-MS/MS在临床分析中将得到更多认可。目前面临的主要挑战有:1) 受限于现有仪器的灵敏度,一些分析物的定量分析需要提前进行衍生化处理,增加了分析时间和使用成本,不利于临床大规模分析应用;2) 由于临床样本基质的复杂性,大多数分析物尚不明确其定量参考范围,或缺少相应的LC-MS/MS参考测量测序程序,不同个体间的定量差异须受到重视;3) LC-MS/MS设备昂贵,开发新方法的成本较高,因此分析物的定量分析通常仅限于实验室内,限制了临床应用的进一步发展。未来,随着质谱仪器小型化,仪器成本将得到控制,现场LC-MS/MS检测将成为可能。

