高效阴离子交换色谱-脉冲安培法检测冻干b 型流感嗜血杆菌结合疫苗的游离多糖含量
贾松华,邓海清,杜闪,张艳红,尹珊珊,刘建凯
流感嗜血杆菌(haemophilus influenzae,Hi)为革兰氏阴性杆菌,隶属嗜血杆菌属,威胁的主要人群为 5 岁以下儿童,是全球严重的公共卫生问题。在常规使用疫苗前,流感嗜血杆菌造成的所有侵入性疾病中 95% 是由 b 型流感嗜血杆菌(haemophilus influenzae type b,Hib)引起[1-3]。多聚磷酸核糖基核糖醇(polyribosylribitol phosphate,PRP)是 b 型流感嗜血杆菌荚膜多糖的主要组成部分,也是制备 Hib 疫苗有效的抗原成分[4],结构见图 1。本公司制备的 Hib 结合疫苗通过将纯化的PRP 与破伤风类毒素(tetanus toxoid,TT)共价结合为结合态多糖,增加了 Hib 疫苗的免疫原性,将免疫应答类型由 T 细胞非依赖性转换为具有免疫记忆的 T 细胞依赖性免疫应答,对于预防 Hib引起的脑膜炎及肺炎等疾病具有重要意义。在 Hib结合疫苗中,与载体蛋白结合的处于结合态的PRP,即为 Hib 结合态多糖;而未与载体蛋白结合的处于游离状态的 PRP,即为 Hib 游离多糖。Guo 等[5]研究结果表明游离多糖含量高的 Hib 疫苗免疫小鼠的抗体水平差。多项研究表明,Hib 游离多糖含量是评价疫苗效价的重要质量控制指标,Hib 游离多糖含量过高会显著影响疫苗的免疫原性[1,5-6]。
目前,《中华人民共和国药典》2020 版(三部)(简称《中国药典》)推荐使用乙醇分步沉淀法[7]测定 Hib 结合疫苗中的游离多糖含量。乙醇分步沉淀法作为测定游离多糖含量的经典方法,其稳定性、线性、准确度、精密度等均得到广泛验证,但该方法操作繁琐,操作要求高,且试验周期长,对于游离多糖含量低的样品,可能因含量低于测定下限造成误差[6]。高效阴离子交换色谱-脉冲安培检测法(high performance anion exchange chromatography with pulsed amperometric detector,HPAEC-PAD)用于检测 Hib 疫苗中多糖含量备受关注。本实验拟利用 HPAEC-PAD 法测定冻干 Hib 疫苗游离多糖含量,探讨不同条件对供试品水解效果的影响,最终确定了最佳水解条件,并初步确定冻干 Hib 结合疫苗中游离多糖含量分离的最适方法。为 Hib结合疫苗的游离多糖质量控制提供了参考,为疫苗中该项测定提供了检测方法。
1 材料与方法
1.1 材料
1.1.1 供试品和标准品 PRP 国际标准品(批号:12/306,4.904 mg/瓶)购自英国国家生物制品检定所;冻干 Hib 结合疫苗(批号:D20200901-1,复溶后 0.5 ml/剂)、冻干 Hib 结合疫苗原液(批号:34-20094001、34-21064001、34-21064002、34-21064003)、Hib 结合疫苗(批号:E20201235,剂型为液体,0.5 ml/剂)和Hib 结合疫苗原液(批号:34-20113035)均由本公司生产。
1.1.2 主要试剂及仪器 离子色谱仪 ICS-6000(配 ED 电化学检测器,变色龙 7.0 工作站)、CarboPac PA10 型分析柱(2 mm × 250 mm)和CarboPac PA10 型保护柱(2 mm × 50 mm)均购自美国 Dionex 公司;摇床 HYG-A 购自太仓市实验设备厂;恒温水浴锅 SAP18 购自 Grant 公司;超速离心机 OptimaTMMAX-XP(转头型号TLA-120.2)、超速离心管(型号 343778)均购自美国 Beckman 公司;214SPE3000 C4 固相萃取柱(5 ml)购自 VydacBioSelect 公司。
50% 氢氧化钠溶液(HPLC 级)购自美国Thermo Fisher 公司;醋酸钠(NaAc,纯度 ≥ 99%)购自美国 Sigma 公司;甲醇(HPLC 级)、氯化钠均购自国药集团化学试剂有限公司;实验用水均为超纯水,电阻率为18.2 MΩ·cm,由默克 Milli-Q IQ 7000 超纯水仪制备。
1.1.3 溶液制备 PRP 标准品储备液:将冻干的PRP 国际标准品室温放置约 1 h,1 ml 超纯水复溶,再取适量超纯水稀释至 19.616 μg/ml,即为PRP 标准品储备液。
1 mol/L NaAc/250 mmol/L NaOH 淋洗液:量取 13.1 ml 50% NaOH,称取 NaAc 82.03 g,加入超纯水至 1 L,氮气排气,混匀,使用时在线稀释。
0.9% 氯化钠:称取氯化钠 0.45 g,加入超纯水 50 ml,混匀。
供试品前处理:用超纯水将供试品按照合适的比例进行稀释,使 PRP 浓度在 0.1962~19.616 μg/ml范围内。
1.2 方法
1.2.1 标准曲线的绘制 添加适量的超纯水系列稀释 PRP 标准品储备液,得到质量浓度分别为0.1962、0.3923、0.9808、1.9616、3.9232、9.8080、15.6928 和 19.616 μg/ml 的系列标准品工作液(STD1~STD8)。经 0.22 μm 滤膜过滤后依次进样,记录色谱图,以 PRP 标准品浓度为横坐标,对应的峰面积为纵坐标绘制标准曲线,得线性回归方程。
1.2.2 色谱条件 采用 CarboPac PA10 型分析柱(2 mm × 250 mm)和 CarboPac PA10 型保护柱(2 mm × 50 mm)。脉冲安培检测器,Au 工作电极,Ag/AgCl 参比电极,波形为 Carboh-ydrates。梯度洗脱条件:0~5 min,10% 淋洗液;5~10 min,10%~25% 淋洗液;10~15 min,25% 淋洗液;15~20 min,25%~35% 淋洗液;20~25 min,35%~10% 淋洗液;25~36 min,10% 淋洗液[8]。进样体积为 20 μl,流速为 0.25 ml/min。
1.2.3 水解条件的确定 量取供试品 0.5 ml 于1.5 ml 离心管中,向所有离心管中加入不同浓度的NaOH 溶液 0.5ml,混匀,不同温度下水解供试品(水解条件详见表 1)[9]。所有样品经 0.22 μm 尼龙膜过滤后,转移至进样瓶中,色谱条件见“1.2.2”。
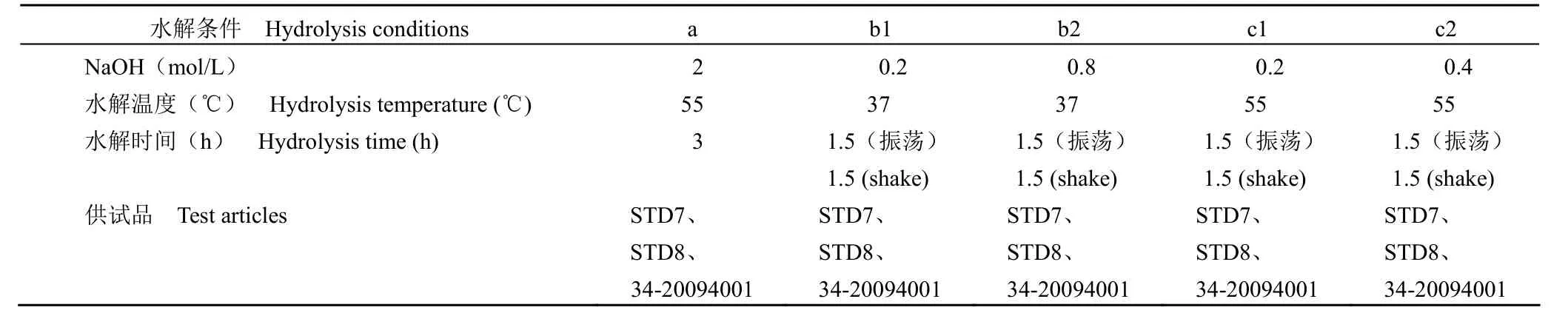
表1 水解方法Table 1 Hydrolysis methods
1.2.4 游离多糖的分离
1.2.4.1 乙醇分步沉淀法 参照《中国药典》[7],乙醇分步沉淀法分离 Hib 游离多糖。
1.2.4.2 C4 固相萃取法 3 ml 甲醇活化 C4 固相萃取柱,10 ml 超纯水冲洗。取 1 ml 供试品过C4 固相萃取柱,取 1 ml 0.9% 氯化钠溶液过 C4固相萃取柱,收集全部滤过液,补 0.9% 氯化钠至2 ml,得 Hib 游离多糖[10]。按照“1.2.3”优化后的条件进行水解,色谱条件见“1.2.2”。
1.2.4.3 超速离心法 参考文献[11-12],优化超速离心条件分离游离多糖。在批号 34-21064001 产品中加入 PRP 标准品储备液,加标制备成 3 个浓度的 PRP 多糖溶液(质量浓度分别为 0、0.9808、3.9232 μg/ml)。取 0.75 ml 加标供试品于超速离心管中,12 ℃ 超速离心,离心力和离心时间详见表 2。离心结束后立刻小心吸取 0.4 ml 上层溶液得 Hib 游离多糖,备用。按照“1.2.3”优化后的条件进行水解,色谱条件见“1.2.2”,计算各离心条件下 Hib 游离多糖中的加标回收率,并按下式计算回收率(%)。通过游离多糖的加标回收率试验筛选出仅沉淀结合态多糖而不沉淀游离多糖的最佳超速离心条件。

表2 超速离心条件优化汇总Table 2 Summary of optimization of ultracentrifugation conditions
回收率(%)=(加标后的游离多糖含量 -加标前的游离多糖含量)/加标多糖值 × 100%
1.2.5 方法的验证
1.2.5.1 系统适用性和专属性 以 3.9232 μg/ml的 PRP 标准品溶液为样品,按上述选择的条件测定,连续进样 5 次,记录目的峰面积、保留时间和理论塔板数。同时记录多糖供试品溶液、游离多糖供试品溶液(批号均为 34-21064001)、空白对照多糖含量色谱图。
1.2.5.2 线性 将 PRP 标准品储备液用超纯水稀释至 0.1962、0.3923、0.9808、1.9616、3.9232、9.8080、15.6928、19.616 μg/ml,按优化条件将上述浓度的 PRP 标准品溶液分别进行 3 次多糖含量测定,根据目的峰峰面积与浓度的线性关系绘制标准曲线。
1.2.5.3 精密度 以批号 34-21064001、34-21064002、34-21064003 为样品,采用优化的方法将各样品平行测定 6 次,以建立的 PRP 校正曲线计算游离多糖重复测定的 RSD;各样品按优化条件在不同时间分 3 次检测游离多糖含量,验证方法的中间精密度。
1.2.5.4 准确性 分别在 3 批稀释后的冻干Hib 结合疫苗原液(批号:34-21064001、34-21064002、34-21064003)中加入已知浓度的 PRP标准品储备液,制备成 3 个浓度的 PRP 多糖溶液,其质量浓度分别为 0、0.9808、3.9232 μg/ml,按优化条件测定样品中游离 PRP 含量,计算游离多糖的平均加标回收率均值和 RSD。
2 结果
2.1 水解条件的确定
方法 a、b2、c2 水解供试品的目的峰面积达最大(图 2);与 a 和 c2 相比,方法 b2 的水解温度低且 NaOH 浓度相对小,因此确定方法 b2 水解供试品:即取供试品(PRP 浓度 0~19.616 μg/ml)0.5 ml 于 1.5 ml 离心管中,向离心管中加入 0.8 mol/L NaOH 溶液 0.5 ml,混匀,37 ℃ 下振荡水解 1.5 h。
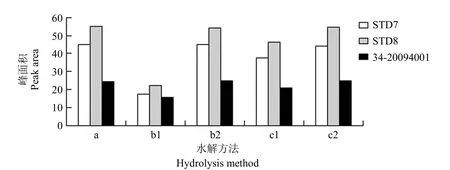
图2 供试品的最佳水解条件Figure 2 Optimal hydrolysis conditions for the test article
2.2 C4 固相萃取法分离游离多糖
在测定冻干 Hib 结合疫苗和冻干 Hib 结合疫苗原液的游离多糖含量时,乙醇分步沉淀法的测定结果分别为 9% 和 7%;C4 固相萃取法的测定结果分别为 32.7%~56.3%、40.6%~46.8%;而在测定 Hib 结合疫苗和 Hib 结合疫苗原液的游离多糖含量时,乙醇分步沉淀法的测定结果分别为8% 和 7%;C4 固相萃取法的测定结果分别为2.9%~3.6%、2.6%~3.2%。与乙醇分步沉淀法相比,C4 固相萃取法测得的冻干 Hib 结合疫苗和冻干Hib 结合疫苗原液的游离多糖含量显著偏高,而测得的 Hib 结合疫苗和 Hib 结合疫苗原液的游离多糖含量略低。
2.2 超速离心法的条件优化
不同离心条件下游离多糖供试品中的加标回收率见图 3,游离多糖的加标回收率接近 100% 所对应的离心条件即为最佳条件。根据实验结果确定分离 Hib 游离多糖的超速离心条件为 550 000 ×g、30 min。
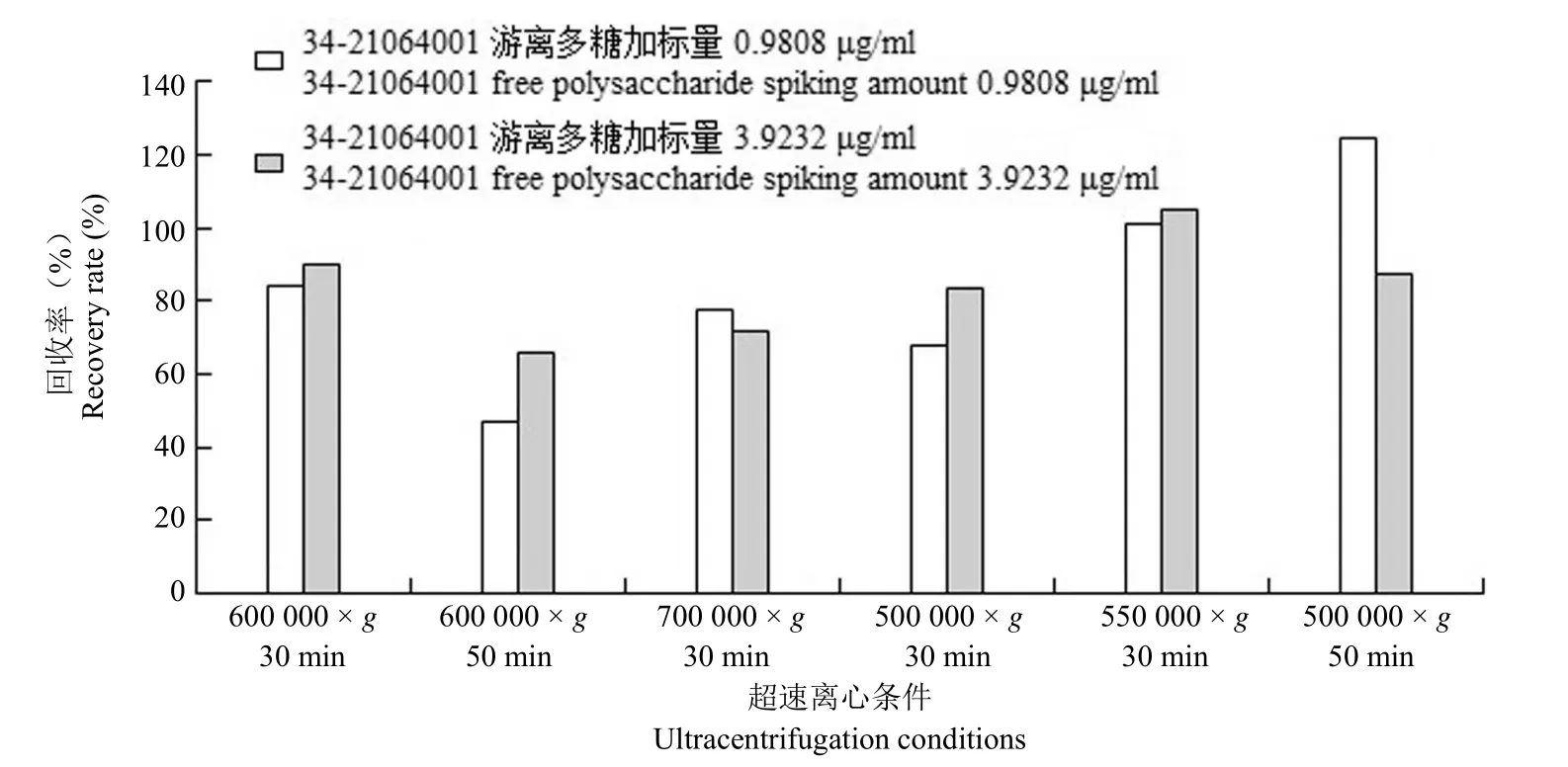
图3 供试品的最佳超速离心条件Figure 3 Optimal ultracentrifugation conditions for the test article
2.3 方法学验证
2.3.1 系统适用性和专属性 PRP 目的峰的理论塔板数均高于 10000,PRP 标准品的峰面积和保留时间测定值的 RSD 分别为 2.3%、0.1%(表 3);PRP 标准品、多糖供试品及游离多糖供试品在相应位置处均可见明显色谱峰,而空白溶液未见对应色谱峰(图 4)。实验结果表明,方法具有良好的系统适用性和专属性。
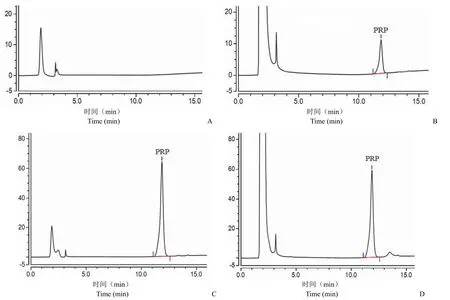
图4 专属性验证色谱图(A:空白溶剂;B:PRP 标准品;C:游离多糖供试品;D:多糖供试品)Figure 4 Specificity verification chromatogram (A: Blank solvent;B: PRP standard;C: Free polysaccharide test artcle;D: Polysaccharide test artcle)

表3 系统适用性验证结果Table 3 System suitability verification results
2.3.2 线性 将 8 个浓度的标准品溶液分别进行 3 次测定,PRP 浓度在 0.1962~19.616 μg/ml范围内与峰面积线性关系良好,R2均大于 0.99,见表 4。
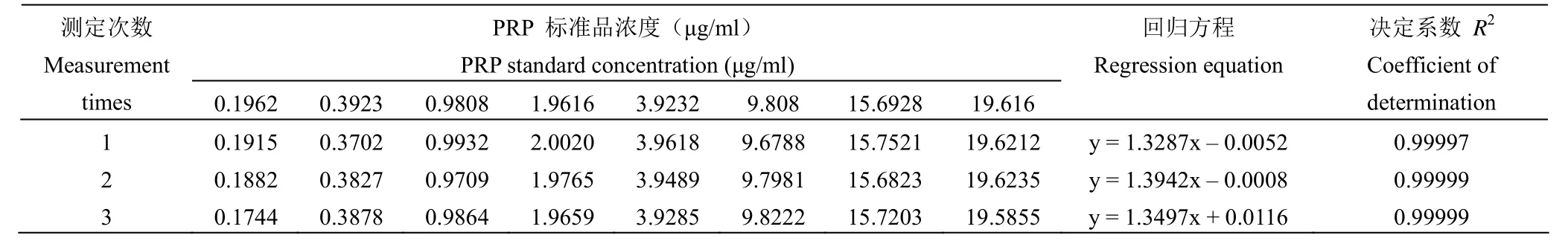
表4 线性回归方程及决定系数Table 4 Linear regression equation and coefficient of determination
2.3.3 精密度 3 批供试品重复测定 6 次游离多糖的 RSD 分别为 4.1%、2.3%、3.3%(表 5);不同时间测得中间精密度的 RSD 分别为 8.3%、3.6%、9.1%(表 6);结果表明方法具有很好的精密度。

表5 重复性验证结果(游离多糖含量,μg/ml)Table 5 Repeatability verification results (free polysaccharide content,μg/ml)

表6 不同时间中间精密度验证结果(游离多糖含量,μg/ml)Table 6 Intermediate precision validation results at different times (free polysaccharide content,μg/ml)
2.3.4 准确性 用优化后的超速离心法测定三批样品的游离多糖回收率(表 7)。34-21064001、34-21064002、34-21064003 的平均加标回收率分别为 102.9%、94.3%、92.0%,RSD 分别为 3.9%、8.7%、5.3%。结果表明,优化后的超速离心法具有良好的准确度。
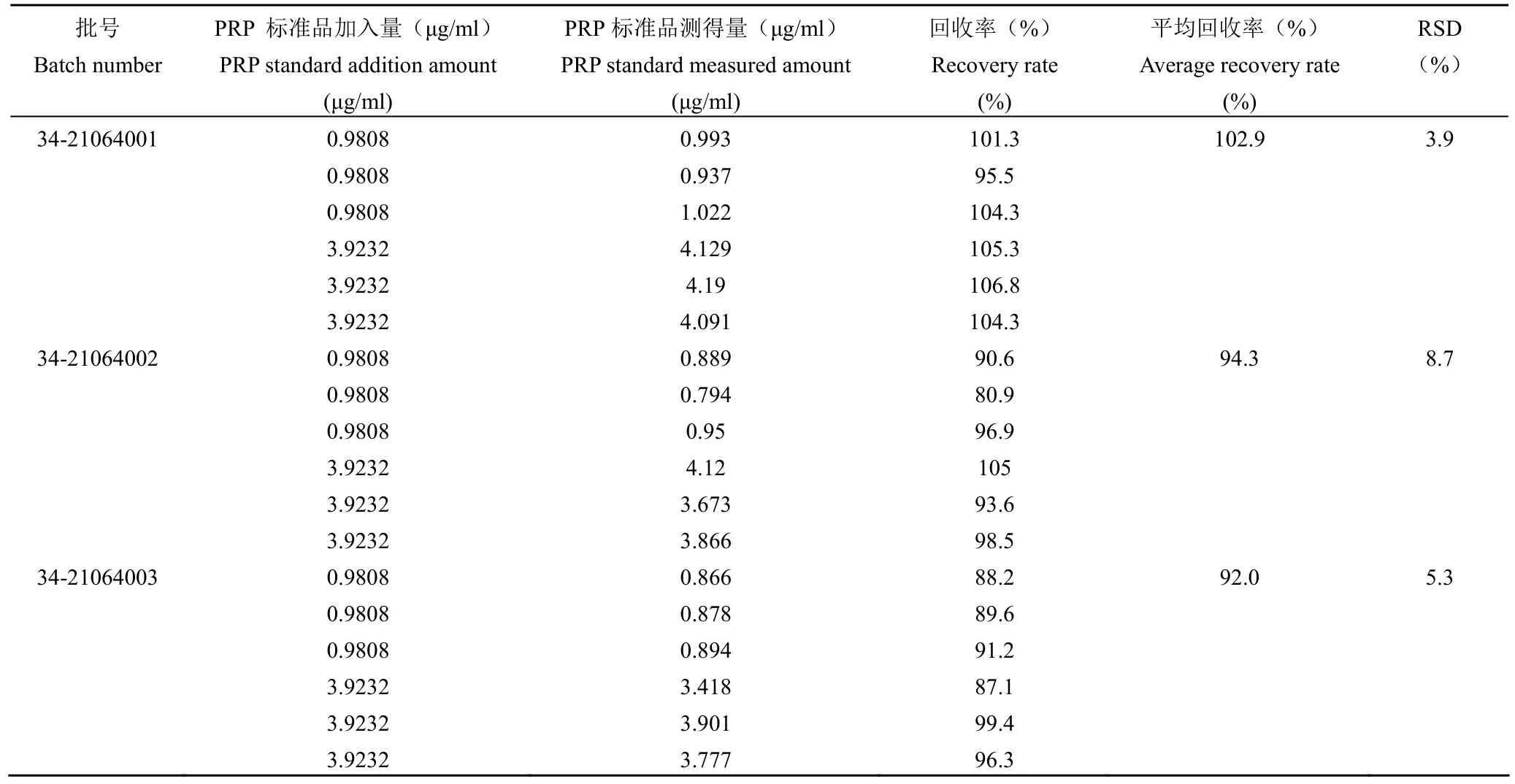
表7 加标回收率试验结果Table 7 Spiked recovery test result
2.4 超速离心法分离游离多糖
不同方法测定样品中游离多糖含量,乙醇分步沉淀法的结果分别为 7%、8%、9%;超速离心法的结果分别为 17.6%~19.4%、20.8%~21.6%、16.4%~20.9%。与乙醇分步沉淀法相比,超速离心法测得的冻干 Hib 结合疫苗原液的游离多糖含量略高。
3 讨论
游离多糖含量过高会显著影响 Hib 疫苗的免疫原性,因此监测游离多糖水平是 Hib 疫苗生产中质量控制和稳定性研究的重要指标。HPAEC-PAD 法[13-14]用于检测 Hib 疫苗中多糖含量备受关注。与药典规定的标准方法地衣酚法[15]相比,该方法选择性强、准确度好、灵敏度高(可精确到 pmol),可作为地衣酚法的替代方法检测Hib 疫苗中多糖含量。目前已报道的 Hib 游离多糖分离方法主要有疏水作用色谱(HIC)法[10]、乙醇分步沉淀法[7]、冷酚抽提法[16]、脱氧胆酸钠法[5,6,17]、超速离心法[12,18]等。冷酚抽提法和乙醇分步沉淀法分离游离多糖时因额外引入化学沉淀剂会对 HPAEC-PAD 测定多糖含量中的色谱柱造成损伤,缩短寿命甚至干扰测定[11]。脱氧胆酸钠法在分离时最大的困扰就是结合态多糖和游离多糖均为带电荷的两性物质,在溶液中形成的非特异性吸附可能造成游离多糖共沉,导致游离多糖含量测定值偏离真实值[19]。
3.1 C4 固相萃取法
疏水作用色谱(HIC)法根据载体蛋白中含有的疏水性残基与 HIC 柱固定相产生的疏水性相互作用而实现 Hib 游离多糖分离[10]。本实验根据HIC 法借助 C4 固相萃取柱分离 Hib 游离多糖。结果表明,与乙醇分步沉淀法相比,C4 固相萃取法测得的 Hib 结合疫苗和 Hib 结合疫苗原液的游离多糖含量偏低。究其原理发现,乙醇分步沉淀法的测定结果表征的是低分子质量结合多糖及游离多糖的总和,而 C4 固相萃取法的测定结果仅显示游离多糖含量[11],因此 C4 固相萃取法的测定结果理论上会低于乙醇分步沉淀法的测定结果。此外,研究还发现 C4 固相萃取法测得的冻干Hib 结合疫苗游离多糖含量显著高于乙醇分步沉淀法的测定结果,偏离 Hib 游离多糖的真实含量。本公司生产的冻干 Hib 结合疫苗与 Hib 结合疫苗的缓冲体系不同,根据供试品特点推测冻干Hib 结合疫苗的缓冲体系会干扰 C4 固相萃取柱分离 Hib 游离多糖,导致游离多糖分离失败。说明 C4 固相萃取法不适用于本公司冻干 Hib 结合成品中游离多糖含量测定。Guo 等[5]提出 HIC 法会存在载体蛋白缺乏疏水性残基或者个别游离多糖和 HIC 柱固定相结合而导致游离多糖分离失败的可能。因此,HIC 法分离 Hib 游离多糖不具有普适性。
3.2 超速离心法
超速离心法根据 Hib 结合物与游离多糖的分子大小、沉降系数等差异,借助超速离心机分离 Hib 游离多糖。与乙醇分步沉淀法相比,超速离心法测得的本公司冻干 Hib 结合疫苗原液的游离多糖含量略高。赵丹等[11]采用超速离心法测定的 Hib 游离多糖含量低于乙醇分步沉淀法结果,实验结果与文献报道不同。推测原因:①两种方法测定游离多糖时存在时间差,产品生产后即用乙醇分步沉淀法测定游离多糖含量,而超速离心法测定游离多糖含量时,样品已在 2~8 ℃ 放置 1 年左右且期间因优化需要已多次取样振荡;②超速离心法分离游离多糖需快速吸取上清实现游离多糖分离,对人员的操作要求很高,有待进一步验证来确定原因。赵丹等[11]优化的超速离心条件为500 000 ×g、30 min,Belfast 等[12]确定的超速离心条件为 600 000 ×g、30 min,而本研究优化的超速离心条件为 550 000 ×g、30 min,三种超速离心法的离心条件存在差异。推测不同公司生产的 Hib结合物与游离多糖的分子大小、沉降系数差异可能会导致超速离心法的离心条件不同。
本研究验证结果表明,PRP 浓度在 0.1962~19.616 μg/ml 范围内与峰面积呈良好的线性关系,R2均大于 0.99,6 次重复测定游离多糖的 RSD均小于 5%,不同时间测定游离多糖的 RSD 均小于 10%,表明该方法具有良好的精密性。游离多糖的加标回收率均在 80%~120% 范围内,表明该方法具有良好的准确度。结果证明,该方法有很好的线性、精密度、准确度及专属性,可用于冻干 Hib疫苗中游离多糖含量检测。
综上所述,本研究初步建立了检测冻干 Hib结合疫苗游离多糖含量的超速离心联合HPAEC-PAD 法,可作为 Hib 结合疫苗游离多糖含量的检测方法,对完善该疫苗游离多糖质量控制具有很好的指导作用,同时也给其他多糖蛋白结合疫苗中游离多糖含量的检测提供了参考。

