siCAP2 对HCCLM3 迁移、侵袭和耐药的影响和在仿生消化道系统中的稳定性研究
孟金凤,闫攀登,董志忠
原发性肝癌是目前我国常见恶性肿瘤,主要包括肝细胞癌(hepatocellular carcinoma,HCC)、肝内胆管癌(intrahepatic cholan giocarcinoma,ICC)和 HCC -ICC 混合型 3 种不同病理类型,其中HCC 占到 85%~90%[1]。肝癌发病隐匿、恶性程度高、预后较差,严重威胁国民的生命和健康[2]。siRNA 核酸药物分子量小,设计便利,通过靶点基因 mRNA 配对降低其表达水平,无免疫原性,近年来已有约 10 种基于 RNAi 技术治疗癌症的药物进入临床试验[3]。然而筛选 siRNA 需要综合其表达水平、基因功能和稳定性等因素,其中评估siRNA 口服过程经消化系统后的稳定性是个迫切需要解决的问题[4]。
腺苷酸环化相关蛋白 2(adenylate cyclase-associated protein 2,CAP2)属于环化酶相关蛋白家族成员,N-端结构域可结合 Ras 响应的腺苷酸环化酶,C-末端结构域含有肌动蛋白(actin)结合的区域[5]。研究显示 CAP2 在肝癌组织中高表达,而在正常肝组织中不表达或表达较弱,高表达CAP2 的患者较低表达 CAP2 的患者死亡率高,促进肝癌细胞的上皮间质转化,在肝癌的发生或发展中起到“致癌基因”的角色[6-7]。因此,该研究进一步采用 siRNA 技术在肝癌细胞系中敲低 CAP2的表达,观测其对肝癌细胞系迁移和侵袭,耐药性的影响,并采用仿生模拟上消化道技术进一步评估siCAP2 核酸分子经上消化道系统的稳定性。以期为抑制肝癌转移或抗药性提供新的科学技术方法。
1 材料与方法
1.1 材料
1.1.1 肝癌组织和癌旁组织的样本 本研究入选的肝癌患者的样本于 2015 年取自浙江大学附属第一医院以及北京肿瘤医院。该实验经军事医学科学院伦理学委员会批准。入选的患者具备以下条件:①确诊的 HBV 相关的原发性肝细胞癌患者;②术前未经化疗或介入治疗;③所选肿瘤组织应避免坏死,尽量为生长活跃区;非肿瘤肝组织取自手术可以得到的距离肿瘤边界最远处的肝组织(距癌组织至少 2 cm,镜下无癌灶),更多细节见文献[8]。
1.1.2 细胞系 人正常肝细胞 LO2 细胞系、肝癌细胞系 HepG2、HCCLM3、Bel-7402、SMCC-7721和 MHCC-97H 均购自中国细胞资源库,并在本实验室的样本库保存。
1.1.3 主要试剂 细胞培养所用培养基(Dulbecco's modified Eagle's medium,DMEM)及胰酶购自北京细工生物科技公司;胎牛血清购自Gibco 公司;siRNA 转染试剂购自广州锐博生物科技有限公司;反转录试剂盒购自 Takara 公司;SYBR Green 定量试剂盒购自 KAPA Biosystems;大、小RNA 分离提取试剂盒购自德国 Macherey-Nagel;GAPDH 抗体购自美国 Proteintech 公司;CAP2抗体、碘化丙锭(propidium iodide,PI)、Annexin V FITC apoptosis 购自美国 Sigma 公司。
1.2 方法
1.2.1 CAP2 免疫组化实验及数据验证集 免疫组化方法与参考文献[9]相似。验证数据集采用http://lifeome.net/database/hccdb 数据库,在数据库中检索其 Gene ID:10486,NM_006366.2 得到CAP2 在其他肝癌和癌旁组织中的蛋白表达水平。
1.2.2 RNA 的提取、浓度测定和荧光定量 待到细胞密度长到 80% 左右,消化收集细胞于 EP 管中并用 PBS 洗一遍,离心弃上清。加入 Trizol 裂解液,按照操作步骤进行。RNA 质量的OD260/280在 1.95~1.99 之间,OD260/230在 2.32~2.38,浓度大于 10 ng/μl,判断为符合 RNA 质量标准。按照反转录试剂盒说明书将提取到的 RNA 反转录为 cDNA,并在荧光定量 PCR 仪上对上述 RNA进行定量。其中使用的引物序列为表 1 所示。

表1 实时荧光定量 PCR 引物序列Table 1 Real time fluorescent quantitative PCR primer sequence
1.2.3 瞬时转染实验 按照 riboFECTTMCP 转染试剂盒说明书操作进行。为避免外界因素(包括酶、极端 pH 或者温度条件等)导致产品降解,所有操作在无 RNA 酶环境中进行。
1.2.4 细胞生长、凋亡、迁移和侵袭 细胞生长实验参考[10],采用 CCK-8 法,根据试剂盒方法检测。
凋亡实验参考文献[11],步骤如下:①瞬时转染 siRNA 48 h 后,用不含 EDTA 的胰酶消化,300 ×g,4 ℃ 离心 5 min 收集细胞;②用预冷的PBS 洗涤细胞 2 次,收集 1 × 105~5 × 105细胞;③加入 100 μl 1 × Binding Buffer 重悬细胞;④加入 5 μl Annexin V-FITC 和 5 μl PI 染色液,轻轻混匀;⑤避光、室温反应 10 min;⑥加入 400 μl 1 ×Binding Buffer,混匀,样品在 1 h 内用流式细胞仪或荧光显微镜检测。流式细胞仪分析:用 CellQuest等软件进行分析,绘制双色散点图,FITC 为横坐标,PI 为纵坐标。每个样采集 10 000 个细胞。典型的实验中,细胞可以分成三个亚群,活细胞仅有很低强度的背景荧光,早期凋亡细胞仅有较强的绿色荧光,晚期凋亡细胞有绿色和红色荧光双重染色。
细胞迁移和侵袭:在 24 孔板中加入含 20%FBS 的培养基 800 μl,将 Transwell 小室轻轻放入24 孔板的孔里,取 200 μl 用 DMEM 重悬的细胞悬液(含有 2 万个细胞)加入到 Transwell 小室内,在培养箱中培养 30 h。将小室移至装有 1 ml甲醇的 24 孔板中固定 30 min。将小室移至加入1 ml 0.5% 的结晶紫溶液的孔中染色 30 min。最后用 PBS 轻轻冲洗小室,晾干小室并在显微镜下对穿过小室的细胞进行拍照,取 5~10 视野进行细胞计数,统计分析。侵袭实验操作与迁移实验操作基本相同,区别是采用的小室底部还有一层基质胶。每个小室需要铺的细胞数是 Transwell 实验的2 倍,约 4 万个。
1.2.5 药物敏感实验 参考文献[12]稍作修改,在 96 孔板中铺 4000 个 HCCLM3 细胞待细胞长到 80% 左右分别进行 si-NC 和 siCAP2 瞬时转染,36 h 后,分别加 0、3.125、6.25、12.5、25、50 μmol/L 的索拉菲尼和 0、1.25、2.5、5.0、10.0、20.0、40.0 μmol/L 的顺铂作用 12 h,采用 CCK-8方法测试吸光度。
细胞活力=(实验组吸光度 -空白组吸光度)/(未加药物处理组吸光度 -空白组吸光度)× 100%,其中,实验组为加不同浓度的药物处理组,空白组为只加 CCK-8 溶液无细胞样品组。
1.2.6 蛋白质提取及蛋白质免疫印迹实验 加入细胞裂解液置于冰上裂解 30 min。12 000 r/min 离心 10 min,收集上清液,然后加入上样缓冲液,煮样,得到细胞总蛋白样品。SDS-PAGE 凝胶电泳分离细胞总蛋白,采用湿转方法电转,室温封闭 2 h,于 4 ℃ 孵育一抗过夜,TBST 洗脱 15 min,室温孵育二抗 2 h,再用 TBST 洗脱 15 min,显影。以 GAPDH 作为内参蛋白。实验独立重复 3 次。
1.2.7 siRNA 体外模拟消化实验 参考文献[13]稍作修改,取 siCAP2、si-NC 各 200 nmol/L,分别和等体积的水、蛋白质溶液(5%)、脂肪溶液(5%)制成 100 nmol/L 的溶液,分别经过模拟胃、模拟小肠阶段,检测消化过程中的 siRNA 浓度。仿生胃消化液中各组分浓度为 K+9.75 mmol/L、Na+90.25 mmol/L、Cl-67.63 mmol/L、H2PO4-1.125 mmol/L、CO32-25.5 mmol/L、Mg2+0.15 mmol/L、NH4+1.25 mmol/L、Ca2+0.15 mmol/L、胃蛋白酶2000 U/ml、pH 调为 2。模拟胃消化 2 h 后取样测试 siRNA 浓度。模拟仿生肠消化液中的各组分浓度为:K+9.5 mmol/L、Na+154.3 mmol/L、Cl-56.5 mmol/L、H2PO4-1 mmol/L、HCO3-106.3 mmol/L、Mg2+0.42 mmol/L、Ca2+0.6 mmol/L、胰液素(胰液提取物)100 U/ml、胆盐 10 mmol/L、淀粉葡萄糖苷酶 10 U/ml,转化酶 3 U/ml,调 pH 为 7,模拟小肠消化阶段 2 h 后取样测试 siRNA 浓度。
仿生模拟动态消化系统参考文献[14]并稍作修改,胃部挤压速度默认设定为 2 mm/s,挤压位置默认设定为 30 mm;幽门挤压速度默认设定为2 mm/s;挤压末端默认设定为 30 mm;挤压张开位置默认设定为 15 mm。
1.3 统计学处理
采用 SPSS 16.0 统计软件进行统计分析,两组间数据的比较采用 Studentt检验;P< 0.05 为差异有统计学意义。
2 结果
2.1 CAP2 蛋白在肝癌组织中显著高表达
如图 1 所示,50 例肝癌和癌旁组织中 CAP2的免疫组化的实验结果显示,CAP2 可定位于肝癌细胞的细胞质、细胞核和细胞膜上,肝癌组织中的表达水平显著高于其癌旁组织(0 分,阴性;2~4 分,低表达;5~8 分,高表达,选取 5 个视野做平均值)。同时,在 HCCDB 数据中,有HCCDB1、HCCDB3、HCCDB4、HCCDB6、HCCDB7、HCCDB11、HCCDB12、HCCDB13、HCCDB15、HCCDB16、HCCDB17、HCCDB18 共12 个数据来源,其中 10 个数据库中,均显示CAP2 在 1880 例肝癌中蛋白质的表达显著高于1339 例癌旁组织。
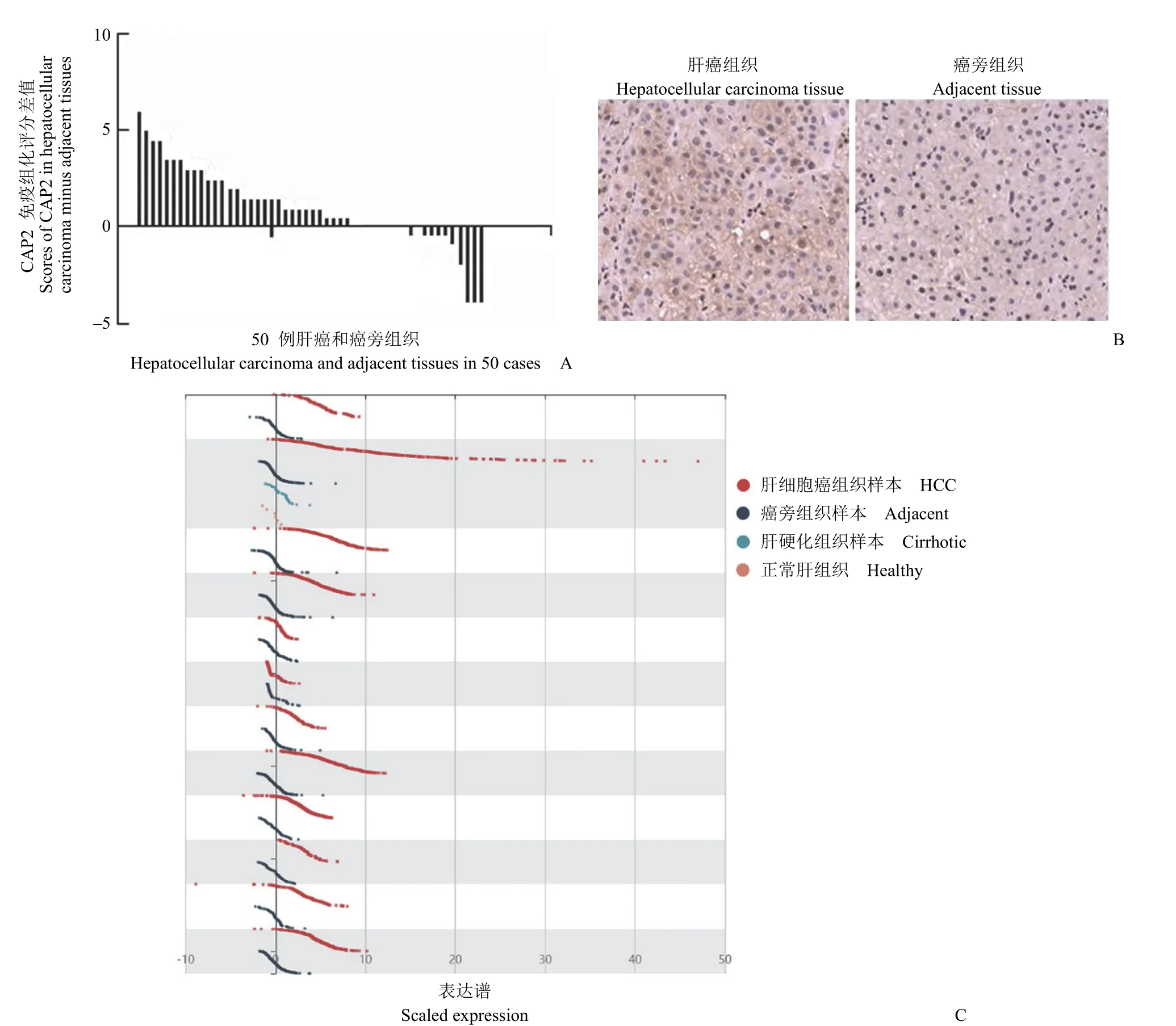
图1 CAP2 在肝癌组织中的蛋白质表达水平高于癌旁组织(A:CAP2 在肝癌中的免疫组化评分与癌旁的差值;B:CAP2的免疫组化的代表性图例;C:HCCDB 数据中 CAP2 的表达)Figure 1 The protein expression level of CAP2 in hepatocellular carcinoma is higher than that in adjacent tissues (A: Scores of CAP2 in hepatocellular carcinoma minus adjacent tissues;B: Representative legend of CAP2 immunohistochemistry;C: Expression of CAP2 in HCCDB data)
2.2 CAP2 促进肝癌细胞系的迁移和侵袭
如图 2 所示,CAP2 蛋白在 HCCLM3、MHCC-97H 比 LO2、HepG2、Bel-7402 高表达。敲低 CAP2 后,HCCLM3 细胞迁移数为对照的16.3%(38.4vs.235.2,P< 0.001);HCCLM3 细胞侵袭数为对照的 24.2%(21.0vs.86.6,P< 0.001)。与之对应,过表达 CAP2 后,HCCLM3 细胞迁移为对照组的 1.6 倍(331.0vs.202.4,P< 0.001);HCCLM3 细胞侵袭为对照组的 4 倍(359.0vs.86.6,P< 0.001)。
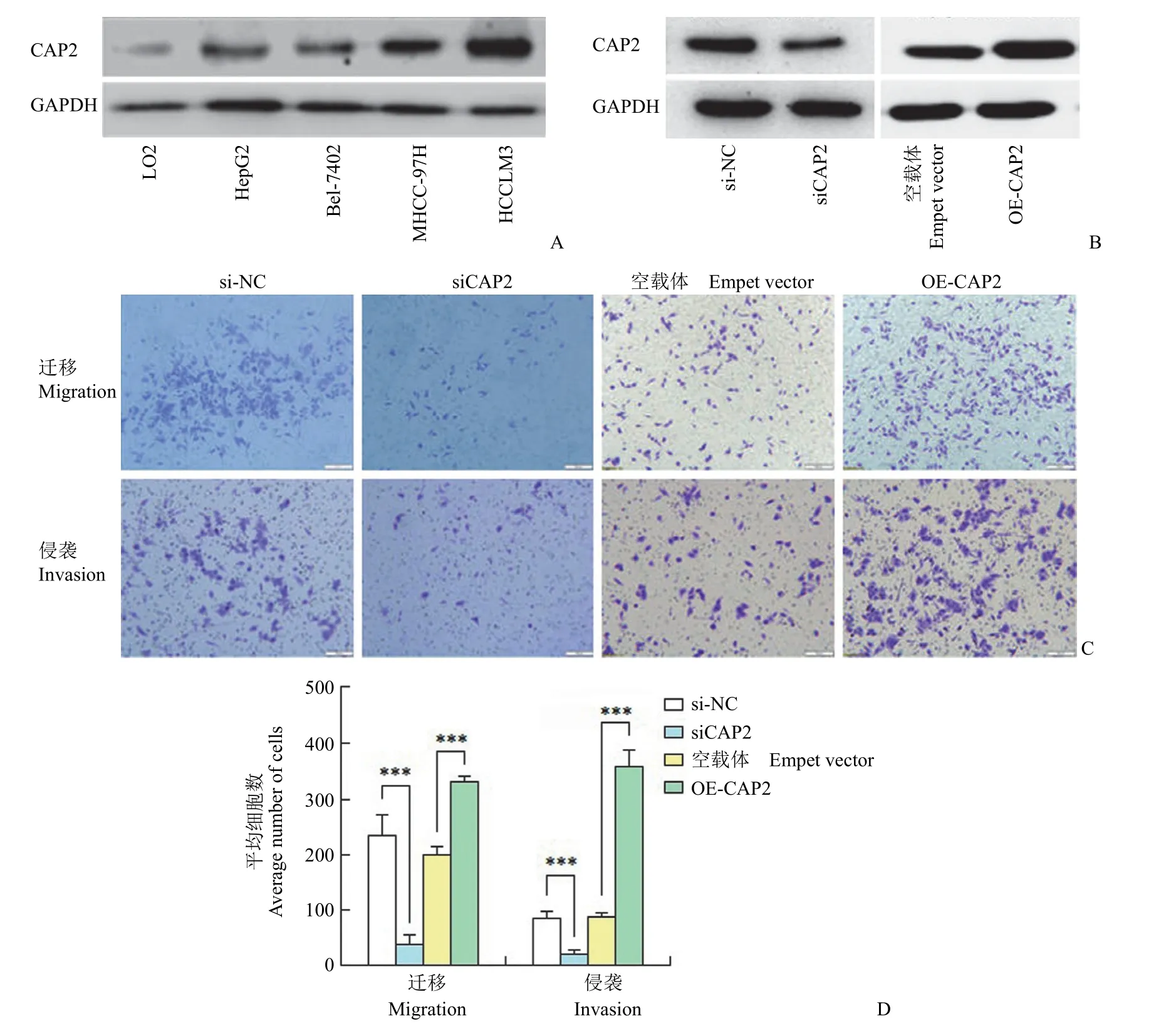
图2 扰动 CAP2 对 HCCLM3 迁移和侵袭的影响(A:CAP2 在细胞中的蛋白表达;B:HCCLM3 细胞中分别敲低 CAP2和过表达 CAP2;C~D:HCCLM3 扰动 CAP2 表达后的迁移和侵袭图例和统计分析,siCAP2 表示敲低 CAP2,OE-CAP2表示过表达 CAP2、si-NC 和空载体分别为对照组,***P < 0.001)Figure 2 Effects of disturbed CAP2 expression on migration and invasion of HCCLM3 (A: Protein expression of CAP2 in cells;B:Expression of CAP2 after knockdown or overexpression of CAP2 in HCCLM3 cells,respectively;C -D: Representative legend and statistical analysis of migration and invasion after perturbing CAP2 expression in HCCLM3 cells.siCAP2 represents knockdown of CAP2 expression,OE-CAP2 represents overexpression of CAP2,and si-NC and empty vector are control groups respectively,***P <0.001)
2.3 siCAP2 提高肝癌细胞对索拉菲尼或顺铂的敏感性
如图 3 所示,在顺铂或者索拉菲尼处理的情况下,抑制 CAP2 后细胞的活力比对照组显著下降,半数致死量更小。HCCLM3 细胞在索拉菲尼0、3.125、6.25、12.5、25、50 μmol/L 浓度下,对照组和抑制 CAP2 组细胞活力的平均值为 100%vs.100%;80%vs.71%;55%vs.44%;42%vs.34%;38%vs.32%;19%vs.18%。HCCLM3 在顺铂 0、1.25、2.5、5.0、10.0、20.0、40.0 μmol/L 浓度下,对照组和抑制 CAP2 组的细胞活力的平均值为100%vs.100%;96.5%vs.96.4%;93.4%vs.93.2%;83.4%vs.76.5%;74.1%vs.60.5%;58.1%vs.48.9%;17.4%vs.11.5%。
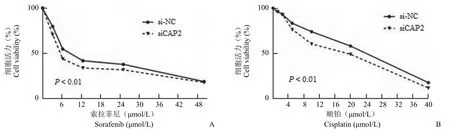
图3 HCCLM3 在索拉菲尼(A)、顺铂(B)刺激下转染 si-NC、siCAP2 后细胞活力的水平Figure 3 Cell viability after HCCLM3 was transfected with si-NC and siCAP2 under the stimulation of sorafenib (A) and cisplatin(B)
2.4 siCAP2 联合索拉菲尼或顺铂显著促进肝癌细胞的凋亡
如图 4 所示,在索拉菲尼的刺激下,抑制CAP2 组的细胞的早期凋亡比例比对照组早期凋亡高 15.24%(21.30%vs.6.06%,P< 0.001),抑制CAP2 组的细胞的晚期凋亡和对照组无显著差异(64.4%vs.64.95%,P> 0.05),抑制 CAP2 组的细胞的总凋亡比对照组增高 13.59%(85.70%vs.71.11%,P< 0.01)。在顺铂刺激下,抑制 CAP2 组的细胞的早期凋亡比例比对照组高 2.5%(5.81%vs.3.31%,P< 0.01),抑制 CAP2 组的细胞的晚期凋亡比对照组高 15.05%(78.85 %vs.63.80%,P<0.001),抑制 CAP2 组的细胞的总凋亡比对照组增高 17.55%(84.66%vs.67.11%,P< 0.001)。
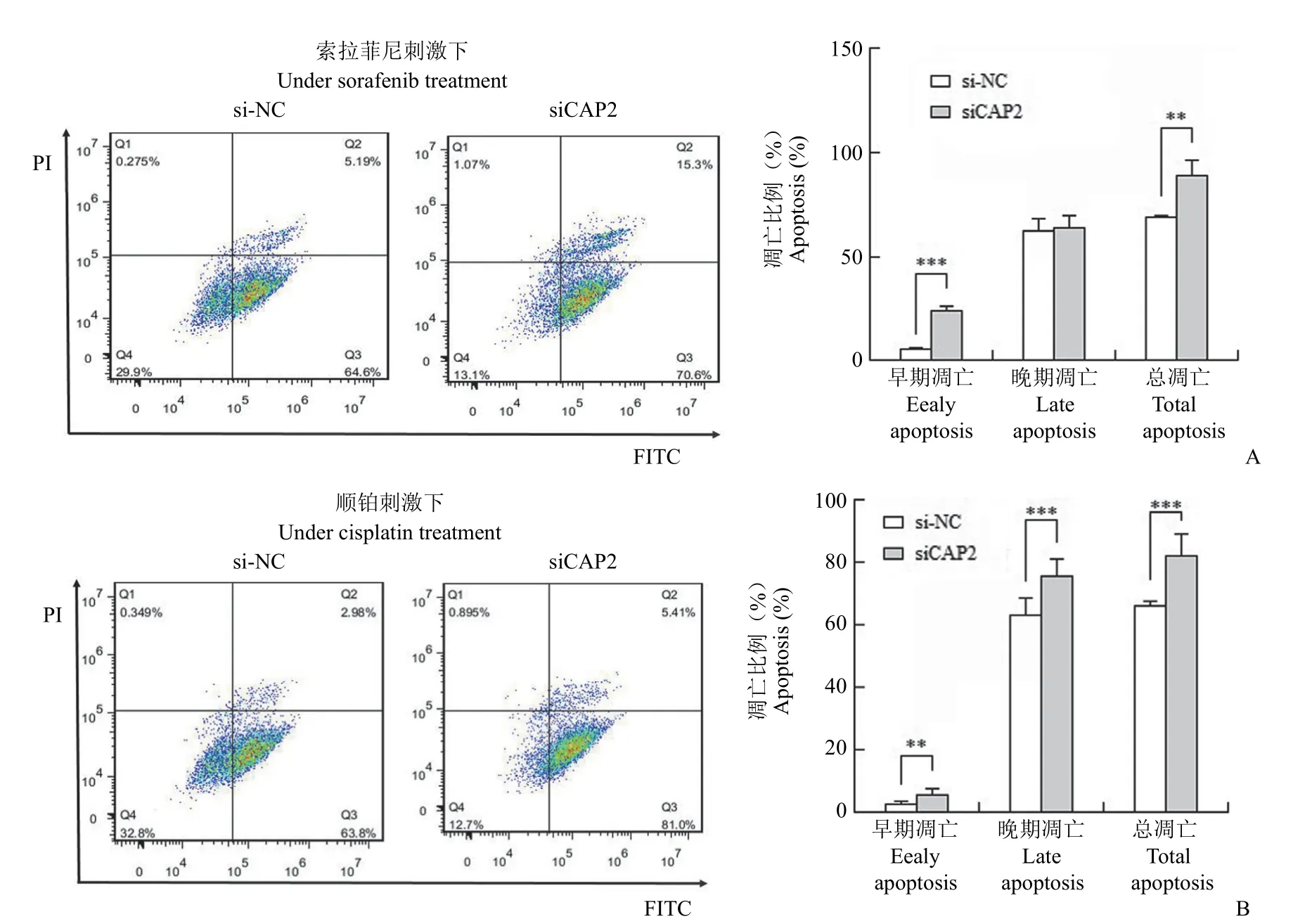
图4 索拉菲尼(A)或者顺铂(B)刺激下,HCCLM3 细胞的凋亡流式图及凋亡比例统计(**P < 0.01,***P < 0.001)Figure 4 Inhibition of CAP2 significantly promote cell apoptosis under sorafenib or cisplatin treatment (A: Detection of apoptosis level of HCCLM3 cells after inhibition of CAP2 by sorafenib;B: Detection of apoptosis level of HCCLM3 cells after inhibition of CAP2 by cisplatin;C: Statistics of apoptosis ratio of cells,t test was used between the two groups,**P <0.01,***P < 0.001)
2.5 siRNA 在模拟上消化系统中的稳定性
如图 5 所示,对照组和抑制 CAP2 组如果只和水溶液混合,其经过仿生胃消化阶段的平均保留率分别为 80.5%、78.5%;对照组和抑制 CAP2 组水溶液经过胃-肠消化阶段的平均保留率为 30.2%、29.8%。
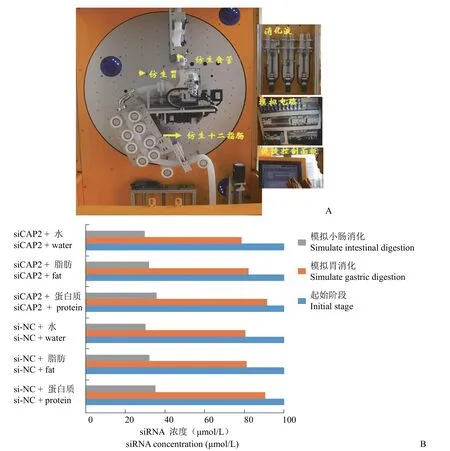
图5 siRNA 在模拟上消化系统中的稳定性(A:仿生模拟上消化道示意图;B:siRNA 在不同溶液中经过上消化道系统后的稳定性)Figure 5 Stability of siRNA mimicking upper digestive system (A: Schematic diagram of bionic simulation of upper digestive tract;B: Stability of siRNA in different solutions after passing through upper gastrointestinal system)
对照组和抑制 CAP2 组如果只和蛋白质溶液混合,其经过仿生模拟的胃消化阶段的平均保留率为 90.5%、91.5%;对照组和抑制 CAP2 组蛋白质溶液组经过胃-肠消化阶段的平均保留率为 35.2%、35.8%。
对照组和抑制 CAP2 组如果只和脂肪溶液混合,其经过仿生模拟的胃消化阶段的平均保留率为 81.2%、82.2%;对照组和抑制 CAP2 脂肪溶液组经过胃-肠消化阶段的平均保留率为 32.2%、32.0%。
由此可见对照组和抑制 CAP2 组在体外胃肠消化阶段其核酸含量显著下降(P< 0.01),且 siRNA和蛋白质或者脂肪溶液复配比单独和水混合其在消化系统中的保留率更高(P< 0.01)。对照组和抑制 CAP2 组别之间无显著差异(P> 0.05)。
3 讨论
可广泛应用的 siRNA 核酸药物需要具备功能明确、稳定性好等特点。本研究发现 CAP2 在肝癌组织中以及肝癌细胞系显著高表达,siCAP2 显著抑制 HCCLM3 细胞的迁移和侵袭。siCAP2 可促进 HCCLM3 凋亡,增强其对索拉菲尼、顺铂的药物敏感性。siCAP2 在仿生模拟上消化道系统中稳定性为 29.8%~35.8%。
较早的研究发现 CAP2 蛋白属于环化酶相关蛋白家族成员,N-端结构域可结合 Ras 响应的腺苷酸环化酶;C-末端结构域含有肌动蛋白结合的区域;哺乳动物中 CAP2 的序列相似性占 88%~93%[15]。在敲除 CAP2 的小鼠中发现,成纤维细胞分化为肌成纤维细胞的比例下降,新血管生成较慢,说明缺失 CAP2 导致了细胞骨架受损。CAP2在维持 G-actin 和 F-actin 的比例有不可或缺的作用,较少应力纤维的外周肌动蛋白丝的致密网状结构可导致细胞运动性降低,进而影响细胞的黏附和迁移[16]。CAP2 的高表达与较高的肝癌死亡率有关[17-18]。这种显著的变化,有利于 CAP2 蛋白作为肝癌早期诊断的一个标志物。肝癌细胞系 KYN2和 PLC/PRF/5 中,CAP2 沉默导致了片状伪足形成的缺陷,并降低了肝癌细胞的活力;CAP2 表达显著与肿瘤大小、分化程度低、门静脉癌栓以及肝内转移正相关[19],提示 siCAP2 有一定的临床价值[20]。CAP2 除了与肝癌的发生发展相关,也与恶性黑色素瘤、胃癌、结肠癌密切相关。如 CAP2 在恶性黑色素瘤高表达,参与了恶性黑色素瘤的侵袭性行为[21];与胃癌、结肠癌患者预后密切相关[22-24]。结肠癌组织中 CAP2 mRNA、CAP2 蛋白表达水平均明显高于癌旁组织,且在分化程度低、浸润程度深、III 与 IV 期、淋巴结转移、结肠癌组织中CAP2 蛋白阳性表达率更高,高表达 CAP2 的患者5 年生存率显著低于阴性表达患者[25]。上皮性卵巢癌中 CAP2 的上调与侵袭性组织学类型和更差的结果相关[26]。CAP2 突变导致肌动蛋白动力学受损并与室上性心动过速和扩张型心肌病[27]。由以上研究可见,CAP2 基因可通过激活环磷酸腺苷(c-AMP)或调节肌动蛋白及细胞骨架蛋白运动而在疾病或肿瘤的进展中发挥着很大的作用。
索拉菲尼是一种多激酶抑制剂,能同时抑制多种存在于细胞内和细胞表面的激酶,包括 RAF 激酶、血管内皮生长因子受体-2(VEGFR-2)、血管内皮生长因子受体-3(VEGFR-3)、血小板衍生生长因子受体-β(PDGFR-β),常用于无法手术或者远处转移的肝癌的治疗[28]。顺铂主要作用在 DNA的嘌呤和嘧啶碱基,可抑制癌细胞的 DNA 复制过程,并损伤其细胞膜的结构,有较强的广谱抗癌作用[29]。有研究报道,激活 NF-κB 抑制细胞的凋亡是细胞对索拉菲尼或顺铂产生抗药性的机制之一[30-32]。本研究发现 siCAP2 可促进 HCCLM3 凋亡,增强其对索拉菲尼、顺铂的药物敏感性。提示临床上应用 siCAP2 或许有提升化疗效果的意义。
然而 siRNA 在体内到靶细胞的稳定性一直是个难题,人体或动物实验存在实验周期长,伦理学限制等难题。虽然目前有纳米粒包裹 RNAi 药物,在核苷酸的特定位置进行化学修饰,以及用硫代磷酸键取代磷酸二酯键等方法可大幅改善核酸偶联物对核酸酶的稳定性[33-35]。但由于体内存在大量核酸酶,核酸分子很容易降解 siRNA[36]。口服 siRNA要达到多少剂量才能经过消化系统后保留到可以发挥功能的剂量一直缺少快捷的考察方法。本研究采用了仿生模拟上消化道技术,表征了 siRNA 经上消化道后 RNA 的稳定性。结果发现 siCAP2 在仿生模拟上消化道系统中稳定性为 29.8%~35.8%。将 siRNA 复配蛋白质或脂肪溶液共同“服用”比只加水更稳定,为推测口服 siRNA 的剂量提供技术方法。
本研究也有一定局限性,如细胞表型相关的实验仅在一种高转移性的 HCCLM3 细胞系验证,需要在多种细胞系验证以及进一步验证其细胞表型相对应的指标。又因为主要考虑采用 RNAi 的方法应用于临床,不会采用过表达质粒载体的方法,所以在药物敏感性实验方面只做了 siCAP2,未考虑过表达 CAP2。同时采用模拟上消化道技术评估siRNA 在上消化道的稳定性,国内外类似研究较少,需要进一步加大其应用。

