牙本质基质蛋白-1对白细胞介素-1β诱导的大鼠软骨细胞炎症损伤的研究
鲁斌,程加峰,汪洋,冀林,王岩松,赵平*
(1.芜湖市第一人民医院骨一科,安徽 芜湖 241000;2.哈尔滨市第一医院骨一科,黑龙江哈尔滨 150081;3.哈尔滨医科大学附属第一医院脊柱外科,黑龙江 哈尔滨 150081)
骨关节炎(osteoarthritis,OA)是一种常见的关节疾病,大约50%的65岁以上和12%的25岁以上人群患有此种疾病[1]。OA的主要病理机制是软骨细胞炎症、细胞外基质(extracellular matrix,ECM)降解、关节软骨丧失、软骨下骨增殖和骨赘形成,最终导致关节功能丧失[2]。目前,确定的OA危险因素包括衰老、肥胖或体重、关节损伤史、遗传、性别和解剖因素[3]。但是,OA的确切分子发病机制仍不清楚[4]。关节软骨没有自我修复能力,其稳态受到一系列因素的精确调控,因此了解OA过程中软骨细胞的稳态机制对于寻找OA有效治疗方案具有重要意义。研究表明,炎症参与了OA软骨细胞的病理过程[5]。关节腔微环境中的炎症因子如白细胞介素(interleukin,IL)-1β、IL-6和肿瘤坏死因子(tumor necrosis factor,TNF)-α可能会降低软骨细胞的活力并增加坏死和凋亡[6-7]。有研究已经确定了某些分子对OA的作用,例如OA期间乙酰化酶1(Sirtuin 1,SIRT1)活性和水平的降低会促进软骨的逐渐丧失,SIRT1抑制人OA软骨细胞中的基质金属蛋白酶(matrix metalloproteinase,MMP)-13,减少软骨基质的丢失[8]。对OA软骨细胞分子功能的不断探索将有助于本研究找出潜在的新型治疗靶点。
牙本质基质蛋白1(dentin matrix protein,DMP-1)是一种酸性细胞外基质蛋白,在牙本质和骨组织中高表达,在牙本质和骨形成中起到了重要的作用[9]。然而,目前尚未有研究DMP-1在OA软骨细胞中的作用。本研究评估了DMP-1在OA软骨细胞中的表达,并确定了其对软骨细胞的生物学作用。使用体外和体内模型评估DMP-1水平,测定了DMP-1对ECM合成、炎症、细胞凋亡的影响。这些发现揭示了DMP-1对OA发病机理,为治疗OA寻找潜在新型治疗靶点提供线索。
1 材料和方法
1.1 Affymetrix微阵列分析 作者从基因表达综合数据库下载GSE42295基因表达数据集[(Rat230_2) Affymetrix Rat Genome 230 2.0 Array],选取3例手术诱发的8周大鼠OA模型以及相应的对照组,通过DESeq软件包筛选对照组8周和OA组8周之间鉴别差异表达基因(differential gene expression,DEG)(P<0.05)[10],进而分析OA大鼠模型中软骨细胞的DMP-1的水平。
1.2 建立体外OA模型 挑选新生的SD大鼠(体重5~6 g),处死大鼠,膝关节获取关节软骨,将软骨组织切成1~3 mm3的小块。在37 ℃下用2 mg/mL胶原酶Ⅱ(Sigma)消化3 h,将消化的软骨细胞悬浮在Dulbecco氏培养基(Dulbecoo's modified eagle medium,DMEM)中,该培养基中添加了1%青霉素/链霉素(碧云天)和10%胎牛血清(fetal bovine serum,FBS)(Sciencell公司)。在37 ℃、5%的CO2培养箱中进行培养,将第3代细胞用于后续的实验。使用IL-1β(10 ng/mL;Merk公司)刺激软骨细胞,建立体外OA模型[11]。
1.3 质粒的构建和细胞转染 DMP-1过表达质粒和阴性对照质粒通过上海吉玛基因设计合成。将软骨细胞以每孔5×106个细胞的密度接种到6孔板中过夜,当融合达到70%~80%的密度时,使用Lipofectamine®3000试剂进行转染。实验分为以下四组:对照组(软骨细胞,未经任何处理);IL-1β组(用IL-1β处理的软骨细胞);IL-1β+pcDNA组(用IL-1β处理并用阴性对照质粒转染的软骨细胞)和IL-1β+DMP-1组(用IL-1β处理并用DMP-1过表达质粒转染的软骨细胞)。
1.4 细胞活力测定 将软骨细胞以每孔8×103个细胞的密度接种到96孔板中,进行不同的处理,并培养6、12、24、48或72 h。细胞计数试剂(cell counting kit-8,CCK-8)(Dojindo分子技术公司)法用于测量细胞活力。向每个孔中添加20 μL的CCK-8试剂,继续将细胞在37 ℃下培养4 h。选择490 nm波长,在酶标仪上测定各孔光吸收值,并绘制生长曲线。
1.5 糖胺聚糖(glycosaminoglycan,GAG)检测 将处理过的软骨细胞更换10% FBS的DMEM,继续培养细胞10 h,抽取上清液,使用大鼠GAG的酶联免疫吸附剂测定(enzyme linked immuno sorbent assay,ELISA)试剂盒(EIAab公司)进行检测,并使用酶标仪(瑞士Tecan)在450 nm处测量吸光度,计算出样品浓度。
1.6 免疫荧光检测 将处理过的软骨细胞使用4%的多聚甲醛固定10 min,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗后加入牛血清白蛋白(bovine albumin,BSA)稀释的Col2a1一抗(Proteintech公司),37 ℃下孵育2 h后,加入山羊抗兔红色荧光二抗(Abcam公司),4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染细胞核后,加入抗荧光淬灭剂,在荧光显微镜下进行拍照。
1.7 软骨细胞mRNA的检测 进行实时荧光定量聚合酶链式反应(real time-quantitative polymerase chain reaction,RT-qPCR)检测DMP-1、Sox9、Acan、Col2a1的基因表达水平。提取细胞中总RNA。使用逆转录试剂盒(Takara)将RNA反转录为cDNA。使用2×Greenstar qPCR Master Mix(Vazyme)进行RT-PCR。根据结果计算基因表达。
1.8 ELISA分析 根据制造商的说明,使用特定的ELISA试剂盒(R&D Systems),收集经过不同处理的软骨细胞培养基,检测炎性细胞因子(IL-6和TNF-α)的水平。使用酶标仪(瑞士Tecan)测量450 nm处的吸光度。
1.9 蛋白质印迹法(western blot,WB) WB用于定量分析DMP-1、Sox9、Acan、Col2a1。提取总蛋白,使用蛋白质定量试剂盒(bicinchoninic acid,BCA)检测蛋白质的浓度。将每组总共50μg蛋白质滴加到10%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)凝胶上,使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离并转移到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上(Biosharp Life Sciences)。在室温下,使用5%脱脂牛奶将膜封闭1 h。将膜与一抗在4℃下孵育过夜,然后与二抗共同孵育1h。最后进行显色检测相应目的蛋白的表达情况。
1.10 活细胞/死细胞双染(Calcein-AM/PI)染色 提前配制Calcein-AM/PI染色工作液,用PBS洗涤处理过的细胞,每孔中加入200 μL染色工作液,在室温下避光孵育15 min,PBS洗涤细胞后,荧光显微镜检测染色结果。
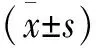
2 结 果
2.1 体内和体外OA模型的软骨细胞中DMP-1表达 使用微阵列分析在OA的体内模型中检测软骨细胞中DMP-1的表达,与对照组相比,8周OA体内模型中DMP-1表达明显降低(P<0.05;见图1a~b),表明DMP-1的下调可能与OA的严重程度有关。IL-1β处理用于建立体外OA模型,RT-qPCR(见图1c)和WB(见图1d)检测DMP-1表达,结果IL-1β处理后软骨细胞中的DMP-1表达明显降低。这些结果表明,在OA中软骨细胞中的DMP-1表达降低。

a 8周OA和对照组差异性基因表达火山图 b DMP-1在OA组和对照组基因表达差异 c 体外OA模型DMP-1的mRNA的表达 d 体外OA模型DMP-1蛋白的表达
2.2 DMP-1可提高IL-1β处理后的软骨细胞活力 为了观察DMP-1对IL-1β处理后的软骨细胞的作用,使用了DMP-1过表达质粒转染软骨细胞。在过表达DMP-1质粒转染后,经过DMP-1处理的软骨细胞中DMP-1的mRNA和蛋白表达均显著增加,而阴性对照组质粒对DMP-1表达没有显著影响(见图2a~c)。CCK-8分析用于评估细胞的生存能力,结果表明DMP-1+pcDNA阴性对照组质粒和对未转染质粒软骨细胞的生长速度没有显著区别。但是,DMP-1的过表达增加了用IL-1β处理的软骨细胞的生长速度(见图2d)。
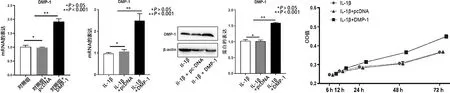
2.3 DMP-1减轻IL-1β诱导的软骨细胞变性 软骨细胞的变性主要表现为GAG水平降低和软骨特异性基因(包括Col2a1、Sox9和Acan)的表达降低。而且,ELISA检测表明与IL-1β组相比,IL-1β+DMP-1组中GAGs水平增加(见图3a)。细胞免疫荧光染色也表明,与IL-1β组相比,IL-1β+DMP-1组中Col2a1的表达增加(见图3b)。另外,软骨特异性基因的表达与上述结果一致。与IL-1β组相比,IL-1β+DMP-1组中Sox9、Acan和Col2a1(见图4a)mRNA的表达水平均增加,还评估了Sox9、Acan、Col2a1的蛋白质表达水平也同时上调(见图4b)。结果表明,DMP-1的过表达减轻了IL-1β诱导的软骨细胞变性。
a 未经IL-1β处理的软骨细胞转染DMP-1后mRNA表达水平 b 经过IL-1β处理的软骨细胞转染DMP-1后mRNA表达水平 c 经过IL-1β处理的软骨细胞转染DMP-1后的蛋白表达水平 d 转染DMP-1后不同条件下软骨细胞生长速度比较
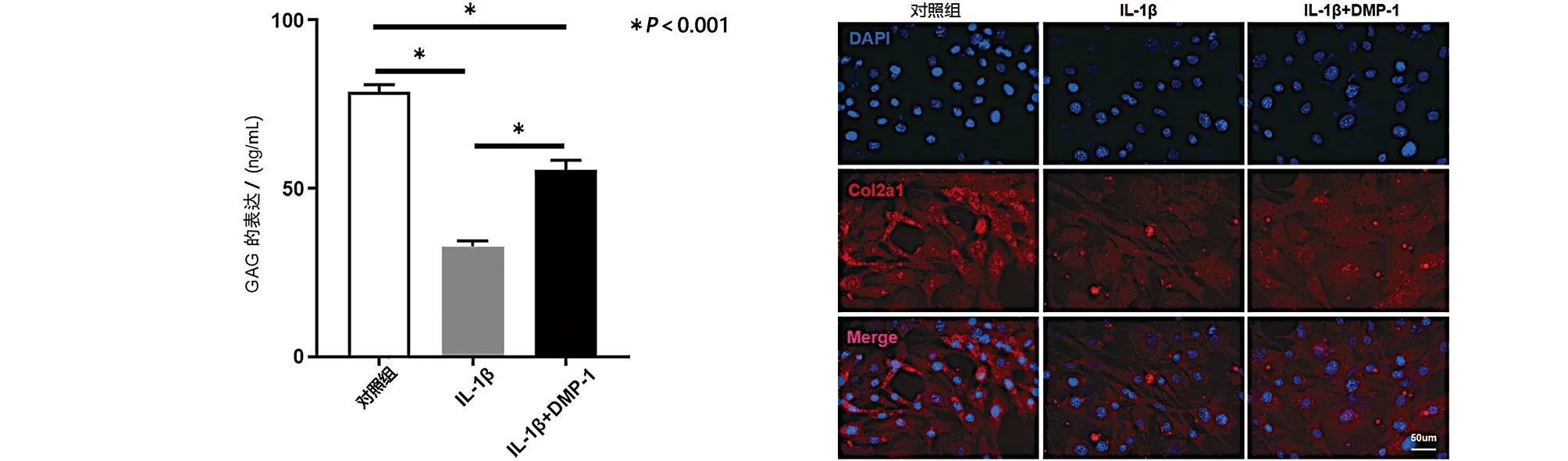
a 不同条件下软骨细胞分泌的GAG定量分析 b 不同条件下软骨细胞Col2a1免疫荧光表达情况(免疫荧光,×400)
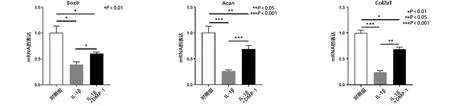
a 不同处理条件下软骨细胞Sox9、Acan、Col2a1 mRNA的表达
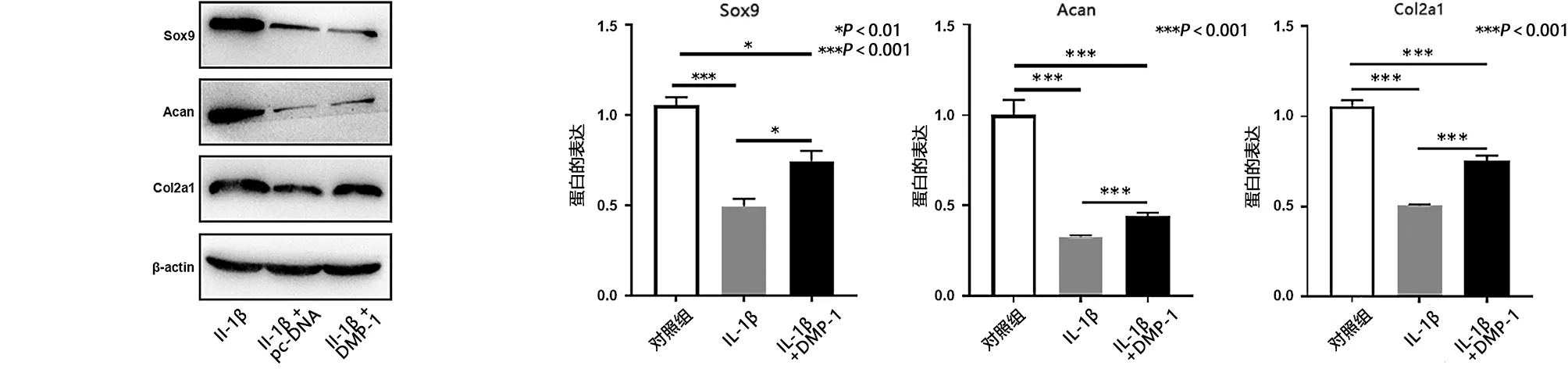
b 不同处理条件下软骨细胞Sox9、Acan、Col2a1蛋白的表达
2.4 DMP-1减少IL-1β诱导的软骨细胞炎症 检测DMP-1对软骨细胞炎症的影响。ELISA法显示,与IL-1β组相比,IL-1β+DMP-1组中OA中关键炎症因子(如IL-6和TNF-α)的含量均降低(见图5a)。此外,IL-1β+DMP-1组中细胞的凋亡率低于IL-1β组(见图5b~c)。结果表明,DMP-1的过表达减轻了用IL-1β刺激处理的软骨细胞的炎症和凋亡。
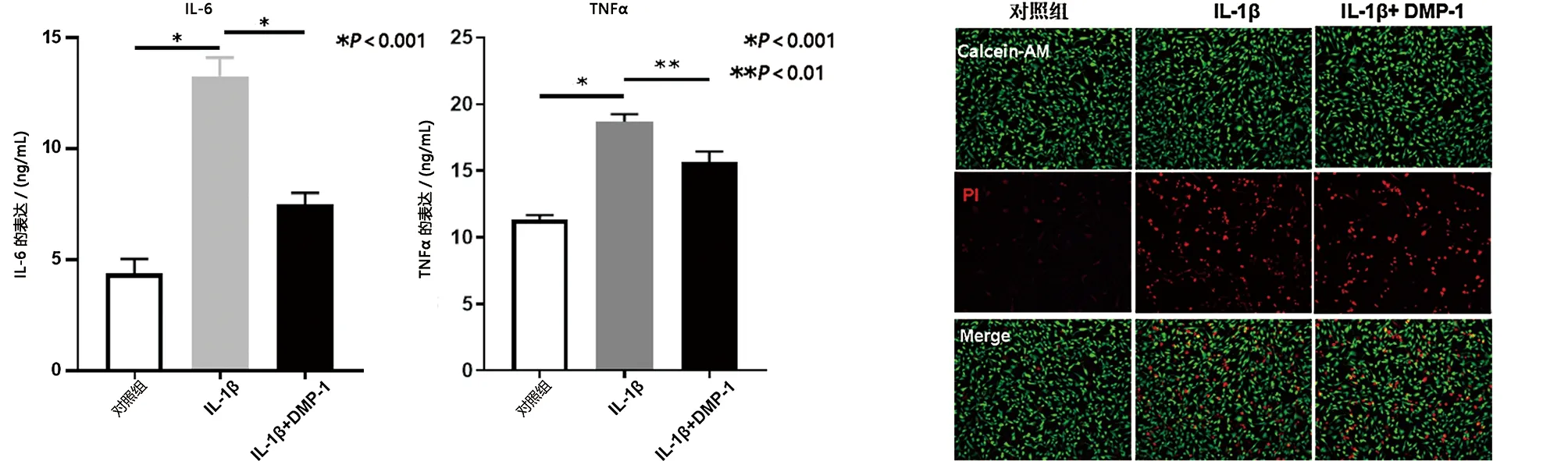
a 不同处理条件下IL-6、TNF-α表达水平 b Calcein-AM/PI染色检测细胞活力(免疫荧光,×200)
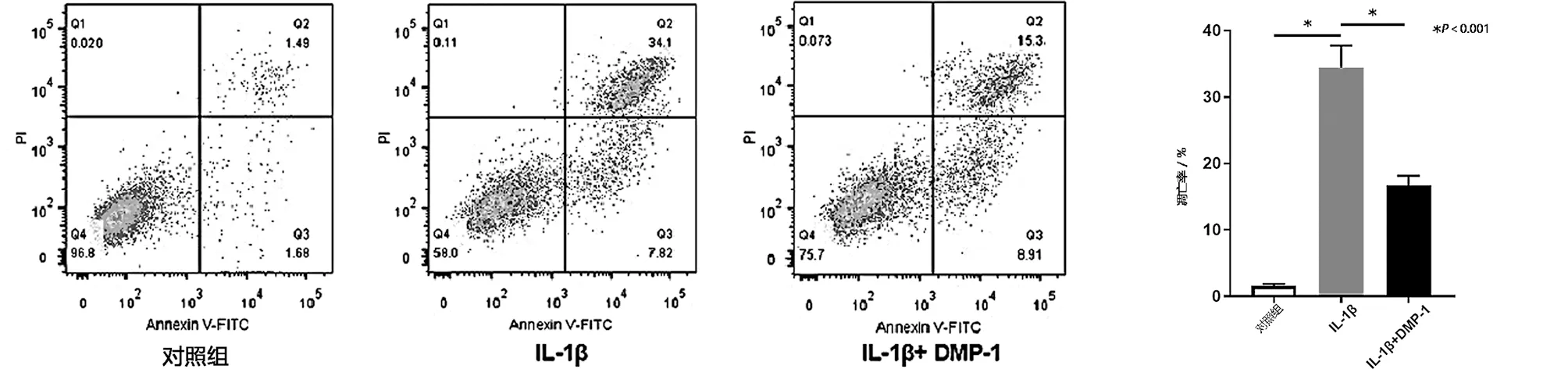
c 不同组软骨细胞凋亡率
3 讨 论
OA是关节最常见的疾病,其特征是关节软骨受损。关节软骨主要由软骨细胞和软骨基质组成。软骨细胞的主要功能是分泌ECM蛋白,例如Acan和Col2a1,以维持关节软骨的稳态[12]。软骨细胞功能的改变伴随着软骨基质的变性,并最终导致OA的发生和发展。保护或拯救软骨细胞的功能可有助于减轻OA的进展[13]。尽管有研究报道了OA软骨细胞潜在靶点和机制,但由于缺乏敏感性和特异性,因此探索OA软骨细胞新的靶点及发病机制显得刻不容缓。本研究发现DMP-1在OA软骨细胞中下调,DMP-1的过度表达减轻了IL-1β诱导的软骨细胞变性、炎症、细胞凋亡。因此,突出了DMP-1对OA软骨细胞的潜在作用,结果表明DMP-1可能是有治疗前景的OA新靶点。细胞外基质蛋白对软骨发育有重要调控作用。有研究表明DMP-1是软骨发育过程中特异性表达的基质蛋白,在DMP-1转基因小鼠的关节软骨层增厚,其软骨细胞数量增加,Sox9、Col Ⅱ、Col X、Acan等软骨细胞分化相关基因表达上调[14]。有学者研究表明,在OA患者的膝关节样本中观察到了DMP-1蛋白的分级特异性抑制,在半月板切除术诱导的OA模型中,Mankin评分的增加伴随着DMP-1表达的逐渐减少,DMP-1可能在维持软骨生成表型中发挥重要作用,并可能参与骨关节炎等疾病条件下软骨基质重构和降解的改变[15-16]。另外有学者研究DMP-1可通过降低氧化应激和抑制转化生长因子(transforming growth factor,TGF)-β信号通路激活来减缓大鼠糖尿病肾病损伤的病理过程,保护肾脏[16]。
在本研究中,DMP-1在OA的软骨细胞中表达降低,这表明DMP-1参与了OA的发病。在正常情况下软骨基质的合成和分解处于一个动态平衡中,转录因子Sox9是维持软骨细胞表型的重要分子,能激活一系列下游信号分子,以促进Col2a1、Acan和GAG的沉积[17]。在OA患者中有许多炎症因子如IL-1β、IL-6和TNF-α可以抑制Sox9的表达并降低软骨的细胞外基质[18]。所以降低炎症水平和恢复软骨细胞的稳态是延缓OA进展的重要措施。本研究中用IL-1β处理的软骨细胞,观察到炎症刺激降低了GAG的水平,而DMP-1的过表达恢复了GAG的沉积。DMP-1的过表达降低了IL-1β对软骨细胞中Sox9、Acan和Col2a1表达的抑制作用。此外,DMP-1过表达可以减轻IL-6和TNF-α的水平,同时抑制IL-1β处理的软骨细胞的凋亡。这些结果表明,DMP-1对软骨细胞稳态、炎症和细胞凋亡均具有保护作用。
综上所述,DMP-1在OA中表达降低,并且与OA的进展有关。本研究发现DMP-1参与了软骨细胞的动态平衡,DMP-1的过表达恢复了OA中软骨细胞的表型、减轻了炎症和细胞凋亡。因此,DMP-1可能是OA研究和治疗中的潜在重要靶点。

