半乳糖凝集素3对肺癌细胞生物学行为和免疫相关因子的影响及可能机制▲
陈耀华 豆亚伟
(陕西省人民医院胸外科,陕西省西安市 710068)
肺癌是病死率极高的恶性肿瘤,占所有癌症类型的26%~29%,其中肺腺癌是肺癌最常见的类型[1]。研究显示,免疫抑制在肺癌的发生和发展过程中起着重要的作用,肿瘤细胞可以通过分泌白细胞介素6(interleukin 6,IL-6)、转化生长因子β1(transforming growth factor β1,TGF-β1)等因子促进肿瘤转移并抑制免疫细胞活性[2-3]。Notch通路可介导肺癌细胞的免疫抑制,与肺癌的发生和发展密切相关[4]。半乳糖凝集素-3(galectin-3,Gal-3)具有交联和聚集整联蛋白的能力,其不但可以调控细胞的增殖和凋亡,还可通过与整合素共同作用来介导细胞的迁移[5]。临床研究显示,Gal-3的高表达与肺癌患者复发风险增加有关[6]。还有研究显示,口服活性Gal-3拮抗剂可以抑制肺癌的进展[7]。这些研究均提示Gal-3参与了肺癌的发生和发展,且与预后密切相关,但是其对肺癌进展的调控机制仍不清楚。故本文探讨Gal-3对肺癌细胞生物学行为及免疫相关因子的影响,并基于Notch信号通路分析其可能的作用机制。
1 材料与方法
1.1 主要实验材料 人肺癌细胞A549(美国ATCC®CCL-185),胎牛血清和链-青霉素(Invitrogen公司,批号:20200612、20200709),DMEM(Thermo Fisher Scientific公司,批号:20210116007)。Gal-3过表达质粒及阴性对照质粒(上海吉玛制药技术有限公司,批号:200315001、200402003),LipofectamineTM2000试剂盒(Invitrogen公司,批号:20021809),Notch信号通路抑制剂LY450139(Selleck公司,批号:191209004),Gal-3一抗、Notch受体1(Notch receptor 1,NOTCH1)一抗、Gal-3和NOTCH1相应二抗(Abcam公司,批号:191106003、200123009、200322008、191226011),硝酸纤维素膜(Millipore公司,批号:200112002),ECL 显色试剂盒(Thermo Fisher Scientific公司,批号:19110302),Annexin Ⅴ-FITC试剂盒和碘化丙啶试剂盒(YEASEN公司,批号:190912003、200423021)。TRIzol试剂和RNAspin Mini试剂盒(QIAGEN GmbH公司,批号:200413、200510),SYBR Premix Ex TaqTM试剂盒(TaKaRa公司,批号:200318001)。流式细胞仪(BD公司,型号:BD-FACSAriaTMFusion),基质胶和Transwell装置(Corning公司,批号:20200112、20200203),光学显微镜(Olympus公司,型号:BX53)。
1.2 细胞分组和转染 将A549细胞接种于含有10%胎牛血清、0.1 mg/mL链霉素和100 U/mL青霉素的完全DMEM,置于37 ℃、95%湿度、5% CO2培养箱中培养。取对数生长期A549细胞,以5×105个/孔的密度接种在96孔板中,当细胞融合度达到60%后,将A549细胞分为4组,即对照组(转染阴性对照质粒)、Gal-3组(转染Gal-3过表达质粒)、LY450139组(给予2 μL终浓度为20 nmol/L的Notch信号通路抑制剂LY450139处理)、Gal-3+LY450139组(转染Gal-3过表达质粒,并给予2 μL终浓度为20 nmol/L的LY450139处理)。转染操作过程均严格根据LipofectamineTM2000试剂盒说明书进行。
1.3 观察指标的检测方法
1.3.1 Western blot检测Gal-3和NOTCH1蛋白表达水平:取转染72 h后的各组细胞,裂解后于4 ℃下12 000 r/min离心5min,收集总蛋白。取40 μg蛋白,通过10% SDS-PAGE分离等量蛋白,然后将其转移到硝酸纤维素膜上。加入5%脱脂牛奶室温封闭2 h,TBST洗膜3次,5 min/次,加入5 μL Gal-3一抗、5 μL NOTCH1一抗(稀释比均为1 ∶1 000),4 ℃孵育8 h,TBST洗膜3次,5 min/次,然后加入5 μL相应二抗(稀释比均为1 ∶2 000),室温孵育1 h,TBST洗膜3次,5 min/次。利用ECL显色试剂盒对条带进行显影。以GAPDH(稀释比为1 ∶10 000)作为内参,采用ImageJ软件分析Gal-3和NOTCH1蛋白的相对表达水平。实验重复3次。
1.3.2 CCK-8法检测细胞增殖活力:取转染72 h后的各组细胞,以5×105个/孔的密度接种到96孔板中,置于37 ℃、95%湿度、5% CO2培养箱,分别孵育24 h、48 h后加入10 μL CCK-8溶液,继续孵育2 h。采用酶标仪检测450 nm波长处的光密度值。实验重复3次。
1.3.3 流式细胞术检测细胞凋亡率:将转染72 h后的各组细胞用1×PBS洗涤并悬浮在100 μL结合缓冲液中。加入5 μL Annexin Ⅴ-FITC和10 μL碘化丙啶,室温下避光孵育10~15 min,加入400 μL结合缓冲液,在1 h内利用流式细胞仪检测细胞凋亡率。实验重复3次。
1.3.4 Transwell法检测细胞侵袭能力:将基质胶(稀释比为1 ∶8)加入Transwell小室的上室并在 37 ℃下孵育30 min。将600 μL完全DMEM加入Transwell小室的下室。取转染72 h后的各组细胞,于无血清培养基中37 ℃下培养24 h进行饥饿处理。使用胰酶消化后,将100 μL 细胞溶液(5×105个/mL)接种于水合的 Transwell 小室上室中,置于37 ℃、95%湿度、5% CO2培养箱中培养24 h后,洗去未侵入的细胞。用95%乙醇固定侵入下室的细胞,用0.1%结晶紫在室温下染色20 min。置于显微镜下观察,随机选取5个高倍视野(×400)进行细胞计数,取平均值。实验重复3次。
1.3.5 实时荧光定量PCR检测IL-6和TGF-β1的mRNA表达水平:取转染72 h后的各组细胞,使用TRIzol试剂提取细胞总RNA,用分光光度计检测RNA的浓度和纯度。使用RNAspin Mini试剂盒进行反转录,使用 SYBR Premix Ex TaqTM进行实时荧光定量PCR反应。IL-6上游引物序列为5′-TCAATGAGGAGACTTGCCTG-3′,下游引物序列为5′-GATGAGTTGTCATGTCCTGC-3′;TGF-β1上游引物序列为5′-CACCCGCGTGCTAATGG-3′,下游引物序列为5′-ATGCTGTGTGTACTCTGCTTGAACT-3′;内参GAPDH上游引物序列为5′-AGGTCGGTGTGAACGGATTTG-3′,上游引物序列为5′-TGTAGACCATGTAGTTGAGGTCA-3′。反应体系(共50 μL)包括SYBR Green染料10 μL、上游引物0.5 μL、下游引物0.5 μL、dNTP 0.5 μL、Taq酶1 μL、模板DNA 5 μL、ddH2O 32.5 μL。反应条件为95 ℃ 2 min预加热; 95 ℃ 2 min,58 ℃ 20 s,72 ℃ 20 s, 共40个循环。以GAPDH为内参,使用2-ΔΔCt法计算IL-6和TGF-β1的mRNA相对表达水平。实验重复3次。
1.4 统计学分析 采用SPSS 19.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用方差分析,进一步两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 4组A549细胞Gal-3和NOTCH1蛋白表达水平的比较 4组A549细胞Gal-3和NOTCH1蛋白表达水平的比较,差异均有统计学意义(均P<0.05)。其中,Gal-3组的Gal-3和NOTCH1蛋白表达水平高于对照组;LY450139组的Gal-3蛋白表达水平低于Gal-3组,NOTCH1蛋白表达水平低于对照组和Gal-3组;Gal-3+LY450139组的Gal-3蛋白表达水平高于对照组和LY450139组,NOTCH1蛋白表达水平低于Gal-3组,但高于LY450139组(均P<0.05),见图1、表1。

图1 各组细胞Gal-3和NOTCH1蛋白表达情况
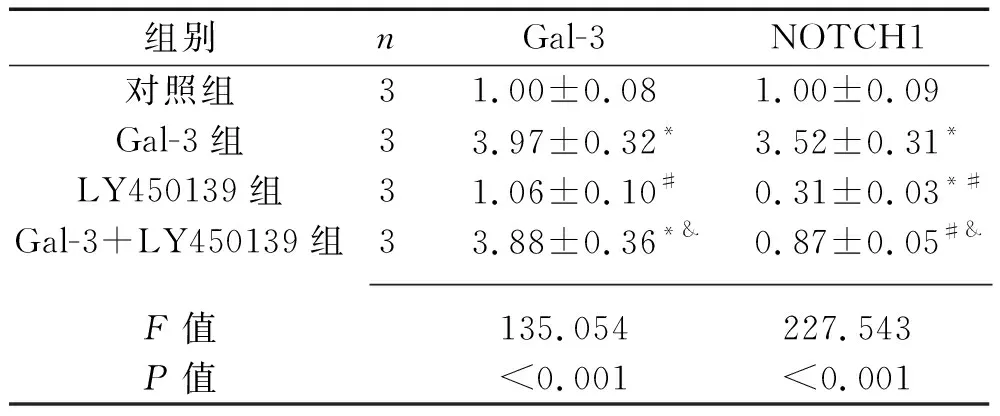
表1 4组A549细胞Gal-3和NOTCH1蛋白相对表达水平的比较(x±s)
2.2 4组A549细胞增殖活力的比较 孵育24 h、48 h后,4组A549细胞的增殖活力比较,差异均有统计学意义(均P<0.05)。其中孵育24 h、48 h后,Gal-3组的增殖活力均高于对照组,LY450139组的增殖活力低于对照组和Gal-3组,Gal-3+LY450139组的增殖活力低于Gal-3组,但高于LY450139组(均P<0.05)。见表2。

表2 4组A549细胞增殖活力的比较(x±s,光密度值)
2.3 4组A549细胞凋亡率的比较 4组A549细胞的凋亡率比较,差异有统计学意义(P<0.05)。其中,Gal-3组的凋亡率低于对照组,LY450139组的凋亡率高于对照组和Gal-3组,Gal-3+LY450139组的凋亡率高于Gal-3组,但低于LY450139组(均P<0.05)。见图2、表3。

对照组 Gal-3组 LY450139组 Gal-3+LY450139组

表3 4组A549细胞凋亡率的比较(x±s,%)
2.4 4组A540细胞侵袭能力的比较 4组A549细胞的侵袭能力比较,差异有统计学意义(P<0.05)。其中,Gal-3组的侵袭能力高于对照组,LY450139组的侵袭能力低于对照组和Gal-3组,Gal-3+LY450139组的侵袭能力低于Gal-3组,但高于LY450139组(均P<0.05)。见图3、表4。
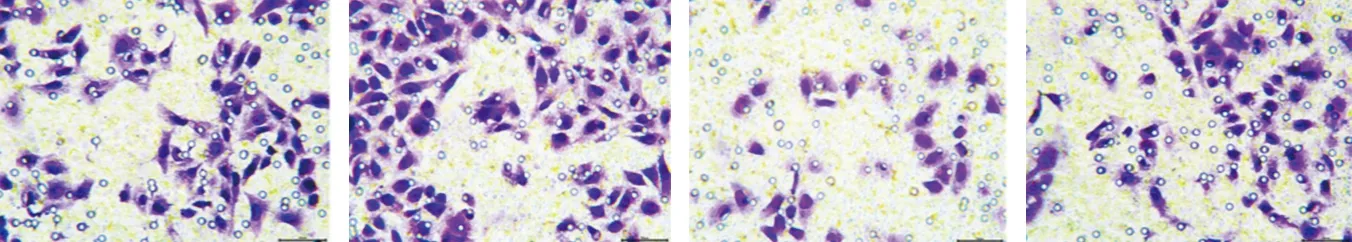
对照组 Gal-3组 LY450139组 Gal-3+LY450139组

表4 4组A549细胞侵袭能力的比较(x±s,个)
2.5 4组A549细胞免疫相关因子表达水平的比较 4组A549细胞的IL-6和TGF-β1 mRNA表达水平比较,差异均有统计学意义(均P<0.05)。其中,Gal-3组的IL-6和TGF-β1 mRNA表达水平高于对照组,LY450139组的IL-6和TGF-β1 mRNA表达水平低于对照组和Gal-3组,Gal-3+LY450139组的IL-6和TGF-β1 mRNA水平低于Gal-3组,但高于LY450139组(均P<0.05)。见表5。

表5 4组A549细胞免疫相关因子mRNA相对表达水平的比较(x±s)
3 讨 论
肺癌是全球癌症相关死亡的主要原因,全球每年新发肺癌患者约210万例,死于肺癌的患者约176万例,在所有恶性肿瘤中其发病率居于前列[8]。虽然近年来有新的治疗方法应用于临床,但肺癌患者的预后仍不尽如人意,其5年总体生存率仅为15%左右[9]。因此分析肺癌的发生和发展机制对于临床诊断和治疗肺癌具有重要意义。
Gal-3是一种由LGALS3基因编码的多功能蛋白,属于β-半乳糖苷结合蛋白家族成员。作为一种胞质蛋白,Gal-3能轻易穿过细胞质膜进入细胞核和线粒体,从而调节多种生物过程[10]。大量研究表明,Gal-3可以调控血管生成、免疫抑制和细胞运动等过程,在肿瘤进展过程中发挥重要作用[11-12]。还有研究显示,Gal-3在结直肠癌[13]、前列腺癌[14]、胰腺癌[15]等肿瘤中发挥介导免疫抑制和促进癌症进展的作用。临床研究显示,Gal-3表达水平与肺癌的转移有关[16]。体外研究显示,Gal-3抑制剂可以增强程序性死亡受体配体1阻断剂治疗肺癌的效果[17]。但关于Gal-3在肺癌中的作用机制研究仍较少。
为分析Gal-3对肺癌细胞生物学行为的影响,本研究构建了过表达Gal-3的肺癌细胞模型,结果显示,Gal-3组细胞的增殖活力和侵袭能力高于对照组,而凋亡率低于对照组(P<0.05),说明过表达Gal-3会促进肺癌细胞的增殖和侵袭,并抑制其凋亡,提示Gal-3具有促进肺癌进展的作用。IL-6可促进肺癌细胞的转移和侵袭[18]。TGF-β1不但会促进肺癌细胞的上皮-间充质转化[19],还会抑制淋巴细胞分化,降低免疫细胞活性,从而增强肿瘤细胞的免疫抑制,促进肿瘤进展[20]。本研究中,Gal-3组细胞的IL-6和TGF-β1 mRNA表达水平均高于对照组(均P<0.05),提示Gal-3可抑制免疫相关因子IL-6和TGF-β1的表达,增强肿瘤细胞的免疫抑制,从而促进肿瘤的发展。
已有研究证实,Notch信号通路的激活会促进肺癌的进展,NOTCH1蛋白表达水平升高与肺癌患者的预后不良有关[21]。NOTCH1蛋白是一种转录因子,其不但会促进增殖和转移相关蛋白的转录,还可以提高IL-6和TGF-β1等免疫相关因子的表达水平[22]。研究显示,Gal-3表达水平降低会抑制Notch通路,并干扰B淋巴细胞的分化[23]。此外,Gal-3可通过激活Notch信号通路促进血管生成,从而促进肿瘤进展[24]。为进一步分析Gal-3促进肺癌进展的作用机制,本研究检测了Gal-3对Notch通路的调控作用,以及该作用对肺癌细胞生物学行为和免疫相关因子表达水平的影响。结果显示,Gal-3组的NOTCH1蛋白表达水平高于对照组(P<0.05),说明过表达Gal-3可以促进NOTCH1蛋白的表达水平,对Notch信号通路具有一定调控作用。而Gal-3+LY450139组细胞的NOTCH1蛋白水平、增殖活力、侵袭能力、IL-6和TGF-β1 mRNA水平均低于Gal-3组但高于LY450139组,凋亡率高于Gal-3组,但低于LY450139组(均P<0.05),说明使用LY450139抑制Notch通路,可以抑制A549细胞的增殖、侵袭能力及IL-6、TGF-β1的表达,促进A549细胞的凋亡,阻断Gal-3的促癌作用,这也提示Gal-3可能通过调控Notch信号通路来促进肺癌细胞的生物学行为及增强肺癌细胞的免疫抑制。
综上所述,Gal-3可能通过调控Notch信号通路来提高肺癌细胞的增殖和侵袭能力,并促进免疫相关因子IL-6和TGF-β1的表达,从而参与肺癌的进展。Gal-3可能成为治疗肺癌的新靶点。

